20 bài tập Xác định biến thiên Enthalpy phản ứng dựa vào năng lượng liên kết (có lời giải)
20 câu hỏi
Cho phản ứng sau: CH≡CH(g) + 2H2(g) ![]() CH3–CH3
CH3–CH3
Năng lượng liên kết (kJ/mol) của H–H là 436, của C–C là 347, của C–H là 414 và của C≡C là 839. Tính nhiệt (∆H) của phản ứng và cho biết phản ứng thu nhiệt hay tỏa nhiệt.
Cho phản ứng hydrogen hóa ethylene sau:
CH2=CH2(g) + H2(g) ![]() CH3–CH3(g)
CH3–CH3(g)
Biết năng lượng liên kết trong các chất cho trong bảng sau:
Liên kết | Phân tử | Eb (kJ/mol) | Liên kết | Phân tử | Eb (kJ/mol) |
C=C | C2H4 | 612 | C–C | C2H6 | 346 |
C–H | C2H4 | 418 | C–H | C2H6 | 418 |
H–H | H2 | 436 |
|
|
|
Biến thiên enthalpy (kJ/mol) của phản ứng có giá trị là
134.
–134.
478.
284.
Cho phản ứng đốt cháy butane sau:
C4H10(g) + 13/2O2(g) ![]() 4CO2(g) + 5H2O(g) (1)
4CO2(g) + 5H2O(g) (1)
Bảng năng lượng liên kết trong các hợp chất cho trong bảng sau:
Liên kết | Phân tử | Eb (kJ/mol) | Liên kết | Phân tử | Eb (kJ/mol) |
C–C | C4H10 | 346 | C=O | CO2 | 799 |
C–H | C4H10 | 418 | O–H | H2O | 467 |
O=O | O2 | 495 |
|
|
|
Xác định biến thiên enthalpy của (![]() ) của phản ứng (1).
) của phản ứng (1).
Phản ứng tổng hợp ammonia (NH3): N2(g) + 3H2(g) ![]() 2NH3(g) ∆H = –92 kJ.
2NH3(g) ∆H = –92 kJ.
Biết năng lượng liên kết (kJ/mol) của N≡N và H–H lần lượt là 946 và 436. Năng lượng liên kết của N–H trong ammonia là
391 kJ/mol.
361 kJ/mol.
245 kJ/mol.
490 kJ/mol.
Trong ngành công nghệ lọc hóa dầu, các alkane thường được loại bỏ hydrogen trong các phản ứng dehydro hóa để tạo ra những sản phẩm hydrocarbon không no có nhiều ứng dụng trong công nghiệp. Hãy tính biến thiên enthalpy chuẩn của các phản ứng sau dựa vào năng lượng liên kết. (Giá trị một số năng lượng liên kết được cho trong bảng phụ lục 2).
a) CH3–CH2–CH2–CH3 ![]() CH2=CH–CH=CH2 + 2H2
CH2=CH–CH=CH2 + 2H2
b) 6CH4 ![]() C6H6 (1,3,5-cyclohexatriene) + 9H2
C6H6 (1,3,5-cyclohexatriene) + 9H2
Cho biết công thức cấu tạo của 1,3,5-cyclohexatriene như sau:

Các phản ứng trên có thuận lợi về phương diện nhiệt hay không? Phản ứng theo chiều ngược lại có biến thiên enthalpy bằng bao nhiêu?
Bằng cách tính biến thiên enthalpy chuẩn của quá trình dựa vào năng lượng liên kết (số liệu bảng phụ lục 1), hãy chỉ ra ở điều kiện chuẩn, CH3–CH2–OH hay CH3–O–CH3 bền hơn.
CH3–CH2–OH(g) ![]() CH3–O–CH3(g)
CH3–O–CH3(g)
Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:
Liên kết | C–H | C–C | C=C |
Eb (kJ/mol) | 418 | 346 | 612 |
Biến thiên enthalpy của phản ứng: C3H8(g) ![]() CH4(g) + C2H4(g) có giá trị là
CH4(g) + C2H4(g) có giá trị là
+103 kJ.
–103 kJ.
+80 kJ.
–80 kJ.
Biết CH3COCH3 có công thức cấu tạo: ![]() . Từ số liệu năng lượng liên kết ở bảng phụ lục 1, hãy xác định biến thiên enthalpy của phản ứng đốt cháy acetone (CH3COCH3):
. Từ số liệu năng lượng liên kết ở bảng phụ lục 1, hãy xác định biến thiên enthalpy của phản ứng đốt cháy acetone (CH3COCH3):
CH3COCH3(g) + 4O2(g) ![]() 3CO2(g) + 3H2O(g)
3CO2(g) + 3H2O(g)
Propene là nguyên liệu cho sản xuất nhựa polypropylene (PP). PP được sử dụng để sản xuất các sản phẩm ống, màng, dây cách điện, kéo sợi, đồ gia dụng và các sản phẩm tạo hình khác. Phản ứng tạo thành propene tử propyne:
CH3–C≡CH(g) + H2(g) ![]() CH3–CH=CH2(g)
CH3–CH=CH2(g)
Hãy xác định số liên kết C–H; C–C; C≡C trong hợp chất CH3–C≡CH (propyne).
Propene là nguyên liệu cho sản xuất nhựa polypropylene (PP). PP được sử dụng để sản xuất các sản phẩm ống, màng, dây cách điện, kéo sợi, đồ gia dụng và các sản phẩm tạo hình khác. Phản ứng tạo thành propene tử propyne:
CH3–C≡CH(g) + H2(g) ![]() CH3–CH=CH2(g)
CH3–CH=CH2(g)
Từ năng lượng của các liên kết (Bảng phụ lục 1), hãy tính biến thiên enthalpy của phản ứng tạo thành propene trên.
Tính nhiệt tạo thành chuẩn của HF và NO dựa vào năng lượng liên kết (Bảng phụ lục 1). Giải thích sự khác nhau về nhiệt tạo thành của HF và NO.
Chloromethane (CH3Cl), còn được gọi là methyl chloride, Refrigerant–40 hoặc HCC 40. CH3Cl từng được sử dụng rộng rãi như một chất làm lạnh. Hợp chất khí này rất dễ cháy, có thể không mùi hoặc mùi thơm nhẹ. Từ năng lượng của các liên kết (Bảng phụ lục 1), hãy tính biến thiên enthalpy của phản ứng tạo thành chloromethane: CH4(g) + Cl2(g) ![]() CH3Cl(g) + HCl(g)
CH3Cl(g) + HCl(g)
Cho biết phản ứng dễ dàng xảy ra dưới ánh sáng mặt trời. Kết quả tính có mâu thuẫn với khả năng dễ xảy ra của phản ứng không?
Cho phản ứng phân hủy hydrazine: N2H4(g) ![]() N2(g) + 2H2(g)
N2(g) + 2H2(g)
Tính ![]() theo năng lượng liên kết của phản ứng trên (giá trị năng lượng liên kết cho ở bảng phụ lục 1).
theo năng lượng liên kết của phản ứng trên (giá trị năng lượng liên kết cho ở bảng phụ lục 1).
Cho phản ứng phân hủy hydrazine: N2H4(g) ![]() N2(g) + 2H2(g)
N2(g) + 2H2(g)
Hydrazine (N2H4) là chất lỏng ở điều kiện thường (sôi ở 114 0C, khối lượng riêng 1,021 g/cm3). Hãy đề xuất lí do N2H4 được sử dụng làm nhiên liệu trong động cơ tên lửa.
Cho biết năng lượng liên kết trong các phân tử O2, N2 và NO lần lượt là 494 kJ/mol, 945 kJ/mol và 607 kJ/mol.
Tính biến thiên enthalpy chuẩn của phản ứng: N2(g) + O2(g) ![]() 2NO(g).
2NO(g).
Cho biết năng lượng liên kết trong các phân tử O2, N2 và NO lần lượt là 494 kJ/mol, 945 kJ/mol và 607 kJ/mol.
Giải thích vì sao nitrogen chỉ phản ứng với oxygen ở nhiệt độ cao hoặc khi có tia lửa điện.
Tính ![]() của các phản ứng sau dựa theo năng lượng liên kết (sử dụng số liệu từ bảng phụ lục 1):
của các phản ứng sau dựa theo năng lượng liên kết (sử dụng số liệu từ bảng phụ lục 1):
N2H4(g) ![]() N2(g) + 2H2(g)
N2(g) + 2H2(g)
Tính ![]() của các phản ứng sau dựa theo năng lượng liên kết (sử dụng số liệu từ bảng phụ lục 1):
của các phản ứng sau dựa theo năng lượng liên kết (sử dụng số liệu từ bảng phụ lục 1):
4HCl(g) + O2(g) ![]() 2Cl2(g) + 2H2O(g)
2Cl2(g) + 2H2O(g)
Phosgene là chất khí không màu, mùi cỏ mục, dễ hóa lỏng; khối lượng riêng 1,420 g/cm3 (ở 0 0C); ts = 8,2 0C. Phosgene ít tan trong nước; dễ tan trong các dung môi hữu cơ, bị thủy phân chậm bằng hơi nước; không cháy; là sản phẩm công nghiệp quan trong; dùng trong tổng hợp hữu cơ để sản xuất sản phẩm nhuộm, chất diệt cỏ, polyurethane,… Phosgene là một chất đọc. Ở nồng độ 0,005 mg/L đã nguy hiểm đối với người; trong khoảng 0,1 – 0,3 mg/L, gây tử vong sau 15 phút.
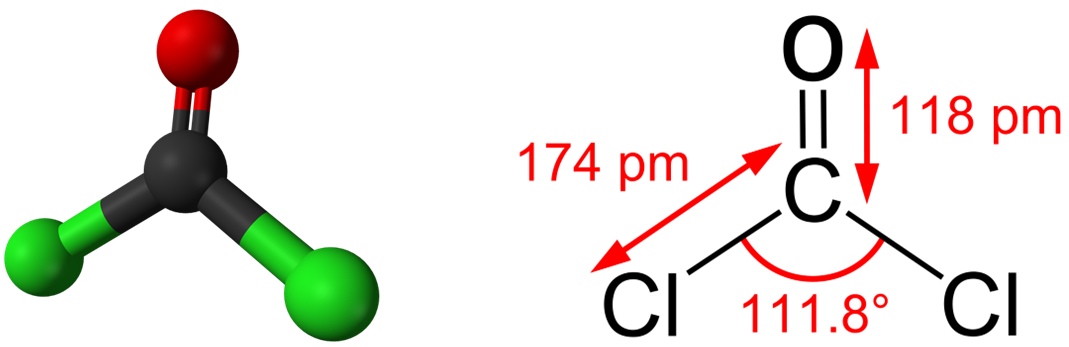
Phosgene được điều chế bằng cách cho hỗn hợp CO và Cl2 đi qua than hoạt tính. Dựa vào năng lượng liên kết (Bảng phụ lục 1), hãy tính biến thiên enthalpy của phản ứng tạo thành phosgene ừ CO và Cl2.
Tính ![]() cho phản ứng sau dựa vào năng lượng liên kết:
cho phản ứng sau dựa vào năng lượng liên kết:
CH4(g) + X2(g) ![]() CH3X(g) + HX(g)
CH3X(g) + HX(g)
Với X = F, Cl, Br, I. Liên hệ giữa mức độ phản ứng (dựa theo ![]() ) với tính phi kim (F > Cl > Br > I). Tra các giá trị năng lượng liên kết ở bảng phụ lục 1.
) với tính phi kim (F > Cl > Br > I). Tra các giá trị năng lượng liên kết ở bảng phụ lục 1.








