Trắc nghiệm tổng hợp ôn thi tốt nghiệp THPT môn Hóa Bài 15. Tách kim loại và tái chế kim loại có đáp án
28 câu hỏi
Trong vỏ Trái Đất, kim loại nào sau đây có thể tồn tại ở dạng đơn chất?
\({\rm{Na}},{\rm{Mg}}.\)
\({\rm{Al}},{\rm{Fe}}.\)
\({\rm{Cu}},{\rm{Zn}}.\)
\({\rm{Ag}},{\rm{Au}}.\)
Ion kim loại nào sau đây có nhiều nhất trong nước biển?
\({\rm{M}}{{\rm{g}}^{2 + }}.\)
\({{\rm{K}}^ + }.\)
\({\rm{N}}{{\rm{a}}^ + }.\)
\({\rm{C}}{{\rm{a}}^{2 + }}.\)
Hai nguyên tố kim loại phổ biến nhất trong vỏ Trái Đất là
\({\rm{Mg}},{\rm{Ca}}.\)
\({\rm{Na}},{\rm{Ca}}.\)
Au, Ag.
\({\rm{Al}},{\rm{Fe}}.\)
Nhôm \(({\rm{Al}})\) là nguyên tố phổ biến thứ ba (sau oxyen và silicon) và là kim loại phổ biến nhất trong vỏ Trái Đất. Nhôm chiếm khoảng 17% khối lớp rắn của Trái Đất. Trong tự nhiên, quặng chính chứa nhôm là bauxite và quặng này là nguyên liệu chính để sản xuất nhôm trong công nghiệp. Thành phần chính của quặng bauxite là
\({\rm{N}}{{\rm{a}}_3}{\rm{Al}}{{\rm{F}}_6}.\)
\({\rm{A}}{{\rm{l}}_2}{{\rm{O}}_3}.2{{\rm{H}}_2}{\rm{O}}.\)
\({\rm{KAl}}{\left( {{\rm{S}}{{\rm{O}}_4}} \right)_2} \cdot 12{{\rm{H}}_2}{\rm{O}}.\)
\({{\rm{K}}_2}{\rm{O}} \cdot {\rm{A}}{{\rm{l}}_2}{{\rm{O}}_3} \cdot 6{\rm{Si}}{{\rm{O}}_2}.\)
Nguyên tắc chung để điều chế kim loại từ hợp chất của chúng là
khử cation kim loại thành kim loại.
oxi hoá ion kim loại thành kim loại.
oxi hoá kim loại thành ion kim loại.
khử kim loại thành ion kim loại.
Gang và thép là hai hợp kim quan trọng nhất của sắt. Chúng có rất nhiều ứng dụng trong đời sống và sản xuất. Để sản xuất gang, người ta khử oxide của sắt \(\left( {{\rm{F}}{{\rm{e}}_2}{{\rm{O}}_3}} \right.\) hoặc \({\rm{F}}{{\rm{e}}_3}{{\rm{O}}_4}\)) trong quặng sắt bằng khí CO (được tạo ra do đốt cháy than cốc). Sắt được tạo ra trong quá trình sản xuất gang bằng phương pháp nào?
Kết tinh.
Nhiệt luyện.
Thuỷ luyện.
Chiết.
Kim loại kẽm (zinc, Zn) được sản xuất trong công nghiệp từ quặng sphalerite (có thành phần chính là ZnS) theo sơ đồ:
Phương pháp điều chế kim loại nào đã được sử dụng trong quá trình sản xuất zinc theo sơ đồ trên?
Thuỷ luyện.
Nhiệt luyện.
Điện phân.
Kết tinh.
Vàng (Au) tồn tại trong tự nhiên ở dạng đơn chất. Tuy nhiên, hàm lượng Au trong quặng hoặc trong đất thường rất thấp vì vậy rất khó tách Au bằng phương pháp cơ học. Trong công nghiệp, người ta tách vàng từ quặng theo sơ đồ sau:
Quặng chứa vàng
Phương pháp điều chế kim loại nào đã được sử dụng trong quá trình sản xuất vàng theo sơ đồ trên?
Thuỷ luyện.
Nhiệt luyện.
Điện phân.
Chiết.
Nhôm (Al) là kim loại có nhiều ứng dụng trong đời sống và sản xuất. Trong công nghiệp, Al được sản xuất từ quặng bauxite theo sơ đồ sau:
Quặng bauxite
Phương pháp nào đã được sử dụng trong quá trình khử \({\rm{A}}{{\rm{l}}_2}{{\rm{O}}_3}\) thành Al ?
Thuỷ luyện.
Nhiệt luyện.
Điện phân nóng chảy.
Điện phân dung dịch.
Dãy nào sau đây gồm những kim loại điều chế được bằng phương pháp thuỷ luyện?
\({\rm{Ca}},{\rm{Fe}},{\rm{Cu}}.\)
\({\rm{Ag}},{\rm{Au}},{\rm{Cu}}.\)
\({\rm{Al}},{\rm{K}},{\rm{Mg}}.\)
\({\rm{Na}},{\rm{Au}},{\rm{Pd}}.\)
Trong công nghiệp, dãy gồm những kim loại nào sau đây đều được sản xuất bằng phương pháp điện phân nóng chảy?
\({\rm{Na}},{\rm{Al}},{\rm{Mg}}.\)
\({\rm{Na}},{\rm{Al}},{\rm{Fe}}.\)
\({\rm{Cu}},{\rm{Fe}},{\rm{Au}}.\)
\({\rm{Ag}},{\rm{Mg}},{\rm{Zn}}.\)
Tái chế kim loại hiện là quá trình sử dụng nguyên liệu là phế thải kim loại để điều chế và sản xuất ra các vật liệu kim loại. Quy trình tái chế kim loại gồm nhiều giai đoạn. Hãy cho biết giai đoạn nào sau đây không có trong quá trình tái chế kim loại.
Thu gom và phân loại phế liệu.
Tạo vật liệu.
Tinh luyện kim loại.
Tinh chế quặng.
Kim loại nào sau đây không được tái chế trong công nghiệp?
Na.
Al.
Fe.
Cu.
Sắt \(({\rm{Fe}})\) là nguyên tố kim loại phổ biến trong vỏ Trái Đất, nó tồn tại ở dạng quặng chứa các khoáng vật như: magnetite \(\left( {{\rm{F}}{{\rm{e}}_3}{{\rm{O}}_4}} \right)\), hematite \(\left( {{\rm{F}}{{\rm{e}}_2}{{\rm{O}}_3}} \right)\), siderite \(\left( {{\rm{FeC}}{{\rm{O}}_3}} \right)\), pyrite \(\left( {{\rm{Fe}}{{\rm{S}}_2}} \right).\) Trong các khoáng vật trên, khoáng vật có hàm lượng Fe cao nhất là
magnetite \(\left( {{\rm{F}}{{\rm{e}}_3}{{\rm{O}}_4}} \right).\)
pyrite \(\left( {{\rm{Fe}}{{\rm{S}}_2}} \right).\)
siderite \(\left( {{\rm{FeC}}{{\rm{O}}_3}} \right).\)
hematite \(\left( {{\rm{F}}{{\rm{e}}_2}{{\rm{O}}_3}} \right).\)
a. Trong công nghiệp, nhôm được sản xuất bằng cách điện phân dung dịch \({\rm{AlC}}{{\rm{l}}_3}.\)
b. Cho mẫu nhỏ Na vào dung dịch \({\rm{CuS}}{{\rm{O}}_4}\), thu được chất rắn là kim loại Cu.
c. Tái chế kim loại là giải pháp giúp con người sử dụng hiệu quả hơn nguồn tài nguyên.
d. Tất cả hợp kim của sắt đều dễ bị ăn mòn trong không khí ẩm.
a. Việc tái chế nhôm giúp giảm giá thành sản phẩm.
b. Việc tái chế nhôm giúp giảm chất thải ra môi trường.
d. Đem cắt, băm nhỏ nhôm phế liệu để quá trình khử \({\rm{A}}{{\rm{l}}_2}{{\rm{O}}_3}\) xảy ra dễ hơn.
c. Không nên dùng nhôm tái chế để chế tạo dụng cụ nhà bếp và y tế.
Quá trình sản xuất gang từ nguyên liệu là quặng hematite, than cốc, chất chảy trong lò cao xảy ra các phản ứng chính:
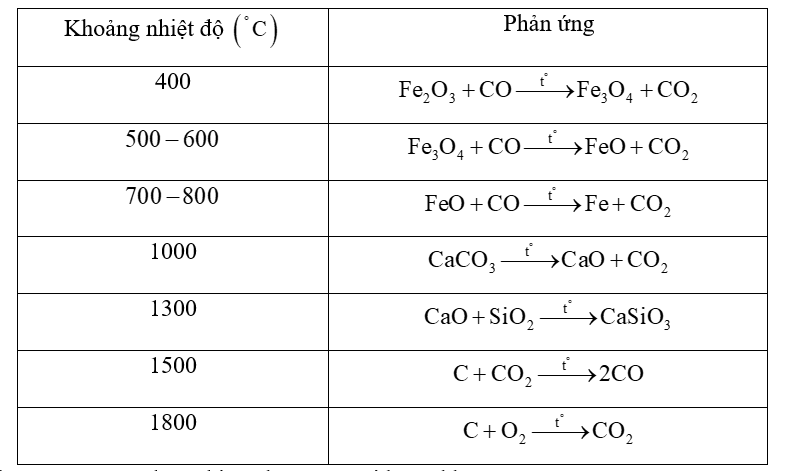
Trong các phản ứng trên có bao nhiêu phản ứng oxi hoá - khử?
Trong công nghiệp sản xuất nhôm từ quặng bauxite theo quy trình Hall Heroult được thực hiện theo sơ đồ:
Quặng bauxite Al
Theo tính toán, từ 4 tấn quặng tinh chế được 2 tấn \({\rm{A}}{{\rm{l}}_2}{{\rm{O}}_3}\) và thu được 1 tấn Al, đồng thời thải ra môi trường 1,574 tấn \({\rm{C}}{{\rm{O}}_2}.\) Nếu sử dụng 10000 tấn quặng thì lượng khí \({\rm{C}}{{\rm{O}}_2}\) thải ra môi trường là bao nhiêu tấn?
Quặng sắt là các khoáng vật chứa các hợp chất của sắt mà chủ yếu ở dạng các oxide. Hematite là một loại quặng chứa hàm lượng sắt cao và được dùng để trực tiếp sản xuất gang bằng cách nạp thẳng vào lò cao. Giả thiết \(90\% \) sắt trong quặng được chuyển vào gang. Từ 1000 tấn quặng hematite (có hàm lượng \(69,9\% {\rm{Fe}}\) ) có thể sản xuất được bao nhiêu tấn gang loại \(96\% {\rm{Fe}}\)? (Làm tròn kết quả đến hàng đơn vị)
Trong công nghiệp sản xuất gang ở nước ta hiện nay, muốn sản xuất ra 1 tấn gang cần phải sử dụng 1,7 đến 1,8 tấn quặng sắt, 0,6 đến 0,7 tấn đá vôi làm chất trợ dung, 0,6 đến 0,8 tấn than cốc. Giả thiết trong đá vôi \({\rm{CaC}}{{\rm{O}}_3}\) chiếm \(97\% \) khối lượng và \(90\% \) than cốc chuyển hoá thành \({\rm{C}}{{\rm{O}}_2}.\) Trong điều kiện sản xuất như trên, khi sản xuất được 1 tấn gang, nhà máy đã thải ra môi trường tối thiểu bao nhiêu \({{\rm{m}}^3}\) khí \({\rm{C}}{{\rm{O}}_2}\) ở điều kiện chuẩn? (Làm tròn kết quả đến hàng đơn vị)
Một loại quặng bauxite chứa khoảng \(48\% {\rm{A}}{{\rm{l}}_2}{{\rm{O}}_3}\) còn lại là các tạp chất khác. Để sản xuất nhôm, người ta phải tinh chế quặng để tạo \({\rm{r}}{{\rm{a}}_{{\rm{A}}{{\rm{l}}_2}{{\rm{O}}_3}}}\)rồi tiến hành điện phân nóng chảy \({\rm{A}}{{\rm{l}}_2}{{\rm{O}}_3}\) tạo ra Al . Tính khối lượng (tẩn) quăang bauxite cần dùng để sản xuất được 4 tấn nhôm. Giả thiết trong quá trình sản xuất chỉ có \(95\% \) lượng nhôm trong quặng chuyển hoá thành kim loại. (Làm tròn kết quả đến hàng phần mười)
Để mạ đồng một vật dụng kim loại có tổng diện tích bề mặt là \(10\;{\rm{c}}{{\rm{m}}^2}\), người ta tiến hành điện phân dung dịch \({\rm{CuS}}{{\rm{O}}_4}\) với cực âm là vật dụng cần mạ và cực dương là lá đồng thô. Biết cường độ dòng điện không đổi là 2 A, hiệu suất điện phân là \(90\% \), khối lượng riêng của tinh thể Cu là \(8,94\;{\rm{g}}/{\rm{c}}{{\rm{m}}^3}\) và lượng đồng tạo ra được tính theo công thức Faraday là \({\rm{m}} = \) A.I.t \(/{\rm{nF}}\) (với A là nguyên tử khối của \({\rm{Cu}} = 64;\)I là cường độ dòng điện, F là hằng số Faraday \( = 96485{\rm{C}}/{\rm{mol}}\), n là số electron mà 1 ion \({\rm{C}}{{\rm{u}}^{2 + }}\) nhận, \(t\) là thời gian điện phân tính bằng giây). Thời gian điện phân để lớp mạ có độ dày đồng nhất \(0,1\;{\rm{mm}}\) là bao nhiêu phút? (Làm tròn kết quả đến hàng đơn vị)



