Đề thi giữa kì 2 Hóa 10 Kết nối tri thức có đáp án ( Đề 1)
26 câu hỏi
A. Phần trắc nghiệm (7 điểm)
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 12. Mỗi câu hỏi thí sinh chỉ chọn một phương án. (2 điểm)
Trong phản ứng oxi hoá – khử, chất nhận electron được gọi là
chất khử.
chất oxi hoá.
acid.
base.
Trong các phản ứng hoá học sau, phản ứng oxi hoá – khử là
Ca(OH)2 + CuCl2 → Cu(OH)2↓ + CaCl2
Ca + Cl2 → CaCl2.
3CaCl2 + 2K3PO4 → Ca3(PO4)2 + 6KCl.
CaO + 2HCl → CaCl2 + H2O.
Những ngày nóng nực, pha viên sủi vitamin C vào nước để giải khát, khi viên sủi tan, thấy nước trong cốc mát hơn đó là do
xảy ra phản ứng tỏa nhiệt.
xảy ra phản ứng thu nhiệt.
xảy ra phản ứng trao đổi chất với môi trường.
có sự giải phóng nhiệt lượng ra ngoài môi trường.
Enthalpy tạo thành chuẩn của một đơn chất bền là
biến thiên enthalpy chuẩn của phản ứng giữa đơn chất đó với hydrogen.
là biến thiên enthalpy chuẩn của phản ứng giữa đơn chất đó với oxygen.
bằng 0.
được xác định từ nhiệt độ nóng chảy của nguyên tố đó.
Nhận xét nào sau đây về số oxi hoá là không đúng?
Số oxi hoá của một nguyên tử nguyên tố trong hợp chất là điện tích của nguyên tử nguyên tố đó với giả định đây là hợp chất ion.
Số oxi hoá của nguyên tử nguyên tố trong đơn chất bằng 0.
Số oxi hoá của oxygen luôn là -2.
Số oxi hoá của các kim loại kiềm trong hợp chất luôn là +1.
Trong phản ứng tạo thành magnesium chloride từ đơn chất: Mg + Cl2 → MgCl2.
Kết luận nào sau đây đúng?
Mỗi nguyên tử magnesium nhận 2e.
Mỗi nguyên tử chlorine nhận 2e.
Mỗi phân tử chlorine nhường 2e.
Mỗi nguyên tử magnesium nhường 2e.
Cho phản ứng: FeO + HNO3 ® Fe(NO3)3 + NO + H2O. Trong phản ứng này có bao nhiêu phân tử HNO3 đóng vai trò là chất oxi hóa?
1.
4.
8.
10.
Copper(II) oxide (CuO) bị khử bởi ammonia (NH3) theo phản ứng sau:
Tổng hệ số cân bằng (là số nguyên, tối giản) của chất tham gia phản ứng là
5.
12.
13.
14.
Phản ứng chuyển hoá giữa hai dạng đơn chất của phosphorus (P):
P (s, đỏ)⟶ P (s, trắng) = 17,6 kJ
Điều này chứng tỏ phản ứng:
thu nhiệt, P đỏ bền hơn P trắng.
thu nhiệt, P trắng bền hơn P đỏ.
toả nhiệt, P đỏ bền hơn P trắng.
toả nhiệt, P trắng bền hơn P đỏ.
Xét phản ứng đốt cháy methane:
CH4(g) + 2O2(g) ⟶ CO2(g) + 2H2O(l) = – 890,3 kJ
Biết nhiệt tạo thành chuẩn của CO2(g) và H2O(l) tương ứng là – 393,5 và – 285,8 kJ/mol. Nhiệt tạo thành chuẩn của khí methane là
– 74,8 kJ.
74,8 kJ.
– 211,6 kJ.
211,6 kJ.
Cho phản ứng sau:
= - 105 kJ
Biết ở điều kiện chuẩn: Eb(Cl-Cl) = 243 kJ/mol; Eb(C-Cl) = 339 kJ/mol; Eb(C=O) = 745 kJ/mol. Giá trị Eb(C ≡ O) là
1075 kJ/ mol.
105 kJ/ mol.
150 kJ/ mol.
107,5 kJ/ mol.
Biết phản ứng đốt cháy khí carbon monoxide (CO) như sau:
CO (g) + O2 (g) ⟶ CO2 (g)
Ở điều kiện chuẩn, nếu đốt cháy hoàn toàn 2,479 L khí CO thì nhiệt lượng toả ra là bao nhiêu?
283 kJ.
28,3 kJ.
-283 kJ.
-28,3 kJ.
a). Số oxi hóa của Mn trong KMnO4 là +7
b).Ở phản ứng trên SO2 đóng vai trò là chất oxi hóa.
c). Ở phản ứng trên MnSO4 đóng vai trò là chất bị khử.
d). Hệ số tối giản nhất của các chất tham gia ở phản ứng trên theo thứ tự là: 5:2:2.
a). Nhiệt tạo thành chuẩn của sulfur (s) và oxygen (g) đều bằng 0 kJ.mol-1;
b). Nhiệt tạo thành chuẩn của sulfur dioxide bằng -296,9 kJ.mol-1.
c). Biến thiên enthalpy chuẩn của phản ứng là 296,9 kJ.
d). 0,5 mol sulfur tác dụng hết với oxygen giải phóng 148,45kJ năng lượng dưới dạng nhiệt.
PHẦN III. Câu hỏi trắc nghiệm yêu cầu trả lời ngắn.Thí sinh trả lời từ câu 1 đến câu 4. (2 điểm)
Cho các phản ứng sau:
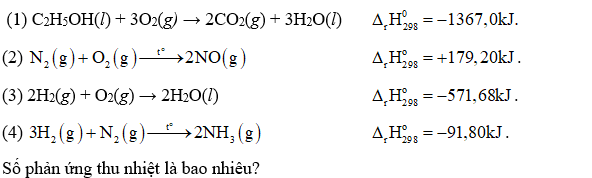
Cho phản ứng sau:
Biết nhiệt tạo thành chuẩn của CO2:
Nhiệt tạo thành chuẩn của CO là bao nhiêu kJ? (Làm tròn kết quả đến hàng đơn vị)
Cho phản ứng hóa học:
Fe3O4 + HNO3 ® Fe(NO3)3 + NO + H2O
Tổng hệ số cân bằng (là các số nguyên, tối giản) của các chất tham gia trong phản ứng là bao nhiêu?
Xét phản ứng trong giai đoạn đầu của quá trình Ostwald:
NH3 + O2 NO + H2O
Biết trong không khí chứa 21% thể tích oxygen và các thể tích khí đo ở cùng điều kiện nhiệt độ và áp suất. Trong công nghiệp, lượng thể tích không khí cần trộn với 1 thể tích khí ammonia để thực hiện phản ứng trên là bao nhiêu?
B. Phần tự luận (3 điểm)
Câu 1 (1,5 điểm):
a. Lập phương trình hoá học của phản ứng sau bằng phương pháp thăng bằng electron và chỉ rõ chất oxi hóa, chất khử:
SO2 + H2O + Cl2 → H2SO4 + HCl
b. Dẫn khí SO2 vào 100 mL dung dịch KMnO4 0,02M đến khi dung dịch vừa mất màu tím. Xác định thể tích khí SO2 đã tham gia phản ứng ở điều kiện chuẩn.
Câu 2 (1,5 điểm): Ammonia thường được tổng hợp từ nitrogen và hydrogen bằngquy trình Haber – Bosch:
N2 (g) + 3H2 (g) 2NH3 (g)
a. Biết các giá trị năng lượng liên kết sau: EN ≡ N = 945 kJ mol-1;EH – H = 436 kJ mol-1. Tính EN – H.
b. Tính enthalpy tạo thành chuẩn của NH3 (g).






