Đề kiểm tra Hóa 11 Cánh diều Chủ đề 2 có đáp án - Đề 1
28 câu hỏi
Tính chất nào sau đây của nitrogen không đúng?
Ở điều kiện thường, nitrogen là chất khí.
Nitrogen tan rất ít trong nước.
Nitrogen không duy trì sự cháy và sự hô hấp.
Nitrogen nặng hơn không khí.
Trong các phản ứng sau, phản ứng nào nitrogen đóng vai trò chất khử?
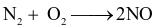 .
.
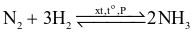 .
.
3Mg + N2 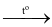 Mg3N2.
Mg3N2.
6Li + N2 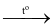 2Li3N.
2Li3N.
Nguyên tố hóahọc nàosau đây thuộc nhómVA trong bảng tuần hoàn các nguyên tố hoá học?
Nitrogen.
Chlorine.
Carbon.
Oxygen.
Khi tác dụng với hydrochloric acid, ammonia đóng vai trò là
acid.
base.
chất oxi hoá.
chất khử.
Ở trạng thái lỏng nguyên chất, phân tử chất nào sau đây tạo được liên kết hydrogen với nhau?
Nitrogen.
Ammonia.
Oxygen.
Hydrogen.
Nhiệt phân hoàn toàn muối nào sau đây thu được sản phẩm chỉ gồm khí và hơi?
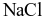 .
.
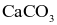 .
.
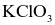 .
.
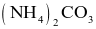 .
.
Phân biệt được đung dịch 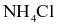 và
và 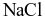 bằng thuốc thử là dung dịch
bằng thuốc thử là dung dịch
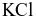 .
.
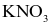 .
.
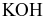 .
.
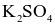 .
.
Nitrogen tác dụng với O2 (khoảng 3000oC) tạo ra
N2O5.
N2O3.
NO.
NO2.
Trong phân tử HNO3,nguyên tử N có:
hoá trị V, số oxi hoá +5.
hoá trị IV, số oxi hoá +5.
hoá trị V, số oxi hoá +4.
hoá trị IV, số oxi hoá +3.
Phú dưỡng là hiện tượng xảy ra do sự gia tăng hàm lượng của nguyên tố
Fe, Mn.
N, P.
Ca, Mg.
Cl, F.
Sulfur là chất rắn có màu
đỏ.
vàng.
không màu.
xanh.
Chất phản ứng ngay với bột sulfur ở điều kiện thường là
2.
O2.
Hg.
Fe.
Trong phản ứng: 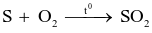 . Sulfur đóng vai trò là
. Sulfur đóng vai trò là
chất khử.
chất oxi hóa.
chất bị khử.
kim loại.
Cho hình vẽ mô tả thí nghiệm:
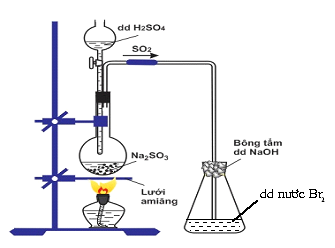
Hiện tượng xảy ra trong bình eclen (bình tam giác) chứa dung dịch nước Br2 là
có kết tủa xuất hiện.
dung dịch nước Br2 bị mất màu.
vừa có kết tủa vừa mất màu dung dịch nước Br2.
dung dịch nước Br2 không bị mất màu.
Để pha loãng dung dịch H2SO4 đặc, người ta dùng cách nào sau đây?
Rót nhanh dung dịch H2SO4 đặc vào nước.
Rót từ từ nước vào dung dịch H2SO4 đặc.
Rót từ từ dung dịch H2SO4 đặc vào nước, khuấy đều.
Rót nhanh nước vào H2SO4 đặc, đun nóng.
Acid H2SO4 loãng tác dụng với Fe tạo thành sản phẩm là
Fe2(SO4)3 và H2.
FeSO4 và H2.
FeSO4 và SO2.
Fe2(SO4)3 và SO2.
Các khí sinh ra trong thí nghiệm phản ứng của saccharose (C12H22O11) với dung dịch H2SO4 đặc bao gồm:
2S và CO2.
2S và SO2.
SO3 và CO2.
SO2 và CO2.
Để nhận biết anion có trong dung dịch K2SO4, không thể dùng thuốc thử nào sau đây?
Ba(OH)2.
BaCl2.
Ba(NO3)2.
MgCl2.
Xét các phát biểu sau về nitrogen.
(a) Nguyên tử nguyên tố nitrogen có cấu hình electron là 1s22s22p3.
(b) Ở trạng thái cơ bản, nguyên tử nitrogen có 3 electron hóa trị.
(c) Nguyên tố nitrogen thuộc chu kì 2, nhóm VA trong bảng tuần.
(d) Trong một số hợp chất, nguyên tử nitrogen có thể dùng cặp electron hóa trị riêng để tạo một liên kết cho – nhận với nguyên tử khác.
Cho các ứng dụng về ammonia.
(a) Trong công nghiệp, ammonia thường được sử dụng với vai trò chất làm lạnh (chất sinh hàn).
(b) Do có hàm lượng nitrogen cao nên ammonia được sử dụng làm phân đạm rất hiệu quả.
(c) Trong các gói snack thường được bơm khí ammonia để bảo quản.
(d) Quá trình tổng hợp ammonia từ nitrogen và hydrogen là quá trình thuận nghịch nên không thể đạt hiệu suất 100%.
Tiến hành thí nghiệm sau:
Bước 1: Cho khoảng 2 gam phân bón ammonium chloride vào ống nghiệm. Sau đó cho khoảng 2 mL nước cất vào ống nghiệm, lắc đều đến khi tan hết.
Bước 2: Cho khoảng 2 mL dung dịch NaOH đặc vào ống nghiệm, lắc đều rồi đun nóng nhẹ trên ngọn lửa đèn cồn.
Bước 3: Đặt mẫu giấy quỳ tím đã tẩm ướt lên miệng ống nghiệm đang đun.
(a) Thí nghiệm trên chứng minh muối ammonium chloride dễ tan trong nước ở nhiệt độ thường.
(b) Có thể sử dụng dung dịch kiềm để nhận biết ion .
.
(c) Mẫu giấy quỳ tím chuyển sang màu đỏ.
(d) Nếu thay ammonium chloride bằng ammonium sulfate, thì hiện tượng ở bước 3 vẫn tương tự.
Trong quy trình sản xuất sulfuric acid (H2SO4) có giai đoạn dùng dung dịch H2SO4 98% hấp thụ sulfur trioxide (SO2) thu được oleum (H2SO4.nSO3). Sulfur trioxide được tạo thành bằng cách oxi hoá sulfur dioxide bằng oxygen hoặc lượng dư không khí ở nhiệt độ 450°C – 500°C, chất xúc tác vanadium(V) oxide (V2O5) theo phương trình hoá học:
2SO2 (g)+ O2 (g) 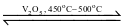 2SO3 (g);
2SO3 (g);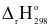 = −198,4 kJ;Kc = 40.
= −198,4 kJ;Kc = 40.
(a) Cân bằng hóa học trên sẽ chuyển dịch theo chiều thuận khi dùng dung dịch H2SO4 98% hấp thu SO3 sinh ra.
(b) Nếu tăng áp suất của hệ phản ứng và giữ nhiệt độ của hệ không đổi thì cân bằng của hệ chuyển dịch theo chiều nghịch.
(c) Nồng độ ban đầu của SO2 và O2 tương ứng là 4M và 2M. Khi đạt đến trạng thái cân bằng đã có 80% SO2 phản ứng.
(d) Nếu tỉ lệ nồng độ mol ban đầu của SO2 và O2 tương ứng là 1:10 thì khi đạt đến trạng thái cân bằng, hiệu suất phản ứng đạt khoảng 90%.
Cho các chất: Cu, Al, MgO, Fe3O4, Fe(OH)2, CaCO3, K2SO4 lần lượt tác dụng với dung dịch HNO3 loãng. Có bao nhiêu trường hợp xảy ra phản ứng oxi hóa – khử?
Cho phản ứng: aFe + bHNO3 → cFe(NO3)3 + dNO2↑ + eH2O. Hệ số tỉ lượng a, b, c, d, e là những số nguyên dương có tỉ lệ tối giản. Tổng (a + b) bằng bao nhiêu?
Trong công nghiệp thực phẩm, nitrogen lỏng (D = 0,808 g/mL) được phun vào vỏ bao bì trước khi đóng nắp để làm căng vỏ bao bì. Thể tích khí nitrogen thu được (đkc) khi hóa hơi 1 mL nitrogen lỏng là bao nhiêu mL?(Kết quả làm tròn đến hàng phần mười)
Nén hỗn hợp gồm 14 lít H2 và 3 lít N2 ở cùng điều kiện vào bình phản ứng có chứa một ít bột Fe. Sau một thời gian đưa bình về nhiệt độ ban đầu thu được 15,8 lít hỗn hợp khí. Hiệu suất của phản ứng tổng hợp NH3 là bao nhiêu %?
Hòa tan 12,8 gam Cu trong acid H2SO4 đặc, nóng, dư. Thể tích khí SO2 ở điều kiện chuẩn thu được là bao nhiêu lít?
Cho 10g hỗn hợp X gồm Fe và Cu tác dụng với dung dịch H2SO4 loãng dư. Sau phản ứng, thu được 2,479 lít khí H2 (đkc), dung dịch X và m gam kim loại không tan. Giá trị của m là?


