Bài tập ôn tập Hóa 11 Cánh diều Chủ đề 2 có đáp án
50 câu hỏi
Khi có sấm sét, nitrogen tác dụng với oxygen tạo ra?
NO2.
HNO3.
N2O.
NO.
Khi có tia lửa điện hoặc nhiệt độ cao. Nitrogen tác dụng trực tiếp với oxygen tạo ra hợp chất X. X tiếp tục tác dụng với oxygen trong không khí tạo thành hợp chất Y. Công thức của X, Y lần lượt là
N2O, NO.
NO2, N2O5.
NO, NO2.
N2O5, HNO3.
Ở -198oC, nitrogen tồn tại ở dạng nào?
Lỏng.
Khí.
Rắn.
Bán rắn.
Trong phản ứng tổng hợp ammonia:
N2(g) + 3H2(g)  2NH3(g); ∆rH < 0.
2NH3(g); ∆rH < 0.
Sẽ thu được nhiều khí NH3 nhất nếu:
Giảm nhiệt độ và áp suất.
Tăng nhiệt độ và áp suất.
Tăng nhiệt độ và giảm áp suất.
Giảm nhiệt độ và tăng áp suất.
Công thức hoá học của muối ammonium nitrate là
NH4NO2.
(NH4)2CO3.
NH4NO3.
(NH4)2SO4.
Hợp chất nàosauđây nitrogen cósố oxihoálà-3?
NO.
N2O.
HNO3.
NH4Cl.
Nhờ tạo được liên kết hydrogen với nước nên ammonia có tính chất nào sau đây?
Tính tan tốt trong nước.
Tính base yếu khi ở dạng dung dịch.
Tính khử khi tác dụng với một chất có tính oxi hóa.
Dễ bay hơi và có mùi khai, xốc.
Phản ứng tổng hợp ammonia:
N2 (g) + 3H2 (g)  2NH3 (g)
2NH3 (g) 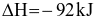
Biết năng lượng liên kết (kJ/mol) của 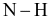 và
và  lần lượt là 391 và 436. Năng lượng liên kết của
lần lượt là 391 và 436. Năng lượng liên kết của  trong nitrogen là
trong nitrogen là
966 kJ/mol.
946 kJ/mol.
945 kJ/mol.
940 kJ/mol.
Người ta cho N2 và H2 vào trong bình kín dung tích không đổi và thực hiện phản ứng: N2 + 3H2  2NH3. Sau một thời gian phản ứng đạt trạng thái cân bằng, nồng độ các chất trong bình như sau: [N2] = 3M; [H2] = 4M; [NH3] = 2M. Nồng độ mol/L của N2 và H2 ban đầu lần lượt là
2NH3. Sau một thời gian phản ứng đạt trạng thái cân bằng, nồng độ các chất trong bình như sau: [N2] = 3M; [H2] = 4M; [NH3] = 2M. Nồng độ mol/L của N2 và H2 ban đầu lần lượt là
6 và 8.
4,5 và 8,5.
4 và 7.
5,5 và 7,5.
Vì sao nitrogen lỏng có thể được sử dụng để làm lạnh nhanh?
Vì nitrogen lỏng phá hủy cấu trúc vật chất, sinh ra chất làm lạnh.
Vì nitrogen lỏng làm chết vi khuẩn phân hủy vật chất.
Vì nitrogen hóa lỏng ở nhiệt độ rất thấp.
Vì nitrogen có tính oxy hóa vô cùng mạnh.
Cho4lítN2 và 13lítH2 vàobìnhrồithựchiệnphảnứngtổnghợpammoniathuđượchỗnhợpkhícóthểtích15,8 lít. (Giả thiết cáckhíđo ở cùngđiều kiện). Hiệu suất của phản ứng tổng hợp NH3 là
15%.
10%.
20%.
25%.
Các liên kết N-H trong phân tử ammonia là liên kết nào sau đây?
Cộng hóa trị phân cực.
Cộng hóa trị không phân cực.
Liên kết ion.
Liên kết cho – nhận.
Tính khử của NH3 do nguyên nhân nào sau đây?
NH3 tan được trong nước.
Phân tử có 3 liên kết cộng hóa trị phân cực.
Trong phân tử NH3, nguyên tử N có số oxi hóa thấp là -3.
NH3 có tính base yếu.
Phản ứng nào sau đây chứng minh ammonia có tính base?
4NH3(g) + 5O2(g)  4NO(g) + 6H2O(g).
4NO(g) + 6H2O(g).
4NO2(g) + 2H2O(l) + O2(g)  4HNO3(aq).
4HNO3(aq).
N2(g) + 3H2(g)  2NH3(g).
2NH3(g).
NH3(aq) + HCl(aq)  NH4Cl(aq).
NH4Cl(aq).
Phát biểu nào sau đây không đúng?
Trong điều kiện thường, NH3 là khí không màu, mùi khai.
Khí NH3 nặng hơn không khí.
Khí NH3dễ hoá lỏng, tan nhiều trong nước.
Liên kết giữa N và3 nguyên tử H là liên kết cộng hoá trị có cực.
Phản ứng hoáhọc nàosau đây chứng tỏ ammonialàmột chất khử mạnh?
NH3+HCl  NH4Cl.
NH4Cl.
2NH3+H2SO4  (NH4)2SO4.
(NH4)2SO4.
2NH3+ 3Cl2  N2+ 6HCl.
N2+ 6HCl.
NH3+H2O 
 +
+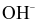 .
.
Thể tích O2 cần để đốt cháy hết 6,8 gam NH3 tạo thành khí N2 là
18,5925 lít.
7,437 lít.
9,916 lít.
12,395 lít.
Nhúng hai đũa thủy tinh vào bình đựng dung dịch HCl đặc và NH3 đặc, đưa hai đầu đũa lại gần nhau thấy xuất hiện khói trắng là
NH4Cl.
NH3.
HCl.
hơi nước.
Cho cân bằng hoá học: N2(g) + 3H2(g) 2NH3(g); phản ứng thuận là phản ứng toả nhiệt. Cân bằng hoá học không bị chuyển dịch khi
thay đổi áp suất của hệ.
thay đổi nồng độ N2.
thay đổi nhiệt độ.
thêm chất xúc tác Fe.
Trong phân tử HNO3,nguyên tử N có:
hoá trị V, số oxi hoá +5.
hoá trị IV, số oxi hoá +5.
hoá trị V, số oxi hoá +4.
hoá trị IV, số oxi hoá +3.
Các tính chất hoá học của HNO3 là
tính acid mạnh, tính oxi hóa mạnh và tính khử mạnh.
tính acid mạnh, tính oxi hóa mạnh và bị phân huỷ.
tính oxi hóa mạnh, tính acid mạnh và tính bazơ mạnh.
tính oxi hóa mạnh, tính acid yếu và bị phân huỷ.
Tính chất nào sau đây không phải tính chất vật lí của sulfur?
Màu vàng ở điều kiện thường.
Thể rắn ở điều kiện thường.
Không tan trong benzene.
Không tan trong nước.
Để loại bỏ SO2 ra khỏi CO2, ta có thể dùng cách nào dưới đây?
Cho hỗn hợp khí qua nước vôi trong.
Cho hỗn hợp khí qua dung dịch Br2 dư.
Cho hỗn hợp khí qua dung dịch CaCl2.
Cho hỗn hợp qua nước nóng.
SO2 luôn thể hiện tính khử trong các phản ứng với:
2S, O2, nước Br2.
dung dịch NaOH, O2, dung dịch KMnO4.
dung dịch KOH, CaO, nước Br2.
O2, nước Br2, dung dịch KMnO4.
Để nhận biết anion có trong dung dịch K2SO4, không thể dùng thuốc thử nào sau đây?
Ba(OH)2.
BaCl2.
Ba(NO3)2.
MgCl2.
Khi làm thí nghiệm với H2SO4 đặc, nóng thường sinh ra khí SO2. Để hạn chế tốt nhất khí SO2 thoát ra gây ô nhiễm môi trường, người ta nút ống nghiệm bằng bông tẩm dung dịch nào sau đây?
Xút.
Muối ăn.
Giấm ăn.
Cồn.
Cho phản ứng: SO2 + KMnO4 + H2O → K2SO4 + MnSO4 + H2SO4.
Trong phương trình hóa học của phản ứng trên, khi hệ số của KMnO4 là 2 thì hệ số của SO2 là
4.
5.
6.
7.
Trong điều kiện thích hợp, xảy ra các phản ứng sau:
(a) 2H2SO4 + C  2SO2 + CO2 + 2H2O.
2SO2 + CO2 + 2H2O.
(b) H2SO4 + Fe(OH)2  FeSO4 + 2H2O.
FeSO4 + 2H2O.
(c) 4H2SO4 + 2FeO  Fe2(SO4)3 + SO2 + 4H2O.
Fe2(SO4)3 + SO2 + 4H2O.
(d) 6H2SO4 + 2Fe  Fe2(SO4)3 + 3SO2 + 6H2O.
Fe2(SO4)3 + 3SO2 + 6H2O.
Trong các phản ứng trên, phản ứng xảy ra với dung dịch H2SO4 loãng là
(d).
(a).
(c).
(b).
Cho các phát biểu sau:
(a) Sulfuric acid đặc có tính háo nước, gây bỏng nặng khi tiếp xúc với da tay.
(b) Khi pha loãng sulfuric acid đặc cần cho từ từ nước vào acid, không làm ngược lại gây nguy hiểm.
(c) Khi bị bỏng sulfuric acid đặc, điều đầu tiên cần làm là xả nhanh chỗ bỏng với nước lạnh.
(d) Sulfuric acid loãng có tính oxi hóa mạnh, khi tác dụng với kim loại không sinh ra khí hydrogen.
(e) Thuốc thử nhận biết sulfuric acid và muối sulfate là ion Ba2+ trong BaCl2, Ba(OH)2, Ba(NO3)2.
Số phát biểu đúng là
1.
2.
3.
4.
Một bình kín có thể tích là 2 lít chứa 2 mol H2 và 2 mol N2, ở nhiệt độ to. Khi ở trạng thái cân bằng có 0,8 mol NH3 tạo thành. Hằng số cân bằng KC của phản ứng tổng hợp NH3 là
7,8125.
3,125.
1,25.
0,675.
Xét các phát biểu sau về nitrogen.
(a) Nguyên tử nguyên tố nitrogen có cấu hình electron là 1s22s22p3.
(b) Ở trạng thái cơ bản, nguyên tử nitrogen có 3 electron hóa trị.
(c) Nguyên tố nitrogen thuộc chu kì 2, nhóm VA trong bảng tuần.
(d) Trong một số hợp chất, nguyên tử nitrogen có thể dùng cặp electron hóa trị riêng để tạo một liên kết cho – nhận với nguyên tử khác.
Xét tính base của dung dịch NH3.
(a) Dung dịch NH3 có tính base yếu, không làm đổi màu quỳ tím.
(b) Dung dịch ammonia có phản ứng với dung dịch acid để tạo muối ammonium.
(c) Khi cho dung dịch NH3 tác dụng với dung dịch HCl loãng thấy xuất hiện khói trắng.
(d) Cho dung dịch FeCl3 tác dụng với dung dịch NH3 thấy xuất hiện kết tủa nâu đỏ.
Phú dưỡng là hiện tượng dư thừa quá nhiều các nguyên tố dinh dưỡng (N, P) trong các nguồn nước làm cho các sinh vật trong nước như vi khuẩn, tảo, rong, rêu,… phát triển nhanh.
(a) Nguyên nhân gây ra hiện tượng phú dưỡng do nguồn nước thải nông nghiệp, công nghiệp, sinh hoạt, ... chưa xử lí triệt để thải vào ao hồ.
(b) Hiện tượng phú dưỡng làm giảm sự quang hợp của thực vật thủy sinh và làm tăng nguồn oxygen của tôm, cá, … gây mất cân bằng hệ sinh thái.
(c) Các loại tôm, cá, … ở ao hồ có hiện tượng phú dưỡng thường khỏe mạnh vì có nguồn chất dinh dưỡng phong phú.
(d) Để khắc phục hiện tượng phú dưỡng ta cần xử lí nước thải trước khi thải vào môi trường, sử dụng phân bón đúng liều lượng, khơi thông kênh rạch, ao hồ, lưu thông dòng nước.
Cho các ứng dụng về ammonia.
(a) Trong công nghiệp, ammonia thường được sử dụng với vai trò chất làm lạnh (chất sinh hàn).
(b) Do có hàm lượng nitrogen cao nên ammonia được sử dụng làm phân đạm rất hiệu quả.
(c) Trong các gói snack thường được bơm khí ammonia để bảo quản.
(d) Quá trình tổng hợp ammonia từ nitrogen và hydrogen là quá trình thuận nghịch nên không thể đạt hiệu suất 100%.
Tiến hành thí nghiệm theo các bước sau:
Bước 1: Lấy vào ống nghiệm thứ nhất 0,5 ml dung dịch HNO3 đặc (68%) và ống nghiệm thứ hai 0,5 ml dung dịch HNO3 15%.
Bước 2: Cho vào mỗi ống nghiệm một mảnh nhỏ đồng kim loại. Nút các ống nghiệm bằng bông tẩm dung dịch NaOH. Đun nhẹ ống nghiệm thứ hai.
(a) Ở hai ống nghiệm, mảnh đồng tan dần, dung dịch chuyển sang màu xanh.
(b) Ở ống nghiệm thứ hai, thấy có khí không màu, không hóa nâu thoát ra khỏi dung dịch.
(c) Bông tẩm dung dịch NaOH có tác dụng hạn chế khí độc NO2 thoát ra khỏi ống nghiệm.
(d) Có thể thay bông tẩm dung dịch NaOH bằng bông tẩm dung dịch NaCl.
Cho dãy chuyển hoá dưới đây:
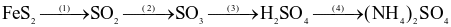
(a) Có hai phản ứng mà nguyên tố lưu huỳnh trong hợp chất đóng vai trò là chất khử.
(b) Sản phẩm của phản ứng (4) có thể dùng làm phân bón.
(c) Không thể phân biệt 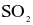 và
và 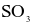 bằng dung dịch
bằng dung dịch 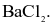
(d) Với 1 tấn 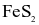 ban đầu thì khối lượng
ban đầu thì khối lượng 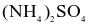 thu được là 377,3 kg. Biết hiệu suất mỗi phản ứng (1), (2), (3) là 70%, của phản ứng (4) là 100%.
thu được là 377,3 kg. Biết hiệu suất mỗi phản ứng (1), (2), (3) là 70%, của phản ứng (4) là 100%.
Tiến hành thí nghiệm sau:
Bước 1: Cho khoảng 2 gam phân bón ammonium chloride vào ống nghiệm. Sau đó cho khoảng 2 mL nước cất vào ống nghiệm, lắc đều đến khi tan hết.
Bước 2: Cho khoảng 2 mL dung dịch NaOH đặc vào ống nghiệm, lắc đều rồi đun nóng nhẹ trên ngọn lửa đèn cồn.
Bước 3: Đặt mẫu giấy quỳ tím đã tẩm ướt lên miệng ống nghiệm đang đun.
(a) Thí nghiệm trên chứng minh muối ammonium chloride dễ tan trong nước ở nhiệt độ thường.
(b) Có thể sử dụng dung dịch kiềm để nhận biết ion .
.
(c) Mẫu giấy quỳ tím chuyển sang màu đỏ.
(d) Nếu thay ammonium chloride bằng ammonium sulfate, thì hiện tượng ở bước 3 vẫn tương tự.
Copper(II) sulfate được dùng để diệt tảo, rong rêu trong nước bể bơi; dùng để pha chế thuốc Bordeaux (trừ bệnh mốc sương trên cây cà chua, khoai tây; bệnh thối thân trên cây ăn quả, cây công nghiệp), … Để diệt nấm trên cây cà chua, thuốc Bordeaux được pha với nước theo tỉ lệ 25g/8L nước. Trung bình mỗi ha cây cà chua cần phun khoảng 500 L dung dịch thuốc Bordeaux.
Trong công nghiệp, copper(II) sulfate thường được sản xuất bằng 2 cách:
- Cách 1: Ngâm đồng phế liệu trong dung dịch sulfuric acid loãng và sục không khí:
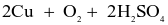 (loãng)
(loãng) 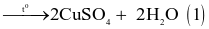
- Cách 2: Cho đồng phế liệu tác dụng với sulfuric acid đặc, nóng:
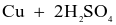 (đặc)
(đặc) 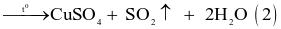
(a) Trong 2 cách trên, cách 1 sử dụng ít sulfuric acid hơn.
(b) Trong 2 cách trên, cách 1 ít gây ô nhiễm môi trường hơn.
(c) Để phun một mảnh vườn rộng 5 ha cần dùng 1,5 kg thuốc Bordeaux.
(d) Trong phản ứng (1): Cu là chất khử,  là chất oxi hóa.
là chất oxi hóa.
Trong quy trình sản xuất sulfuric acid (H2SO4) có giai đoạn dùng dung dịch H2SO4 98% hấp thụ sulfur trioxide (SO2) thu được oleum (H2SO4.nSO3). Sulfur trioxide được tạo thành bằng cách oxi hoá sulfur dioxide bằng oxygen hoặc lượng dư không khí ở nhiệt độ 450°C – 500°C, chất xúc tác vanadium(V) oxide (V2O5) theo phương trình hoá học:
2SO2 (g)+ O2 (g) 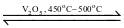 2SO3 (g);
2SO3 (g);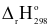 = −198,4 kJ;Kc = 40.
= −198,4 kJ;Kc = 40.
(a) Cân bằng hóa học trên sẽ chuyển dịch theo chiều thuận khi dùng dung dịch H2SO4 98% hấp thu SO3 sinh ra.
(b) Nếu tăng áp suất của hệ phản ứng và giữ nhiệt độ của hệ không đổi thì cân bằng của hệ chuyển dịch theo chiều nghịch.
(c) Nồng độ ban đầu của SO2 và O2 tương ứng là 4M và 2M. Khi đạt đến trạng thái cân bằng đã có 80% SO2 phản ứng.
(d) Nếu tỉ lệ nồng độ mol ban đầu của SO2 và O2 tương ứng là 1:10 thì khi đạt đến trạng thái cân bằng, hiệu suất phản ứng đạt khoảng 90%.
Muối Epsom 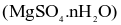 có nhiều ứng dụng: vừa có thể dùng pha chế thuốc nhuận tràng, vừa như một loại phân bón cho cây, hay dung dịch khử khuẩn. Khi làm lạnh 440,0 gam dung dịch
có nhiều ứng dụng: vừa có thể dùng pha chế thuốc nhuận tràng, vừa như một loại phân bón cho cây, hay dung dịch khử khuẩn. Khi làm lạnh 440,0 gam dung dịch 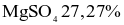 thì có 49,2 gam muối Epsom tách ra, phần dung dịch thu được có nồng độ 24,56%. Biết độ tan của
thì có 49,2 gam muối Epsom tách ra, phần dung dịch thu được có nồng độ 24,56%. Biết độ tan của 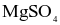 tại
tại 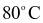 và
và 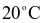 lần lượt là 54,80 gam và 35,10 gam. Khối lượng Epsom được tách ra khi làm lạnh 9288 gam dung dịch bão hòa
lần lượt là 54,80 gam và 35,10 gam. Khối lượng Epsom được tách ra khi làm lạnh 9288 gam dung dịch bão hòa 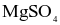 từ
từ 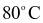 xuống
xuống 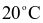 là b gam.
là b gam.
(a) Để lâu Epsom trong không khí sẽ bị chảy rữa.
(b) Giá trị của b là 3837 gam (kết quả làm tròn đến hàng đơn vị).
(c) Epsom là một loại muối có ứng dụng trong y học.
(d) Công thức của muối Epsom là 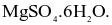
Cho các chất: Cu, Al, MgO, Fe3O4, Fe(OH)2, CaCO3, K2SO4 lần lượt tác dụng với dung dịch HNO3 loãng. Có bao nhiêu trường hợp xảy ra phản ứng oxi hóa – khử?
Cho sơ đồ chuyển hóa nitrogen trong khí quyển thành phân đạm:
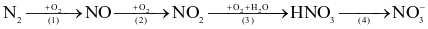
Có bao nhiêu phản ứng thuộc loại oxi hóa – khử trong sơ đồ trên?
Cho phản ứng: aFe + bHNO3 → cFe(NO3)3 + dNO2↑ + eH2O. Hệ số tỉ lượng a, b, c, d, e là những số nguyên dương có tỉ lệ tối giản. Tổng (a + b) bằng bao nhiêu?
Trong công nghiệp, chất rắn copper(II) sulfate pentahydrate có thể được sản xuất từ copper(II) oxide theo hai giai đoạn của quá trình:
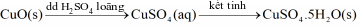
Có thể pha chế dung dịch copper(II) sulfate 10-4 M dùng để diệt một số loại vi sinh vật. Tính số mg copper(II) sulfate pentahydrate cần dùng để pha chế thành 1 L dung dịch copper(II) sulfate 10-4 M?
Trong công nghiệp thực phẩm, nitrogen lỏng (D = 0,808 g/mL) được phun vào vỏ bao bì trước khi đóng nắp để làm căng vỏ bao bì. Thể tích khí nitrogen thu được (đkc) khi hóa hơi 1 mL nitrogen lỏng là bao nhiêu mL?(Kết quả làm tròn đến hàng phần mười)
Trong công nghiệp, người ta sản xuất nitric acid (HNO3) từ ammonia theo sơ đồ chuyển hoá sau:
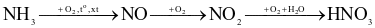
Tính khối lượng dung dịch HNO3 60% điều chế được từ 340 kg ammonia, biết rằng hiệu suất của toàn bộ quá trình là 90%.
Nén hỗn hợp gồm 14 lít H2 và 3 lít N2 ở cùng điều kiện vào bình phản ứng có chứa một ít bột Fe. Sau một thời gian đưa bình về nhiệt độ ban đầu thu được 15,8 lít hỗn hợp khí. Hiệu suất của phản ứng tổng hợp NH3 là bao nhiêu %?
Cho sơ đồ phản ứng:
SO2 + KMnO4 + H2O → K2SO4 + MnSO4 + H2SO4.
Tổng hệ số cân bằng (là các số nguyên tối giản) của phản ứng là?
Hòa tan 12,8 gam Cu trong acid H2SO4 đặc, nóng, dư. Thể tích khí SO2 ở điều kiện chuẩn thu được là bao nhiêu lít?
Hòa tan 1,96 gam một muối X ngậm nước vào cốc nước, thu được 100 mL dung dịch X gồm các ion: 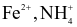 và
và 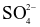 . Cho dung dịch NaOH dư vào 40 mL dung dịch X, đun nóng, thu được 99,16 mL khí (đkc). Cho dung dịch
. Cho dung dịch NaOH dư vào 40 mL dung dịch X, đun nóng, thu được 99,16 mL khí (đkc). Cho dung dịch 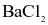 dư vào 40 mL dung dịch X, thu được 0,932 gam kết tủa. Tổng số nguyên tử có trong 1 phân tử muối ngậm nước X là?
dư vào 40 mL dung dịch X, thu được 0,932 gam kết tủa. Tổng số nguyên tử có trong 1 phân tử muối ngậm nước X là?


