Đề kiểm tra Hóa 11 Cánh diều Chủ đề 1 có đáp án - Đề 2
28 câu hỏi
Cho phản ứng thuận nghịch: . Hằng số cân bằng của phản ứng trên là
. Hằng số cân bằng của phản ứng trên là
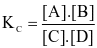 .
.
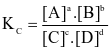 .
.
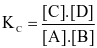 .
.
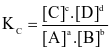 .
.
Phát biểu nào sau đây về một phản ứng thuận nghịch tại trạng thái cân bằng là không đúng?
Tốc độ của phản ứng thuận bằng tốc độ của phản ứng nghịch.
Nồng độ của tất cả các chất trong hỗn hợp phản ứng là không đổi.
Nồng độ mol của chất phản ứng luôn bằng nồng độ mol của chất sản phẩm phản ứng.
Phản ứng thuận và phản ứng nghịch vẫn diễn ra.
Nhận xét nào sau đây không đúng?
Trong phản ứng một chiều, sản phẩm không phản ứng được với nhau tạo thành chất đầu.
Trong phản ứng thuận nghịch, các chất sản phẩm có thể phản ứng với nhau để tạo thành chất đầu.
Phản ứng một chiều là phản ứng luôn xảy ra không hoàn toàn.
Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều trái ngược nhau trong cùng điều kiện.
Cho phản ứng: H2 (g) + I2(g)  2HI (g)
2HI (g)
Ở nhiệt độ 430°C, hằng số cân bằng KCcủa phản ứng trên bằng 53,96. Đun nóng một bình kín dung tích không đổi 10 lít chứa 4,0 gam H2và 406,4 gam I2. Khi hệ phản ứng đạt trạng thái cân bằng ở 430°C, nồng độ của HI gần nhất với
0,275M.
0,320M.
0,151M.
0,225M.
Cho phản ứng: 2SO2 (g) + O2 (g)  2SO3 (g),
2SO3 (g), 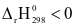 . Để thu được nhiều sản phẩm nhất thì ta phải:
. Để thu được nhiều sản phẩm nhất thì ta phải:
giảm áp suất, giảm nhiệt độ.
giảm nhiệt độ và tăng áp suất.
tăng nhiệt độ, tăng áp suất.
tăng nhiệt độ và giảm áp suất.
Cho phản ứng: N2 (g) + 3H2 (g)  2NH3 (g). Biết rằng phản ứng thuận là phản ứng toả nhiệt, cân bằng hoá học không bị chuyển dịch khi nào?
2NH3 (g). Biết rằng phản ứng thuận là phản ứng toả nhiệt, cân bằng hoá học không bị chuyển dịch khi nào?
Thay đổi áp suất của hệ.
Thay đổi nhiệt độ của hệ.
Thay đổi nồng độ N2.
Thêm chất xúc tác Fe.
Xét cân bằng hóa học:
CO2(g) + H2(g)  CO(g) + H2O(g); ∆rH < 0
CO(g) + H2O(g); ∆rH < 0
Yếu tố nào sau đây không làm chuyển dịch cân bằng?
Nhiệt độ.
Áp suất.
Nồng độ chất đầu.
Nồng độ sản phẩm.
Đối với một hệ ở trạng thái cân bằng, nếu thêm chất xúc tác thì:
Chỉ làm tăng tốc độ phản ứng thuận.
Chỉ làm tăng tốc độ phản ứng nghịch.
Làm tăng tốc độ phản ứng thuận và phản ứng nghịch như nhau.
Không làm tăng tốc độ phản thuận và phản ứng nghịch.
Chất nào sau đây không phải chất điện li?
KOH.
2S.
HNO3.
2H5OH.
Chất nào dưới đây không phân li ra ion khi hòa tan trong nước?
MgCl2.
HClO3.
Ba(OH)2.
6H12O6 (glucose).
Chất nào sau đây thuộc loại chất điện li mạnh?
CH3COOH.
2H5OH.
2O.
NaCl.
Phương trình điện li viết đúng là
2SO4→ 2H+ + SO4−
NaOH  Na+ + OH−
Na+ + OH−
HF  H+ + F-
H+ + F-
AlCl3→ Al3+ + Cl3-
Trong dung dịch acetic acid (bỏ qua sự phân li của H2O) có những phần tử nào?
+, CH3COO−.
+, CH3COO−, H2O.
CH3COOH, H+, CH3COO−, H2O.
CH3COOH, CH3COO−, H+.
Cho phương trình:NH3 + H2O  NH4+ + OH-
NH4+ + OH-
Trong phản ứng thuận, theo thuyết Bronsted – Lowry chất nào là base?
NH3.
2O.
NH4+.
OH-.
Các dung dịch sau đây có cùng nồng độ 0,10 mol/L, dung dịch nào dẫn điện kém nhất?
HCl.
HF.
HI.
HBr.
Dung dịch chất nào sau đây làm xanh quỳ tím?
HCl.
Na2SO4.
NaOH.
KCl.
Cho cân bằng: N2O4(g)  2NO2(g). Ban đầu có 0,02 mol N2O4 trong bình kín có thể tích 500 mL, khi phản ứng đạt trạng thái cân bằng thì nồng độ của N2O4 là 0,0055 M. Giá trị của hằng số cân bằng KC là
2NO2(g). Ban đầu có 0,02 mol N2O4 trong bình kín có thể tích 500 mL, khi phản ứng đạt trạng thái cân bằng thì nồng độ của N2O4 là 0,0055 M. Giá trị của hằng số cân bằng KC là
0,87.
12,5.
6,27.
0,14.
Dung dịch H2SO4 0,10 M có:
pH = 1.
pH < 1.
pH > 1.
[H+] > 2,0 M.
Cho biến thiên nồng độ chất phản ứng và chất sản phẩm theo thời gian như sau:
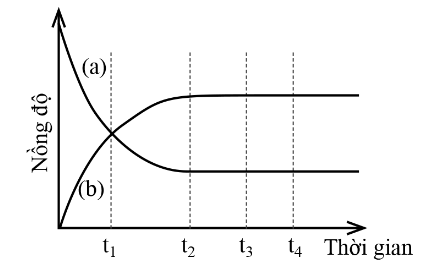
(a) Đường (a) mô tả biến thiên nồng độ chất sản phẩm theo thời gian.
(b) t1 không phải là thời điểm bắt đầu trạng thái cân bằng.
(c) t2 là thời điểm phản ứng đạt trạng thái cân bằng.
(d) Đường (b) mô tả biến thiên nồng độ chất phản ứng theo thời gian.
Cho ba dung dịch có cùng nồng độ: hydrochloric acid (HCl), ethanol acid (acetic acid, CH3COOH) và sodium hydroxide (NaOH). Khi chuẩn độ riêng một thể tích như nhau của dung dịch HCl và dung dịch CH3COOH bằng dung dịch NaOH.
(a) Giá trị pH của hai acid tăng như nhau cho đến khi đạt điểm tương đương.
(b) Tại các điểm tương đương, dung dịch của cả hai phép chuẩn độ đều có giá trị bằng 7.
(c) Cần cùng một thể tích sodium hydroxide để đạt đến điểm tương đương.
(d) Trước khi chuẩn độ, pH của hai acid bằng nhau.
Người ta thường sản xuất vôi bằng phản ứng nhiệt phân calcium carbonate theo phương trình nhiệt hóa học sau:
CaCO3(s)  CaO(s) + CO2(g)
CaO(s) + CO2(g) 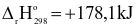
(a) Phản ứng trên có phản ứng thuận là phản ứng tỏa nhiệt.
(b) Khi tăng nhiệt độ của hệ, cân bằng trên sẽ chuyển dịch theo chiều thuận.
(c) Khi tăng áp suất của hệ, cân bằng trên sẽ chuyển dịch theo chiều nghịch.
(d) Để nâng cao hiệu suất của phản ứng nhiệt phân calcium carbonate ta cần thực hiện phản ứng ở nhiệt độ thấp.
Cho hai phản ứng:
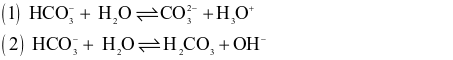
Xét theo thuyết acid – base của Bronsted – Lowry.
(a) Trong phản ứng thuận của phản ứng (1) thì 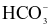 là base, H2O là acid.
là base, H2O là acid.
(b) Trong phản ứng thuận của phản ứng (2) thì 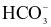 là acid, H2O là base.
là acid, H2O là base.
(c) 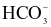 vừa có tính acid, vừa có tính base nên là chất lưỡng tính.
vừa có tính acid, vừa có tính base nên là chất lưỡng tính.
(d) H2O vừa có tính acid, vừa có tính base nên là chất lưỡng tính.
Cho các chất sau đây: KCl, H2O, HNO3, HF, HNO2, NaNO3, H2CO3, CH3COOH, H2S, Ba(OH)2. Số chất thuộc loại điện li mạnh là bao nhiêu?
Cho các dung dịch có cùng nồng độ: KOH (1), H2SO4 (2), HNO3 (3), NaCl(4). Giá trị pH của các dung dịch được sắp xếp theo chiều tăng từ trái sang phải là? (Biểu diễn bằng cách viết liên số thứ tự các dung dịch, ví dụ: 1234 hay 4321 …)
Cho phản ứng thủy phân ester sau:

Hằng số tốc độ phản ứng thuận và phản ứng nghịch của sự thủy phân ester trên lần lượt là 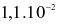 giây-1 và
giây-1 và 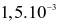 giây-1.
giây-1.
Biết rằng động học của phản ứng thủy phân ester trên phù hợp với định luật tác dụng khối lượng. Hằng số cân bằng của phản ứng là? (Làm tròn đến hàng phần trăm).
Hòa tan 12,5 gam tinh thể CuSO4.5H2O trong nuớc thành 200mL dung dịch. Tính nồng độ mol của ion Cu2+ có trong dung dịch thu được.
Một học sinh thực hiện thí nghiệm sau: Lấy 10 mL dung dịch HCl 0,2 M cho vào 5 mL dung dịch NH3 thu được dung dịch A. Chuẩn độ lượng HCl dư trong dung dịch A bằng dung dịch NaOH 0,1 M thấy phản ứng hết 10,2 mL. Tính nồng độ của dung dịch NH3 ban đầu theo đơn vị mol / lít.
Trộn 200ml dung dịch H2SO4 0,05M với 300ml dung dịch HCl 0,1M thu được dung dịch Y. pH của dung dịch Y là bao nhiêu?


