Đề kiểm tra Hóa 11 Cánh diều Chủ đề 1 có đáp án - Đề 1
28 câu hỏi
Cho phản ứng thuận nghịch: 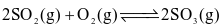 . Hằng số cân bằng của phản ứng trên là
. Hằng số cân bằng của phản ứng trên là
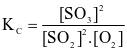 .
.
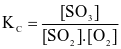 .
.
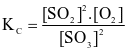 .
.
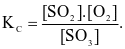
Hằngsốcânbằng KCcủamộtphảnứngthuậnnghịchphụthuộcvàoyếutố nàosauđây?
Nồng độ.
Nhiệtđộ.
Ápsuất.
Chấtxúctác.
Cho cân bằng hoá học: H2 (g) + I2 (g) 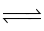 2HI (g); ∆H > 0. Cân bằng không bị chuyển dịch khi:
2HI (g); ∆H > 0. Cân bằng không bị chuyển dịch khi:
tăng nhiệt độ của hệ.
giảm nồng độ HI.
giảm áp suất chung của hệ.
tăng nồng độ H2.
Trong các phản ứng sau đây, phản ứng nào áp suất không ảnh hưởng đến cân bằng phản ứng?
N2 + 3H2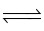 2NH3.
2NH3.
N2 + O2 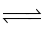 2NO.
2NO.
2NO + O2 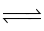 2NO2.
2NO2.
2SO2 + O2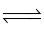 2SO3.
2SO3.
Xét cân bằng: N2O4(g) 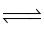 2NO2 (g) ở
2NO2 (g) ở 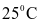 . Khi chuyển dịch sang một trạng thái cân bằng mới nếu nồng độ của N2O4 tăng lên 9 lần thì nồng độ của NO2:
. Khi chuyển dịch sang một trạng thái cân bằng mới nếu nồng độ của N2O4 tăng lên 9 lần thì nồng độ của NO2:
tăng 9 lần.
tăng 3 lần.
tăng 4,5 lần.
giảm 3 lần.
Cho phản ứng: N2 (g) + 3H2 (g) 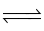 2NH3 (g). Nếu ở trạng thái cân bằng nồng độ NH3 là 0,30 mol/L, N2 là 0,05 mol/L và của H2 là 0,10 mol/L thì hằng số cân bằng của phản ứng là bao nhiêu?
2NH3 (g). Nếu ở trạng thái cân bằng nồng độ NH3 là 0,30 mol/L, N2 là 0,05 mol/L và của H2 là 0,10 mol/L thì hằng số cân bằng của phản ứng là bao nhiêu?
18.
60.
3600.
1800.
Cho phản ứng thuận nghịch ở trạng thái cân bằng:
4NH3(g) + 3O2(g) ⇌ 2N2(g) + 6H2O(g); ∆rH < 0
Cân bằng sẽ chuyển dịch theo chiều thuận khi:
Tăng nhiệt độ.
Thêm chất xúc tác.
Tăng áp suất.
Loại bỏ hơi nước.
Cho cân bằng hóa học: 2SO2(g) + O2(g) 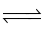 2SO3(g); phản ứng thuận là phản ứng tỏa nhiệt. Phát biểu đúng là
2SO3(g); phản ứng thuận là phản ứng tỏa nhiệt. Phát biểu đúng là
Cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ.
Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ O2.
Cân bằng chuyển dịch theo chiều thuận khi giảm áp suất hệ phản ứng.
Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ SO3.
Cho phản ứng: Fe2O3 (s) + 3CO (g) 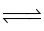 2Fe (s) + 3CO2 (g).
2Fe (s) + 3CO2 (g).
Khi tăng áp suất chung của hệ phản ứng thì
cân bằng chuyển dịch theo chiều thuận.
cân bằng không bị chuyển dịch.
cân bằng chuyển dịch theo chiều nghịch.
phản ứng dừng lại.
Chất nào sau đây là chất điện li?
Cl2.
HNO3.
MgO.
CH4.
Dung dịch nào sau đây có khả năng dẫn điện?
Dung dịch đường.
Dung dịch rượu.
Dung dịch muối ăn.
Dung dịch benzene trong ancol.
Chất nào sau đây thuộc loại chất điện li yếu?
NaHCO3.
2H5OH.
2S.
NH4Cl.
Phương trình điện li viết đúng là
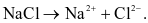
KOH → K+ + OH−.
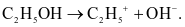
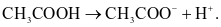
Cho phương trình:CH3COOH + H2O  CH3COO− + H3O+
CH3COO− + H3O+
Trong phản ứng thuận, theo thuyết Bronsted – Lowry chất nào là acid?
CH3COOH.
2O.
CH3COO−.
3O+.
Các chất trong dãy nào sau đây là những chất điện li mạnh?
HCl, NaOH, CH3COOH.
KOH, NaCl, H3PO4.
HCl, NaOH, NaCl.
NaNO3, NaNO2, NH3.
Hòa tan hoàn toàn 12,4 gam Na2O vào nước dư thu được 500 mL dung dịch X. Nồng độ mol của cation trong X là
0,4 M.
0,8 M.
0,2 M.
0,5 M.
Dung dịch X gồm 0,03 mol Na+, 0,02 mol Mg2+, 0,01 mol 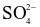 và a mol
và a mol 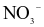 . Khối lượng muối trong dung dịch là
. Khối lượng muối trong dung dịch là
5,23 gam.
4,61 gam.
4,16 gam.
3,24 gam.
Cho các chất: NaOH, CH3COOH, HCl, CO2, NaHCO3, C2H5OH.
(a) Có 3 chất điện li mạnh là NaOH, HCl, NaHCO3.
(b) Có 2 chất điện li yếu là CH3COOH, CO2.
(c) Có 1 chất không điện li là C2H5OH.
(d) Phương trình điện li của CH3COOH là CH3COOH → CH3COO− + H+.
Hằng số cân bằng của phản ứng 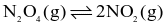 ở nhiệt độ 400 K và 500 K lần lượt là 50 và 1 700. Mỗi phát biểu sau là đúng hay sai?
ở nhiệt độ 400 K và 500 K lần lượt là 50 và 1 700. Mỗi phát biểu sau là đúng hay sai?
(a) Đây là phản ứng thu nhiệt.
(b) Đây là phản ứng toả nhiệt.
(c) Nếu trộn 20 mol NO2(g) với 2 mol N2O4(g) ở 400 K, thì cân bằng chuyển dịch theo chiều nghịch.
(d) Enthalpy của phản ứng có giá trị dương.
Cho phản ứng tổng hợp ammonia:
N2(g) + 3H2(g) 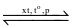 2NH3(g)
2NH3(g) 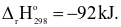
(a) Phản ứng trên có phản ứng thuận là phản ứng tỏa nhiệt.
(b) Khi tăng nhiệt độ của hệ thì cân bằng chuyển dịch theo chiều nghịch.
(c) Khi giảm áp suất của hệ thì cân bằng chuyển dịch theo thuận.
(d) Thực tế để phản ứng tổng hợp NH3 đạt hiệu suất cao thì người ta thực hiện ở nhiệt độ phòng và áp suất cao.
Khi tìm hiểu về các yếu tố ảnh hưởng đến tốc độ phản ứng, để trả lời cho câu hỏi “Nồng độ chất tham gia ảnh hưởng đến tốc độ phản ứng như thế nào?”, một học sinh đã tiến hành thí nghiệm theo các bước:
Bước 1: Chuẩn bị 2 cốc thuỷ tinh 250 mL được đánh dấu (A) và (B)
Bước 2: Rót 50 mL dung dịch hydrochloric acid (HCl) 1M vào cốc (A) 50 mL dung dịch HCl 2M vào cốc (B)
Bước 3: Cho 1 gam bột kẽm (Zn) vào mỗi cốc. Quan sát hiện tượng xảy ra ở 2 cốc.
(a) Nếu trong cùng một khoảng thời gian, lượng khí thoát ra ở cốc nào nhiều hơn thì có thể kết luận tốc độ phản ứng ở cốc đó lớn hơn cốc còn lại.
(b) Ở bước 3, nếu cho 1 gam Zn dạng viên vào cốc (A), 1 gam bột Zn vào cốc (B) thì có thể cho thấy được tốc độ phản ứng phụ thuộc vào nồng độ.
(c) “Tốc độ phản ứng không phụ thuộc vào nồng độ chất tham gia” có thể là một giả thuyết tương ứng với câu hỏi trên.
(d) Ở bước 3, nếu sử dụng bột đồng (Cu) thay cho bột Zn thì thí nghiệm không còn phù hợp để trả lời câu hỏi trên.
Cho các chất sau đây: HCl, H2O, HNO3, HF, HNO2, KNO3, H2CO3, CH3COOH, H2S, Ba(OH)2. Số chất thuộc loại điện li yếu là bao nhiêu?
Cho các dung dịch có cùng nồng độ: NaOH (1), H2SO4 (2), HCl(3), KNO3 (4). Giá trị pH của các dung dịch được sắp xếp theo chiều tăng từ trái sang phải là? (Biểu diễn bằng cách viết liên số thứ tự các dung dịch, ví dụ: 1234 hay 4321 …)
Trong dung dịch trung hòa về điện, tổng đại số điện tích của các ion bằng không. Dung dịch A có chứa 0,02 mol Mg2+; 0,01 mol Na+; 0,02 mol Cl− và x mol 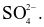 Giá trị của x là?
Giá trị của x là?
Cho phương trình hóa học sau:
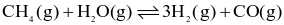
Biết rằng, ở 760 °C các chất đều ở thể khí và nồng độ mol của CH4, H2O, H2 và CO ở trạng thái cân bằng lần lượt là 0,126M; 0,242M; 1,150M và 0,126M.
Tính hằng số cân bằng 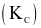 của phản ứng ở 760 °C. (Làm tròn đến hàng phần trăm)
của phản ứng ở 760 °C. (Làm tròn đến hàng phần trăm)
Trộn 200 mL dung dịch NaOH 0,1M với 300 mL dung dịch HCl 0,2M thu được dung dịch  Tính pH của dung dịch A. (Làm tròn đến hàng phần mười).
Tính pH của dung dịch A. (Làm tròn đến hàng phần mười).
Dungdịch nào sau đâycó pH=7?
NaCl.
NaOH.
HNO3.
H2SO4.
Để xác định nồng độ của một dung dịch HCl, người ta đã tiến hành chuẩn độ bằng dung dịch NaOH 0,1 M. Để chuẩn độ 10 mL dung dịch HCl này cần 15 mL dung dịch NaOH. Nồng độ của dung dịch HCl là bao nhiêu M?


