Bài tập ôn tập Hóa 11 Cánh diều Chủ đề 1 có đáp án
49 câu hỏi
Chất nào sau đây không dẫn điện được?
KCl rắn, khan.
CaCl2 nóng chảy.
NaOH nóng chảy.
HBr hòa tan trong nước.
Phản ứng nào sau đây là phản ứng thuận nghịch?
Mg + 2HCl  MgCl2 + H2.
MgCl2 + H2.
2SO2 + O2  2SO3.
2SO3.
2H5OH + 3O2  2CO2 + 3H2O.
2CO2 + 3H2O.
2KClO3  2KC1 + 3O2.
2KC1 + 3O2.
Dung dịch nào sau đây có khả năng dẫn điện?
Dung dịch đường.
Dung dịch rượu.
Dung dịch muối ăn.
Dung dịch benzene trong alcohol.
Chất nào sau đây không phải chất điện li?
NaCl.
6H12O6 (glucose).
HNO3.
NaOH.
Phương trình điện li nào sau đây không chính xác?
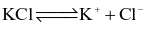 .
.
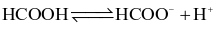 .
.
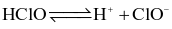 .
.
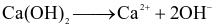 .
.
Nồng độ mol của cation trong dung dịch FeCl3 0,45M là
0,45M.
0,90M.
1,35M.
1,00M.
Theo thuyết Bronsted - Lowry, H2O đóng vai trò gì trong phản ứng sau:
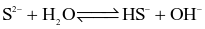
Chất oxi hóa.
Chất khử.
Acid.
Base.
Cho phương trình hóa học của phản ứng sản xuất ammonia trong công nghiệp:
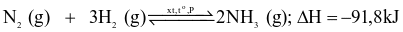 .
.
Yếu tố nào không làm ảnh hưởng đến sự chuyển dịch cân bằng hoá học của phản ứng trên?
Nhiệt độ.
Nồng độ.
Áp suất.
Chất xúc tác.
Cho phương trình hóa học của phản ứng sản xuất ammonia trong công nghiệp:
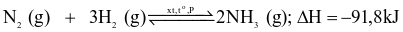 .
.
Cân bằng hoá học sẽ chuyển dịch về phía tạo ra nhiều ammonia hơn khi
giảm nồng độ của khí nitrogen.
giảm nồng độ của khí hydrogen.
tăng nhiệt độ của hệ phản ứng.
tăng áp suất của hệ phản ứng.
Cho phương trình nhiệt hóa học sau:
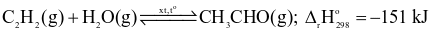 .
.
Cân bằng hoá học sẽ chuyển dịch về phía tạo ra nhiều CH3CHO hơn khi
giảm nồng độ của khí C2H2.
tăng nhiệt độ của hệ phản ứng.
không sử dụng chất xúc tác.
tăng áp suất của hệ phản ứng.
Trong các dung dịch acid sau có cùng nồng độ 0,1M, dung dịch nào có 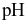 cao nhất?
cao nhất?
HF.
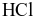 .
.
HBr.
HI.
Cho phương trình nhiệt hóa học sau:
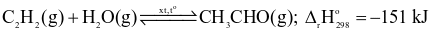
Biểu thức hằng số cân bằng của phản ứng là
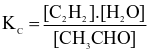 .
.
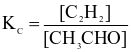 .
.
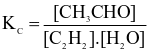 .
.
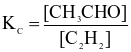 .
.
Sulfur trioxide được điều chế theo phương trình hóa học:
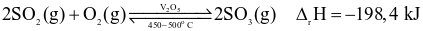 .
.
Cho các biện pháp (1) tăng nhiệt độ, (2) tăng áp suất chung của hệ phản ứng, (3) hạ nhiệt độ, (4) dùng thêm chất xúc tác V2O5, (5) giảm nồng độ SO3, (6) giảm áp suất chung của hệ phản ứng. Những biện pháp nào làm cân bằng trên chuyển dịch theo chiều thuận?
(1), (2), (4), (5).
(2), (3), (5).
(2), (3), (4), (6).
(1), (2), (4).
Cho phản ứng hoá học sau:
PCl3(g) + Cl2(g)  PCl5(g)
PCl5(g)
Ở T °C, nồng độ các chất ở trạng thái cân bằng như sau: [PCl5] = 0,059 mol/L; [PCl3] = [Cl2] = 0,035 mol/L. Hằng số cân bằng (KC) của phản ứng tại T °C là
1,68.
48,16.
0,02.
16,95.
Thêm nước vào 10 mL dung dịch NaOH 0,10 mol/L, thu được 1000 mL dung dịch A. Dung dịch A có pH thay đổi như thế nào so với dung dịch ban đầu?
pH giảm đi 2 đơn vị.
pH giảm đi 1 đơn vị.
pH tăng 2 đơn vị.
pH tăng gấp đôi.
Cho phản ứng hoá học sau:
Br2(g) + H2(g)  2HBr(g)
2HBr(g)
Biểu thức hằng số cân bằng (Kc) của phản ứng trên là
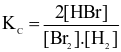 .
.
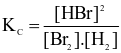 .
.
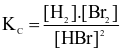 .
.
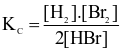 .
.
Cân bằng hoá học nào sau đây không bị chuyển dịch khỉ thay đổi áp suất?
2SO2(g) + O2(g)  2SO3(g).
2SO3(g).
C(s) + H2O(g)  CO(g) + H2(g).
CO(g) + H2(g).
PCl3 (g) + Cl2(g)  PCl5(g).
PCl5(g).
3Fe(s) + 4H2O (g) Fe3O4(s) + 4H2 (g).
Fe3O4(s) + 4H2 (g).
Cho phản ứng hoá học sau:
N2(g) + 3H2(g)  2NH3(g)
2NH3(g) 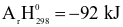
Yếu tố nào sau đây cần tác động để cân bằng trên chuyển dịch sang phảỉ?
Thêm chất xúc tác.
Giảm nồng độ N2 hoặc H2.
Tăng áp suất.
Tăng nhiệt độ.
Trong dung dịch nước, cation kim loại mạnh, gốc acid mạnh không bị thuỷ phân, còn cation kim loại trung bình và yếu bị thuỷ phân tạo môi trường acid, gốc acid yếu bị thuỷ phân tạo môi trường base. Dung dịch muối nào sau đây có 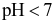 ?
?
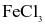 .
.
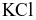 .
.
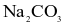 .
.
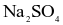 .
.
Dung dịch nào sau đây có pH > 7?
NaOH.
2SO4.
NaCl.
HNO3.
Trộn lẫn V mL NaOH 0,01M với V mL dung dịch HCl 0,03M được 2V mL dung dịch Y. Dung dịch Y có pH là
4.
3.
2.
1.
Cho phản ứng hoá học sau:

Biểu thức hằng số cân bằng của phản ứng trên là
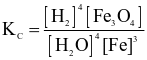 .
.
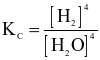 .
.
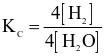 .
.
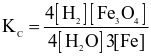 .
.
Hòa tan hoàn toàn 12,4 gam Na2O vào nước dư thu được 500 mL dung dịch X. Nồng độ mol của cation trong X là
0,4 M.
0,8 M.
0,2 M.
0,5 M.
Cho phản ứng hoá học sau:
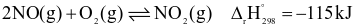
Nhận xét nào sau đây không đúng?
Nếu tăng nhiệt độ thì cân bằng trên chuyển dịch theo chiều nghịch.
Nếu tăng áp suất thì cân bằng trên chuyển dịch theo chiều nghịch.
Hằng số cân bằng của phản ứng trên chỉ phụ thuộc vào nhiệt độ.
Phản ứng thuận là phản ứng toả nhiệt.
Cho cân bằng hoá học sau:
4NH3(g) + 5O2(g)  4NO(g) + 6H2O(g)
4NO(g) + 6H2O(g) 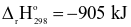
Yếu tố nào sau đây cần tác động để cân bằng trên chuyển dịch sang phải?
Giảm nhiệt độ.
Tăng áp suất.
Giảm nồng độ của O2.
Thêm xúc tác Pt.
Trong dung dịch nước, cation kim loại mạnh, gốc acid mạnh không bị thuỷ phân, còn cation kim loại trung bình và yếu bị thuỷ phân tạo môi trường acid, gốc acid yếu bị thuỷ phân tạo môi trường base. Dung dịch muối nào sau đây có 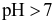 ?
?
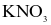 .
.
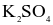 .
.
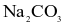 .
.
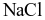 .
.
Tại khu vực bị ô nhiễm, 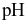 của nước mưa đo được là 4,5 còn
của nước mưa đo được là 4,5 còn 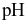 của nước mưa tại khu vực không bị ô nhiễm là 5,7. Nhận xét nào sau đây không đúng?
của nước mưa tại khu vực không bị ô nhiễm là 5,7. Nhận xét nào sau đây không đúng?
Nồng độ ion 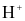 trong dung dịch nước mưa bị ô nhiễm là
trong dung dịch nước mưa bị ô nhiễm là 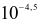 .
.
Nồng độ ion 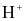 trong dung dịch nước mưa không bị ô nhiễm là
trong dung dịch nước mưa không bị ô nhiễm là 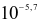 .
.
Nồng độ ion 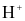 trong nước mưa bị ô nhiễm thấp hơn so với trong nước mưa không bị ô nhiễm.
trong nước mưa bị ô nhiễm thấp hơn so với trong nước mưa không bị ô nhiễm.
Nồng độ ion 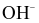 trong nước mưa bị ô nhiễm thấp hơn hơn so với trong nước mưa không bị ô nhiễm.
trong nước mưa bị ô nhiễm thấp hơn hơn so với trong nước mưa không bị ô nhiễm.
Cho cân bằng hoá học sau:
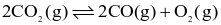
Ở ToC, nồng độ các chất ở trạng thái cân bằng như sau:
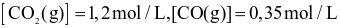 và
và 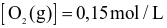 .
.
Hằng số cân bằng của phản ứng tại ToC là
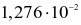 .
.
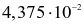 .
.
78,36.
22,85.
Thêm nước vào 10 mL dung dịch HCl 0,1M, thu được 1000 mL dung dịch A. Dung dịch A có pH thay đổi như thế nào so với đung dịch ban đầu?
pH giảm đi 2 đơn vị.
pH giảm đi 1 đơn vị.
pH tăng 2 đơn vị.
pH tăng gấp đôi.
Dung dịch X gồm 0,03 mol Na+, 0,02 mol Mg2+, 0,01 mol 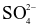 và a mol
và a mol 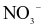 . Khối lượng muối trong dung dịch là
. Khối lượng muối trong dung dịch là
5,23 gam.
4,61 gam.
4,16 gam.
3,24 gam.
Cho biến thiên nồng độ chất phản ứng và chất sản phẩm theo thời gian như sau:
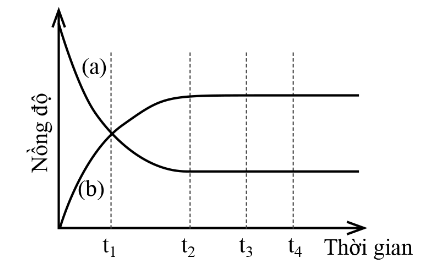
(a) Đường (a) mô tả biến thiên nồng độ chất sản phẩm theo thời gian.
(b) t1 không phải là thời điểm bắt đầu trạng thái cân bằng.
(c) t2 là thời điểm phản ứng đạt trạng thái cân bằng.
(d) Đường (b) mô tả biến thiên nồng độ chất phản ứng theo thời gian.
Cho các chất: NaOH, CH3COOH, HCl, CO2, NaHCO3, C2H5OH.
(a) Có 3 chất điện li mạnh là NaOH, HCl, NaHCO3.
(b) Có 2 chất điện li yếu là CH3COOH, CO2.
(c) Có 1 chất không điện li là C2H5OH.
(d) Phương trình điện li của CH3COOH là CH3COOH → CH3COO− + H+.
Vỏ trứng có chứa calcium ở dạng 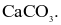 Để xác định hàm lượng
Để xác định hàm lượng 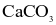 trong vỏ trứng trong phòng thí nghiệm, người ta có thể tiến hành như sau:
trong vỏ trứng trong phòng thí nghiệm, người ta có thể tiến hành như sau:
Bước 1: Lấy 1,0 g vỏ trứng khô, đã được làm sạch, hoà tan hoàn toàn trong 50 mL dung dịch HCl 0,4 M.
Bước 2: Lọc dung dịch sau phản ứng thu được 50 mL dung dịch A.
Bước 3: Lấy 10,0 mL dung dịch A chuẩn độ với dung dịch NaOH 0,1 M thấy hết 5,6 mL.
(a) Hàm lượng calcium trong vỏ trứng là 68,8% (giả thiết các tạp chất khác trong vỏ trứng không phản ứng với HCl).
(b) Dung dịch A có pH < 7.
(c) Sau bước 1, thấy vỏ trứng tan một phần và sủi bọt khí.
(d) Hàm lượng 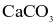 trong vỏ trứng là 86%.
trong vỏ trứng là 86%.
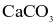 trong vỏ trứng là 86%.
trong vỏ trứng là 86%.Hằng số cân bằng của phản ứng 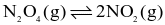 ở nhiệt độ 400 K và 500 K lần lượt là 50 và 1 700. Mỗi phát biểu sau là đúng hay sai?
ở nhiệt độ 400 K và 500 K lần lượt là 50 và 1 700. Mỗi phát biểu sau là đúng hay sai?
(a) Đây là phản ứng thu nhiệt.
(b) Đây là phản ứng toả nhiệt.
(c) Nếu trộn 20 mol NO2(g) với 2 mol N2O4(g) ở 400 K, thì cân bằng chuyển dịch theo chiều nghịch.
(d) Enthalpy của phản ứng có giá trị dương.
Cho ba dung dịch có cùng nồng độ: hydrochloric acid (HCl), ethanol acid (acetic acid, CH3COOH) và sodium hydroxide (NaOH). Khi chuẩn độ riêng một thể tích như nhau của dung dịch HCl và dung dịch CH3COOH bằng dung dịch NaOH.
(a) Giá trị pH của hai acid tăng như nhau cho đến khi đạt điểm tương đương.
(b) Tại các điểm tương đương, dung dịch của cả hai phép chuẩn độ đều có giá trị bằng 7.
(c) Cần cùng một thể tích sodium hydroxide để đạt đến điểm tương đương.
(d) Trước khi chuẩn độ, pH của hai acid bằng nhau.
Mỗi phát biểu sau đây về thuyết Bronsted – Lowry là đúng hay sai?
(a) Các ion tác dụng với nước nếu tạo ra 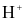 là acid, nếu tạo ra
là acid, nếu tạo ra 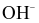 là base.
là base.
(b) Tất cả mọi acid và base đều phân li hoàn toàn trong nước.
(c) Base là một chất làm tăng nồng độ ion hydroxide trong nước.
(d) Acid là chất có khả năng cho 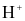 . Base là chất có khả năng nhận
. Base là chất có khả năng nhận 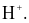
Cho phản ứng tổng hợp ammonia:
N2(g) + 3H2(g) 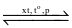 2NH3(g)
2NH3(g) 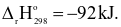
(a) Phản ứng trên có phản ứng thuận là phản ứng tỏa nhiệt.
(b) Khi tăng nhiệt độ của hệ thì cân bằng chuyển dịch theo chiều nghịch.
(c) Khi giảm áp suất của hệ thì cân bằng chuyển dịch theo thuận.
(d) Thực tế để phản ứng tổng hợp NH3 đạt hiệu suất cao thì người ta thực hiện ở nhiệt độ phòng và áp suất cao.
Người ta thường sản xuất vôi bằng phản ứng nhiệt phân calcium carbonate theo phương trình nhiệt hóa học sau: CaCO3(s)  CaO(s) + CO2(g)
CaO(s) + CO2(g) 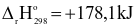
(a) Phản ứng trên có phản ứng thuận là phản ứng tỏa nhiệt.
(b) Khi tăng nhiệt độ của hệ, cân bằng trên sẽ chuyển dịch theo chiều thuận.
(c) Khi tăng áp suất của hệ, cân bằng trên sẽ chuyển dịch theo chiều nghịch.
(d) Để nâng cao hiệu suất của phản ứng nhiệt phân calcium carbonate ta cần thực hiện phản ứng ở nhiệt độ thấp.
Cho hai phản ứng:
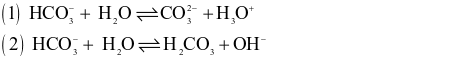
Xét theo thuyết acid – base của Bronsted – Lowry.
(a) Trong phản ứng thuận của phản ứng (1) thì 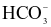 là base, H2O là acid.
là base, H2O là acid.
(b) Trong phản ứng thuận của phản ứng (2) thì 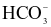 là acid, H2O là base.
là acid, H2O là base.
(c) 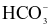 vừa có tính acid, vừa có tính base nên là chất lưỡng tính.
vừa có tính acid, vừa có tính base nên là chất lưỡng tính.
(d) H2O vừa có tính acid, vừa có tính base nên là chất lưỡng tính.
Cho các dung dịch có cùng nồng độ: NaOH (1), H2SO4 (2), HCl(3), KNO3 (4). Giá trị pH của các dung dịch được sắp xếp theo chiều tăng từ trái sang phải là? (Biểu diễn bằng cách viết liên số thứ tự các dung dịch, ví dụ: 1234 hay 4321 …)
Cho các chất sau đây: HCl, H2O, HNO3, HF, HNO2, KNO3, H2CO3, CH3COOH, H2S, Ba(OH)2. Số chất thuộc loại điện li yếu là bao nhiêu?
Cho phản ứng thủy phân ester sau:

Hằng số tốc độ phản ứng thuận và phản ứng nghịch của sự thủy phân ester trên lần lượt là 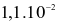 giây-1 và
giây-1 và 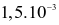 giây-1.
giây-1.
Biết rằng động học của phản ứng thủy phân ester trên phù hợp với định luật tác dụng khối lượng. Hằng số cân bằng của phản ứng là? (Làm tròn đến hàng phần trăm).
Trộn lẫn 3 dung dịch H2SO4 0,1 M, HNO3 0,2 M và HCl 0,3 M với những thể tích bằng nhau, thu được dung dịch X. Lấy 300 mL dung dịch X cho phản ứng với V lít dung dịch Y gồm NaOH 0,2 M và KOH 0,3 M, thu được dung dịch Z có pH = 3. Giá trị V là ?
Trong dung dịch trung hòa về điện, tổng đại số điện tích của các ion bằng không. Dung dịch A có chứa 0,02 mol Mg2+; 0,01 mol Na+; 0,02 mol Cl− và x mol 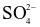 . Giá trị của x là?
. Giá trị của x là?
Để xác định nồng độ của một dung dịch HCl, người ta tiến hành chuẩn độ bằng dung dịch NaOH 0,1M. Để chuẩn độ 10 mL dung dịch HCl trên cần 30 mL dung dịch NaOH. Xác định nồng độ mol của dung dịch HCl trên.
Hòa tan 12,5 gam tinh thể CuSO4.5H2O trong nuớc thành 200mL dung dịch. Tính nồng độ mol của ion Cu2+ có trong dung dịch thu được.
Cho phương trình hóa học sau:
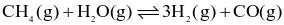
Biết rằng, ở 760 °C các chất đều ở thể khí và nồng độ mol của CH4, H2O, H2 và CO ở trạng thái cân bằng lần lượt là 0,126M; 0,242M; 1,150M và 0,126M.
Tính hằng số cân bằng 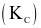 của phản ứng ở 760 °C. (Làm tròn đến hàng phần trăm)
của phản ứng ở 760 °C. (Làm tròn đến hàng phần trăm)
Nabica là một loại thuốc có thành phần chính là muối được dùng để trung hòa bớt lượng acid HCl dư trong dạ dày. Giả sử nồng độ dung dịch HCl trong dạ dày là 0,035M. Khi bệnh nhân uống 0,588 gam bột
được dùng để trung hòa bớt lượng acid HCl dư trong dạ dày. Giả sử nồng độ dung dịch HCl trong dạ dày là 0,035M. Khi bệnh nhân uống 0,588 gam bột 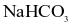 thì trung hòa được bao nhiêu mL dung dịch HCl trong dạ dày?
thì trung hòa được bao nhiêu mL dung dịch HCl trong dạ dày?
Trộn 200 mL dung dịch NaOH 0,1M với 300 mL dung dịch HCl 0,2M thu được dung dịch 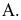 Tính pH của dung dịch A. (Làm tròn đến hàng phần mười).
Tính pH của dung dịch A. (Làm tròn đến hàng phần mười).


