Đề kiểm tra Hóa 10 Kết nối tri thức Chương 6 có đáp án - Đề 1
28 câu hỏi
Tốc độ phản ứng là
đại lượng đặc trưng cho sự tăng nồng độ của chất phản ứng.
đại lượng đặc trưng cho sự thay đổi nồng độ của chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
đại lượng đặc trưng cho sự thay đổi áp suất của chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
đại lượng đặc trưng cho sự thay đổi nhiệt độ của chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
Yếu tố nào sau đây không làm ảnh hưởng đến tốc độ phản ứng?
Nồng độ.
Nhiệt độ.
Áp suất.
Khối lượng chất rắn.
Chất xúc tác là
chất làm giảm tốc độ phản ứng, nhưng không bị tiêu hao trong phản ứng.
chất làm tăng tốc độ phản ứng, nhưng bị tiêu hao trong phản ứng.
chất làm tăng tốc độ phản ứng nhưng không bị thay đổi cả lượng và chất sau khi phản ứng kết thúc.
chất làm thay đổi tốc độ phản ứng, nhưng bị tiêu hao không nhiều trong phản ứng.
Thông thường đối với các phản ứng có chất khí tham gia, khi tăng áp suất, tốc độ phản ứng
giảm.
không đổi.
tăng.
không xác định được.
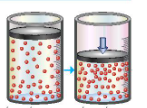
Thực hiện 2 thí nghiệm theo hình vẽ sau.
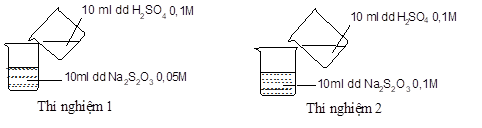
Ở thí nghiệm nào xuất hiện kết tủa trước?
Thí nghiệm 1 có kết tủa xuất hiện trước.
Thí nghiệm 2 có kết tủa xuất hiện trước.
Không xác định được.
Không có kết tủa xuất hiện.
Cho cùng một lượng kẽm (zinc) vào các cốc khác nhau chứa cùng một lượng dung dịch hydrochloric acid, trường hợp nào sẽ có tốc độ phản ứng nhanh nhất?
Kẽm ở dạng viên tròn nhỏ.
Kẽm ở dạng lá mỏng.
Kẽm ở dạng bột mịn, khuấy đều .
Kẽm ở dạng sợi, mảnh.
Cho các phản ứng sau:
(1) Phản ứng than cháy trong không khí.
(2) Phản ứng tạo gỉ sắt.
(3) Phản ứng nổ của khí bình gas.
(4) Phản ứng lên men rượu.
Phản ứng xảy ra với tốc độ nhanh nhất là
(1).
(2).
(3).
(4).
Tốc độ tức thời của phản ứng là
sự thay đổi nồng độ của chất phản ứng hoặc sản phẩm trong một đơn vị thời gian.
tốc độ tính trung bình trong một khoảng thời gian phản ứng.
tốc độ phản ứng tại một thời điểm nào đó.
tốc độ phản ứng trong một khoảng thời gian nào đó.
Để hạn chế sự ôi thiu thực phẩm do các phản ứng của oxygen cũng như sự hoạt động của vi khuẩn, người ta thường bơm khí nào sau đây vào các túi đựng thực phẩm trước khi đóng gói?
O2.
N2.
CO2.
N2 hoặc CO2.
Tốc độ phản ứng tính theo định luật tác dụng khối lượng là
tốc độ phản ứng trung bình.
tốc độ tức thời của phản ứng tại một thời điểm.
tốc độ phản ứng trung bình tại một thời điểm.
tốc độ phản ứng tức thời trong một khoảng thời gian.
Nhận xét nào sau đây là không đúng về hằng số tốc độ phản ứng?
Giá trị của hằng số tốc độ phản ứng chỉ phụ thuộc vào nhiệt độ và bản chất các chất tham gia phản ứng.
Hằng số tốc độ của phản ứng càng lớn thì tốc độ của phản ứng đó càng lớn.
Hằng số tốc độ phản ứng có giá trị đúng bằng tốc độ phản ứng khi nồng độ các chất phản ứng bằng nhau và bằng 1M.
Hằng số tốc độ của phản ứng càng lớn thì tốc độ của phản ứng đó càng nhỏ.
Phản ứng của H2 và I2 là phản ứng đơn giản:
H2 (g) + I2 (g) → 2HI (g)
Theo định luật tác dụng khối lượng, tốc độ của phản ứng này được viết dưới dạng là
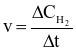 .
.
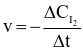 .
.
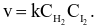
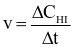 .
.
Nếu chia một vật thành nhiều phẩn nhỏ hơn thì tổng diện tích bề mặt sẽ
giảm đi.
tăng lên.
không thay đổi.
không xác định được.
Hệ số nhiệt độ Van’t Hoff được kí hiệu là
∝.
γ.
φ.
θ.
Chất làm giảm tốc độ phản ứng mà sau phản ứng nó không bị thay đổi về lượng và chất được gọi là
chất ức chế.
chất xúc tác.
chất hoạt hóa.
chất điện li.
Biện pháp nào sau đây không làm tăng diện tích bề mặt của khối chất?
Đập nhỏ khối chất.
Tạo lỗ xốp trong lòng khối chất.
Làm đầy các rãnh trên bề mặt khối chất.
Tạo nhiều đường rãnh trên bề mặt khối chất.
Năng lượng hoạt hóa là
năng lượng cần cung cấp cho phản ứng hóa học.
năng lượng tối thiểu cần cung cấp cho các hạt (nguyên tử, phân tử hoặc ion) để va chạm giữa chúng gây ra phản ứng hóa học.
năng lượng tối đa có thể cung cấp cho các hạt (nguyên tử, phân tử hoặc ion) để gây ra phản ứng hóa học.
lượng nhiệt tỏa ra hoặc thu vào khi hình thành phản ứng hóa học.
Hình ảnh dưới đây minh họa ảnh hưởng của yếu tố nào tới tốc độ phản ứng:
Diện tích bề mặt tiếp xúc.
Nhiệt độ.
Áp suất.
Chất xúc tác.
Nghiên cứu ảnh hưởng của diện tích bề mặt đến tốc độ phản ứng:
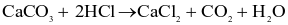
Chuẩn bị: 2 bình tam giác, dung dịch HCl 0,5 M, đá vôi dạng viên, đá vôi đập nhỏ.
Tiến hành:
- Cho cùng một lượng (khoảng 2 g) đá vôi dạng viên vào bình tam giác (1) và đá vôi đập nhỏ vào
bình tam giác (2).
- Rót 20 mL dung dịch HCl 0,5 M vào mỗi bình.
(a) Phản ứng trong bình 1 có tốc độ thoát khí chậm hơn so với bình 2.
(b) Diện tích bề mặt tiếp xúc càng lớn thì tốc độ phản ứng càng chậm.
(c) Đá vôi dạng đập nhỏ có tổng diện tích bề mặt lớn hơn.
(d) Phản ứng trên thuộc loại phản ứng oxi hóa – khử.
Phản ứng: 2NO(g) + O2(g) → 2NO2(g) có tốc độ phản ứng phù hợp với biểu thức  Nếu thể tích của bình phản ứng đột ngột giảm một nửa, mỗi phát biểu sau là đúng hay sai?
Nếu thể tích của bình phản ứng đột ngột giảm một nửa, mỗi phát biểu sau là đúng hay sai?
(a) Áp suất của các khí NO và O2 giảm xuống.
(b) Áp suất của các khí NO và O2 tăng lên.
(c) Tốc độ phản ứng giảm 8 lần so với khi chưa giảm thể tích.
(d) Tốc độ phản ứng tăng 4 lần so với khi chưa giảm thể tích.
Cho các phát biểu sau về tốc độ phản ứng hóa học.
(a) Tốc độ phản ứng giảm khi tăng nồng độ chất phản ứng.
(b) Tốc độ phản ứng phụ thuộc vào nhiệt độ và thường tăng khi nhiệt độ tăng.
(c) Tốc độ phản ứng giảm theo thời gian vì nồng độ chất phản ứng giảm.
(d) Tốc độ phản ứng là như nhau tại bất kì thời điểm nào trong suốt quá trình phản ứng.
Cho phương trình hóa học:
Mg (s) + 2HCl (aq) 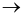 MgCl2(aq)+ H2(g)
MgCl2(aq)+ H2(g)
(a) Trong phản ứng (1), Mg là chất khử.
(b) Khi tăng nồng độ của HCl, tốc độ phản ứng tăng.
(c) Khi thay dây Mg bằng bột Mg, tốc độ phản ứng tăng.
(d) Nếu thay Mg bằng Cu thì phản ứng xảy ra tương tự.
Cho các yếu tố có thể ảnh hưởng đến tốc độ phản ứng nói chung như sau:
(1) Đun nóng chất tham gia; (2) Thêm xúc tác phù hợp; (3) Pha loãng dung dịch; (4) Giảm nhiệt độ; (5) Tăng nhiệt độ; (6) Giảm diện tích bề mặt; (7) Tăng nồng độ chất phản ứng; (8) Chia nhỏ chất phản ứng thành mảnh nhỏ.
Có bao nhiêu yếu tố làm tăng tốc độ phản ứng nói chung?
Cho phản ứng X + Y → Z.Khi bắt đầu phản ứng, nồng độ chất X là 0,024 mol/L. Sau 10s xảy ra phản ứng, nồng độ của X là 0,022 mol/L. Tốc độ phản ứng trong trường hợp này là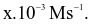 Giá trị của x là?
Giá trị của x là?
NOCl là chất khí độc, sinh ra do sự phân hủy nước cường toan (hỗn hợp 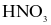 và HCl có tỉ lệ 1 : 3). NOCl có tính oxi hóa mạnh, ở nhiệt độ cao bị phân hủy theo phản ứng hóa học sau: 2NOCl → 2NO + Cl2. Tốc độ phản ứng ở
và HCl có tỉ lệ 1 : 3). NOCl có tính oxi hóa mạnh, ở nhiệt độ cao bị phân hủy theo phản ứng hóa học sau: 2NOCl → 2NO + Cl2. Tốc độ phản ứng ở 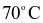 là
là 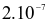 mol/(L.s) và ở
mol/(L.s) và ở 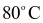 là
là 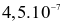 mol/(L.s). Hệ số nhiệt độ
mol/(L.s). Hệ số nhiệt độ 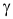 của phản ứng là bao nhiêu?
của phản ứng là bao nhiêu?
Khi nhiệt độ tăng thêm 10oC, tốc độ phản ứng hoá học tăng thêm 2 lần. Tốc độ phản ứng sẽ tăng lên bao nhiêu lần khi nâng nhiệt độ từ 20oC lên 70oC?
Phosgen (COCl2) là một chất độc hóa học được sử dụng trong chiến tranh thế giới thứ nhất. Phản ứng tổng hợp phosgen như sau: CO + Cl2 → COCl2. Biểu thức tốc độ phản ứng có dạng: 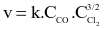 . Tốc độ phản ứng giảm bao nhiêu lần nếu giảm nồng độ Cl2 xuống 4 lần?
. Tốc độ phản ứng giảm bao nhiêu lần nếu giảm nồng độ Cl2 xuống 4 lần?
Cho phương trình hóa học của phản ứng: X + 2Y → Z + T. Ở thời điểm ban đầu, nồng độ của chất X là 0,01 mol/L. Sau 20 giây, nồng độ của chất X là 0,008 mol/L. Tốc độ trung bình của phản ứng tính theo chất X trong khoảng thời gian trên là 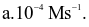 Giá trị của a là?
Giá trị của a là?


