Bài tập ôn tập Hóa 10 Kết nối tri thức Chương 6 có đáp án
50 câu hỏi
Phát biểu nào sau đây là đúng?
Tốc độ của phản ứng hoá học có thể có giá trị âm hoặc dương.
Tốc độ của phản ứng hoá học là hiệu số nồng độ của một chất trong hỗn hợp phản ứng tại hai thời điểm khác nhau.
Trong cùng một phản ứng hoá học, tốc độ tiêu thụ các chất phản ứng khác nhau sẽ như nhau nếu chúng được lấy với cùng một nồng độ.
Trong cùng một phản ứng hoá học, tốc độ tạo thành của các chất sản phẩm khác nhau là khác nhau, tuỳ thuộc vào hệ số cân bằng của chúng trong phương trình hoá học.
Tốc độ phản ứng là
độ biến thiên nồng độ của một chất phản ứng trong một đơn vị thời gian.
độ biến thiên nồng độ của một sản phẩm phản ứng trong một đơn vị thời gian.
độ biến thiên nồng độ của một chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
độ biến thiên nồng độ của các chất phản ứng trong một đơn vị thời gian.
Hằng số tốc độ phản ứng k phụ thuộc vào
thể tích và bản chất các chất tham gia phản ứng.
nhiệt độ và bản chất các chất tham gia phản ứng.
tốc độ độ và bản chất các chất tham gia phản ứng.
áp suất và bản chất các chất tham gia phản ứng.
Cho phản ứng đơn giản: 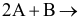 sản phẩm. Khi tăng nồng độ chất A lên gấp đôi, tốc độ phản ứng thay đổi như thế nào?
sản phẩm. Khi tăng nồng độ chất A lên gấp đôi, tốc độ phản ứng thay đổi như thế nào?
Tăng 2 lần.
Tăng 6 lần.
Tăng 4 lần.
Không đổi.
Tốc độ tức thời của phản ứng là
tốc độ được tính một khoảng thời gian.
sự biến thiên nồng độ.
tốc độ được tính tại một thời điểm nhất định.
biến thiên khối lượng của phản ứng.
Trong các cặp phản ứng sau, nếu lượng Fe trong các cặp đều được lấy bằng nhau và có kích thước như nhau thì cặp nào có tốc độ phản ứng lớn nhất?
Fe + dung dịch HCl 0,3 M.
Fe + dung dịch HCl 0,5 M.
Fe + dung dịch HCl 0,1 M.
Fe + dung dịch HCl 0,2 M.
Cho phản ứng hóa học sau: Zn (s) + H2SO4 (aq, dư) → ZnSO4 (aq) + H2 (g)
Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng?
Diện tích bề mặt Zn.
Nồng độ dung dịch sulfuric acid.
Thể tích dung dịch sulfuric acid.
Nhiệt độ của dung dịch sulfuric acid.
Củi khi được chẻ nhỏ sẽ cháy nhanh và mạnh hơn so với củi có kích thước lớn. Yếu tố nào đã được sử dụng để làm tăng tốc độ phản ứng trong trường hợp trên?
Chất xúc tác.
Diện tích bề mặt tiếp xúc.
Nồng độ.
Nhiệt độ.
Phản ứng nào sau đây không thay đổi tốc độ khi tăng áp suất?
2H2(g) + O2(g) → 2H2O(l).
2(g) + Cl2(g) → 2HCl(g).
CO(g) + 2H2(g) → CH3OH(g).
MgO(s) + H2SO4(aq) → MgSO4(aq) + H2O(g).
Cho các biện pháp sau:
(a) Dùng khí nén, nóng thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang).
(b) Bảo quản thực phẩm trong tủ lạnh để giữ thực phẩm tươi lâu.
(c) Nghiền nguyên liệu trước khi nung để sản xuất clinker.
(d) Cho bột sắt làm xúc tác trong quá trình sản xuất NH3 từ N2 và H2.
Số biện pháp được sử dụng để tăng tốc độ phản ứng là
1.
2.
3.
4.
Yếu tố nào dưới đây đã được sử dụng để làm tăng tốc độ của phản ứng rắc men vào tinh bột đã được nấu chín (cơm, ngô, khoai, sắn) để ủ rượu?
Nhiệt độ.
Nồng độ.
Chất xúc tác.
Áp suất.
Xét phản ứng  Tốc độ trung bình của sự mất đi của
Tốc độ trung bình của sự mất đi của 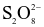 tương ứng với biểu thức nào sau đây?
tương ứng với biểu thức nào sau đây?
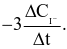
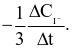
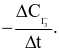
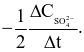
Cho phản ứng đơn giản xảy ra trong bình kín: 2NO(g) + O2(g) 2NO2(g) có biểu thức tốc độ tức thời: 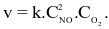 Nếu nồng độ của NO không đổi, nồng độ O2 tăng 3 lần, thì tốc độ sẽ
Nếu nồng độ của NO không đổi, nồng độ O2 tăng 3 lần, thì tốc độ sẽ
không đổi.
tăng 1,5 lần.
giảm 2 lần.
tăng 3 lần.
Đồ thị biểu diễn đường cong động học của phản ứng giữa oxygen và hydrogen tạo thành nước: O2(g) + 2H2(g) 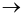 2H2O(g), như sau:
2H2O(g), như sau:
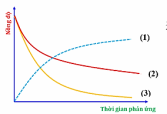
Đường cong nào của hydrogen?
Đường cong số (3).
Đường cong số (1).
Đường cong số (2) hoặc (3) đều đúng.
Đường cong số (2).
Cho phản ứng:
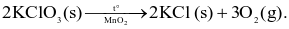
Yếu tố nào sau đây không ảnh hưởng đến tốc độ của phản ứng?
Chất xúc tác.
Nhiệt độ.
Kích thước tinh thể KClO3.
Áp suất.
Khảo sát phản ứng của 1 gam Zn bột trong dung dịch HCl với 3 thí nghiệm sau:
| Thí nghiệm | Nhiệt độ (oC) | Nồng độ dung dịch HCl(M) |
| 1 | 40 | 3,0 |
| 2 | 20 | 3,0 |
| 3 | 40 | 6,0 |
Tốc độ phản ứng của các thí nghiệm sắp xếp theo chiều giảm dần là
3, 2, 1.
2, 3, 1.
3, 1, 2.
1, 2, 3.
Một phản ứng có hệ số nhiệt độ Van’t Hoff bằng 2, tốc độ phản ứng thay đổi như thế nào khi tăng nhiệt độ của phản ứng từ 30oC lên 60oC?
giảm 9 lần.
tăng 8 lần.
tăng 9 lần.
giảm 8 lần.
Cho ba mẫu đá vôi (100% 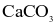 ) có cùng khối lượng: mẫu 1 dạng khối, mẫu 2 dạng viên nhỏ, mẫu 3 dạng bột mịn vào ba cốc đựng cùng thể tích dung dịch HCl (dư, cùng nồng độ, ở điều kiện thường). Thời gian để đá vôi tan hết trong ba cốc tương ứng là
) có cùng khối lượng: mẫu 1 dạng khối, mẫu 2 dạng viên nhỏ, mẫu 3 dạng bột mịn vào ba cốc đựng cùng thể tích dung dịch HCl (dư, cùng nồng độ, ở điều kiện thường). Thời gian để đá vôi tan hết trong ba cốc tương ứng là 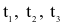 giây. So sánh nào sau đây đúng?
giây. So sánh nào sau đây đúng?
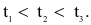
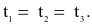
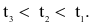
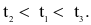
Tốc độ phản ứng không phụ thuộc yếu tố nào sau đây?
Chất xúc tác.
Bề mặt tiếp xúc giữa các chất phản ứng.
Nồng độ các chất tham gia phản ứng.
Thời gian xảy ra phản ứng.
Xét phản ứng: A + 2B → 3C + D. Tốc độ trung bình của sự mất đi của B tương đương với biểu thức nào sau đây?
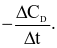
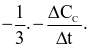
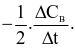
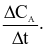
Cho phương trình hóa học của phản ứng tổng hợp ammonia như sau:
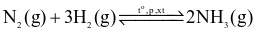
Khi tăng nồng độ của hydrogen lên 2 lần, tốc độ phản ứng thuận
tăng lên 8 lần.
giảm đi 2 lần.
tăng lên 6 lần.
tăng lên 2 lần.
Cho phản ứng đơn giản xảy ra trong bình kín theo phương trình hóa học:
2NO(g) + O2(g) 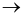 2NO2(g)
2NO2(g)
Theo định luật tác dụng khối lượng, biểu thức tốc độ tức thời của phản ứng trên là (k là hằng số tốc độ phản ứng)
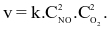
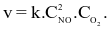
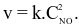
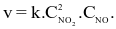
Thực hiện phản ứng: 2ICl + H2  I2 + 2HCl.
I2 + 2HCl.
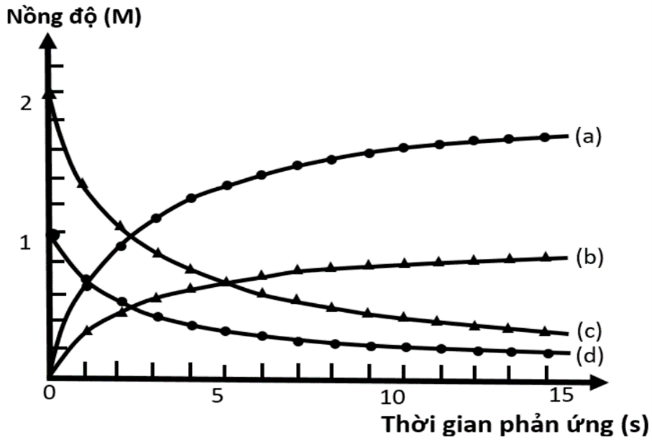
Nồng độ đầu của ICl và H2 được lấy đúng theo tỉ lệ hợp thức. Nghiên cứu sự thay đổi nồng độ các chất tham gia và chất tạo thành trong phản ứng theo thời gian, thu được đồ thị như hình bên.
Cho biết các đường (a), (b), (c), (d) tương ứng với sự biến đổi nồng độ các chất nào trong phương trình phản ứng trên.
I2, HCl, H2, ICl.
I2, ICl, H2, HCl.
HCl, I2, H2, ICl.
HCl, I2, ICl, H2.
Thực hiện phản ứng sau:
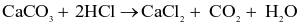
Theo dõi thể tích 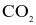 thoát ra theo thời gian, thu được đồ thị như sau (thể tích khí được đo ở áp suất khí quyển và nhiệt độ phòng).
thoát ra theo thời gian, thu được đồ thị như sau (thể tích khí được đo ở áp suất khí quyển và nhiệt độ phòng).
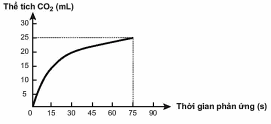
Trong các phát biểu sau, phát biểu nào không đúng?
Tốc độ trung bình của phản ứng trong các khoảng thời gian 15 giây là như nhau.
Tốc độ phản ứng giảm dần theo thời gian.
Tốc độ trung bình của phản ứng trong khoảng thời gian từ thời điểm đầu đến 75 giây là 0,33 mL/s.
Ở thời điểm 90 giây, tốc độ phản ứng bằng 0.
Khi cho cùng một lượng magnesium vào cốc đựng dung dịch acid HCl, tốc độ phản ứng sẽ lớn nhất khi dùng magnesium ở dạng
viên nhỏ.
bột mịn, khuấy đều.
lá mỏng.
thỏi lớn.
Có hai cốc chứa dung dịch Na2S2O3 với nồng độ mol trong cốc (1) lớn hơn cốc (2). Thêm dung dịch H2SO4 1M lần lượt vào hai cốc. Hiện tượng quan sát được là
cốc (1) xuất hiện kết tủa chậm hơn cốc (2).
cốc (1) xuất hiện kết tủa nhanh hơn cốc (2).
cốc (1) và cốc (2) xuất hiện kết tủa với tốc độ như nhau.
cốc (1) xuất hiện kết tủa vàng nhạt, cốc (2) không thấy kết tủa.
Tốc độ trung bình  của một phản ứng được viết theo biến thiên nồng độ các chất theo thời gian như sau:
của một phản ứng được viết theo biến thiên nồng độ các chất theo thời gian như sau:
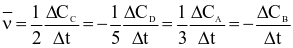
4A + B → 2C + 3D.
B + 5D → 2C + 3A.
4A + 2B → 2C + 3D.
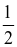 D + B → 4A + 2C.
D + B → 4A + 2C.
Tốc độ trung bình 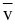 của một phản ứng được viết theo biến thiên nồng độ các chất theo thời gian như sau:
của một phản ứng được viết theo biến thiên nồng độ các chất theo thời gian như sau:
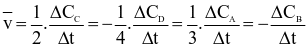
Phản ứng đó là
4A + B → 2C + 3D.
4A + 2B → 2C + 3D.
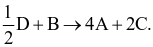
B + 4D → 2C + 3A.
Cho phản ứng đơn giản: 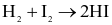
Người ta thực hiện 3 thí nghiệm với nồng độ các chất đầu (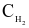 và
và 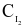 ) được lấy khác nhau và xác định được tốc độ tạo thành HI trong 20 giây đầu tiên, kết quả cho trong bảng sau:
) được lấy khác nhau và xác định được tốc độ tạo thành HI trong 20 giây đầu tiên, kết quả cho trong bảng sau:
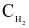 (M) (M) | 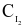 (M) (M) | 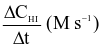 |
| 0,10 | 0,20 | 5,00 |
| 0,20 | 0,20 | 10,00 |
| 0,10 | 0,15 | 3,75 |
Biểu thức định luật tác dụng viết cho phản ứng trên là
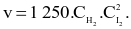
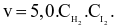
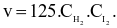
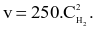
Nghiên cứu ảnh hưởng của diện tích bề mặt đến tốc độ phản ứng:
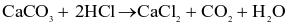
Chuẩn bị: 2 bình tam giác, dung dịch HCl 0,5 M, đá vôi dạng viên, đá vôi đập nhỏ.
Tiến hành:
- Cho cùng một lượng (khoảng 2 g) đá vôi dạng viên vào bình tam giác (1) và đá vôi đập nhỏ vào
bình tam giác (2).
- Rót 20 mL dung dịch HCl 0,5 M vào mỗi bình.
(a) Phản ứng trong bình 1 có tốc độ thoát khí chậm hơn so với bình 2.
(b) Diện tích bề mặt tiếp xúc càng lớn thì tốc độ phản ứng càng chậm.
(c) Đá vôi dạng đập nhỏ có tổng diện tích bề mặt lớn hơn.
(d) Phản ứng trên thuộc loại phản ứng oxi hóa – khử.
Trong quy trình sản xuất sulfuric acid, xảy ra phản ứng hoá học sau:
2SO2(g) + O2(g) 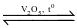 2SO3(g)
2SO3(g)
(a) Khi tăng nồng độ khí SO2 hay O2 thì tốc độ phản ứng đều tăng lên.
(b) Xúc tác sẽ dần chuyển hoá trong quá trình phản ứng nhưng khối lượng không đổi.
(c) Tăng diện tích bề mặt của xúc tác V2O5 sẽ làm tăng tốc độ phản ứng.
(d) Cần hạ nhiệt độ bình phản ứng để đẩy nhanh tốc độ phản ứng.
Xét phản ứng: H2 + Cl2 → 2HCl.
Nghiên cứu sự thay đổi nồng độ một chất trong phản ứng theo thời gian, thu được đồ thị sau:
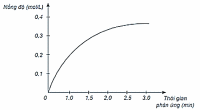
(a) Đồ thị mô tả sự thay đổi nồng độ theo thời gian của H2.
(b)Biểu thức tốc độ trung bình của phản ứng là 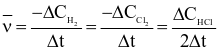 .
.
(c) Đồ thị mô tả sự thay đổi nồng độ theo thời gian của Cl2.
(d) Phản ứng trên có thể xảy ra ngay trong bóng tối.
Thực hiện phản ứng:  Nồng độ đầu của ICl và
Nồng độ đầu của ICl và  được lấy đúng theo tỉ lệ hợp thức. Nghiên cứu sự thay đổi nồng độ các chất tham gia và chất tạo thành trong phản ứng theo thời gian, thu được đồ thị sau:
được lấy đúng theo tỉ lệ hợp thức. Nghiên cứu sự thay đổi nồng độ các chất tham gia và chất tạo thành trong phản ứng theo thời gian, thu được đồ thị sau:
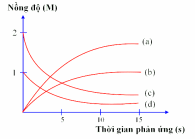
(a) Đường (a) biểu diễn nồng độ I2 thay đổi theo thời gian, nồng độ tăng dần.
(b) Đường (a) biểu diễn nồng độ HCl thay đổi theo thời gian, nồng độ tăng dần lượng tăng gấp đôi I2.
(c) Trong quá trình phản ứng, nồng độ ICl và H2 tăng dần còn nồng độ I2 và HCl giảm dần.
(d) Đường (c) biểu diễn nồng độ ICl thay đổi theo thời gian, nồng độ giảm dần, lượng giảm gấp đôi H2.
Phản ứng: 2NO(g) + O2(g) → 2NO2(g) có tốc độ phản ứng phù hợp với biểu thức  Nếu thể tích của bình phản ứng đột ngột giảm một nửa, mỗi phát biểu sau là đúng hay sai?
Nếu thể tích của bình phản ứng đột ngột giảm một nửa, mỗi phát biểu sau là đúng hay sai?
(a) Áp suất của các khí NO và O2 giảm xuống.
(b) Áp suất của các khí NO và O2 tăng lên.
(c) Tốc độ phản ứng giảm 8 lần so với khi chưa giảm thể tích.
(d) Tốc độ phản ứng tăng 4 lần so với khi chưa giảm thể tích.
Trong đời sống và trong sản xuất, con người áp dụng nhiều biện pháp kĩ thuật để thay đổi tốc độ phản ứng.
(a) Khi làm than để đun bếp người ta lại làm các lỗ rỗng (gọi là than tổ ong) để than dễ cháy và cháy mạnh hơn.
(b) Khi ủ bếp than, người ta đậy nắp bếp lò thật kín làm cho phản ứng cháy của than chậm lại.
(c) Khi cần cháy lâu, lửa nhỏ thì người ta chẻ nhỏ thanh củi lớn.
(d) Để đẩy nhanh quá trình sản xuất gang, nên dùng không khí nén, nóng thổi vào lò cao.
Cho các phát biểu sau về tốc độ phản ứng hóa học.
(a) Tốc độ phản ứng giảm khi tăng nồng độ chất phản ứng.
(b) Tốc độ phản ứng phụ thuộc vào nhiệt độ và thường tăng khi nhiệt độ tăng.
(c) Tốc độ phản ứng giảm theo thời gian vì nồng độ chất phản ứng giảm.
(d) Tốc độ phản ứng là như nhau tại bất kì thời điểm nào trong suốt quá trình phản ứng.
Cho a g kim loại Zn dạng hạt vào lượng dư dung dịch HCl 2M ở nhiệt độ phòng. Nếu giữ nguyên các điều kiện khác, chỉ biến đổi một trong các điều kiện phản ứng như sau thì tốc độ phản ứng tăng lên.
(a) Thay dung dịch HCl 2M bằng dung dịch HCl 3M.
(b) Thay a g Zn hạt bằng a g bột Zn.
(c) Thêm nước vào bình phản ứng lên thể tích gấp đôi.
(d) Làm lạnh dung dịch HCl.
Cho phương trình hóa học:
Mg (s) + 2HCl (aq) 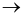 MgCl2(aq)+ H2(g)
MgCl2(aq)+ H2(g)
(a) Trong phản ứng (1), Mg là chất khử.
(b) Khi tăng nồng độ của HCl, tốc độ phản ứng tăng.
(c) Khi thay dây Mg bằng bột Mg, tốc độ phản ứng tăng.
(d) Nếu thay Mg bằng Cu thì phản ứng xảy ra tương tự.
Thực hiện bốn thí nghiệm sau để khảo sát các yếu tố ảnh hưởng đến tốc độ phản ứng
| Thí nghiệm | Chất phản ứng | Nhiệt độ phản ứng |
| I | Dây magnesium dư và 50 ml sulfuric acid 1M | 30oC |
| II | Dây magnesium dư và 50 ml hydrochloric acid 1M | 30oC |
| III | Bột magnesium dư và 50 ml hydrochloric acid 1M | 40oC |
| IV | Dây magnesium dư và 50 ml sulfuric acid 1M | 40oC |
(a) Thí nghiệm II có tốc độ phản ứng chậm hơn thí nghiệm III.
(b) Thể tích khí thoát ra ở thí nghiệm I nhỏ hơn thí nghiệm IV.
(c) Thể tích khí thoát ra ở thí nghiệm I bằng 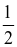 lần thí nghiệm II.
lần thí nghiệm II.
(d) Phương trình hóa học của phản ứng thí nghiệm III là Mg + 2HCl → MgCl2 + H2↑.
Cho các yếu tố có thể ảnh hưởng đến tốc độ phản ứng nói chung như sau:
(1) Đun nóng chất tham gia; (2) Thêm xúc tác phù hợp; (3) Pha loãng dung dịch; (4) Giảm nhiệt độ; (5) Tăng nhiệt độ; (6) Giảm diện tích bề mặt; (7) Tăng nồng độ chất phản ứng; (8) Chia nhỏ chất phản ứng thành mảnh nhỏ.
Có bao nhiêu yếu tố làm tăng tốc độ phản ứng nói chung?
Cho phản ứng sau: 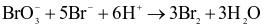
Sau một thời gian đo được: 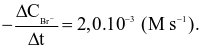
Tốc độ trung bình của phản ứng trên trong khoảng thời gian đó là 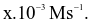 Giá trị của x là?
Giá trị của x là?
Cho phản ứng X + Y → Z.Khi bắt đầu phản ứng, nồng độ chất X là 0,024 mol/L. Sau 10s xảy ra phản ứng, nồng độ của X là 0,022 mol/L. Tốc độ phản ứng trong trường hợp này là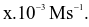 Giá trị của x là?
Giá trị của x là?
Xét phản ứng:
2ClO2 + 2KOH → KClO3 + KClO2 + H2O
Tốc độ phản ứng được viết như sau: 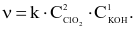 Nếu tăng nồng độ của các chất phản ứng chlorine dioxide (ClO2) lên 2 lần và potasium hydroxide (KOH) lên 3 lần thì tốc độ phản ứng tăng lên bao nhiêu lần?
Nếu tăng nồng độ của các chất phản ứng chlorine dioxide (ClO2) lên 2 lần và potasium hydroxide (KOH) lên 3 lần thì tốc độ phản ứng tăng lên bao nhiêu lần?
NOCl là chất khí độc, sinh ra do sự phân hủy nước cường toan (hỗn hợp 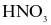 và HCl có tỉ lệ 1 : 3). NOCl có tính oxi hóa mạnh, ở nhiệt độ cao bị phân hủy theo phản ứng hóa học sau: 2NOCl → 2NO + Cl2. Tốc độ phản ứng ở
và HCl có tỉ lệ 1 : 3). NOCl có tính oxi hóa mạnh, ở nhiệt độ cao bị phân hủy theo phản ứng hóa học sau: 2NOCl → 2NO + Cl2. Tốc độ phản ứng ở 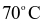 là
là 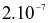 mol/(L.s) và ở
mol/(L.s) và ở 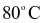 là
là 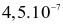 mol/(L.s). Hệ số nhiệt độ
mol/(L.s). Hệ số nhiệt độ 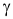 của phản ứng là bao nhiêu?
của phản ứng là bao nhiêu?
Khi nhiệt độ tăng lên 10 oC, tốc độ của một phản ứng hóa học tăng lên 3 lần. Hỏi tốc độ của phản ứng đó tăng lên bao nhiêu lần khi nâng nhiệt độ lên từ 30 oC đến 50 oC?
Khi nhiệt độ tăng thêm 10oC, tốc độ phản ứng hoá học tăng thêm 2 lần. Tốc độ phản ứng sẽ tăng lên bao nhiêu lần khi nâng nhiệt độ từ 20oC lên 70oC?
Khi nhiệt độ tăng thêm 10oC, tốc độ phản ứng hoá học tăng lên 3 lần. Để tốc độ phản ứng đó (đang tiến hành ở 30oC) tăng lên 27 lần thì cần thực hiện phản ứng ở nhiệt độ bao nhiêu độ C?
Phosgen (COCl2) là một chất độc hóa học được sử dụng trong chiến tranh thế giới thứ nhất. Phản ứng tổng hợp phosgen như sau: CO + Cl2 → COCl2. Biểu thức tốc độ phản ứng có dạng: 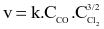 . Tốc độ phản ứng giảm bao nhiêu lần nếu giảm nồng độ Cl2 xuống 4 lần?
. Tốc độ phản ứng giảm bao nhiêu lần nếu giảm nồng độ Cl2 xuống 4 lần?
Cho phương trình hóa học của phản ứng: X + 2Y → Z + T. Ở thời điểm ban đầu, nồng độ của chất X là 0,01 mol/L. Sau 20 giây, nồng độ của chất X là 0,008 mol/L. Tốc độ trung bình của phản ứng tính theo chất X trong khoảng thời gian trên là 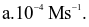 Giá trị của a là?
Giá trị của a là?
Đối với phản ứng: A +3B 2C, phát biểu nào sau đây đúng?
Tốc độ tiêu hao chất B bằng 3/2 tốc độ tạo chất C
Tốc độ tiêu hao chất B bằng 2/3 tốc độ tạo chất C
Tốc độ tiêu hao chất B bằng 3 tốc độ tạo chất C
Tốc độ tiêu hao chất B bằng 1/3 tốc độ tạo chất C


