28 CÂU HỎI
Dụng cụ nào dùng để đo thể tích của chất lỏng?
A. Ống đong.
B. Mặt kính đồng hồ.
C. Bát sứ.
D. Ống nghiệm.
Dụng cụ nào dùng để lấy từng lượng nhỏ chất rắn dạng bột?
A. Thìa thủy tinh.
B. Mặt kính đồng hồ.
C. Bát sứ.
D. Đũa thủy tinh.
Việc không được làm trong phòng thực hành thí nghiệm?
A. Ngửi, nếm các hóa chất.
B. Đọc kĩ nhãn mác lọ hóa chất trước khi sử dụng.
C. Đậy kín các lọ đựng hóa chất sau khi lấy.
D. Thực hiện theo hướng dẫn của giáo viên hoặc người phụ trách.
Thiết bị nào dùng để cung cấp năng lượng trong mạch điện?
A. Pin điện.
B. Công tắc.
C. Cầu chì.
D. Điện trở.
Khí hydrogen được xem là loại nhiên liệu sạch vì khi cháy trong oxygen tạo ra hơi nước. Chất tham gia của phản ứng đó là:
A. hydrogen và oxygen.
B. hydrogen.
C. oxygen.
D. nước.
Quá trình nào dưới đây là quá trình thu nhiệt?
A. Đá viên tan chảy.
B. Đốt than.
C. Xăng cháy.
D.Đốt cháy cồn.
Lập phương trình hóa học được tiến hành theo thứ tự nào với các bước sau:
(1) Cân bằng số nguyên tử của mỗi nguyên tố.
(2) Viết sơ đồ phản ứng.
(3) Kiểm tra và viết phương trình hóa học.
(4) So sánh số nguyên tử của mỗi nguyên tố có trong phân tử của các chất phản ứng và các chất sản phẩm.
A. (2), (4), (1), (3).
B. (1), (2), (3), (4).
C. (4), (3), (2), (1).
D. (1), (3), (2), (4).
Chọn phát biểu sai khi nói về tỉ khối của chất khí.
A. Tỉ khối của khí A đối với khí B là tỉ số giữa khối lượng của khí A và khối lượng của khí B.
B. Tỉ khối của khí A đối với khí B là tỉ số giữa khối lượng mol của khí A và khối lượng mol của khí B.
C. Tỉ khối của khí A đối với khí B nhỏ hơn 1 => Khí A nhẹ hơn khí B.
D. Tỉ khối của khí A đối với khí B lớn hơn 1 => Khí A nặng hơn khí B.
Ở điều kiện chuẩn (áp suất 1 bar và nhiệt độ 25oC) thể tích của 1 mol khí bất kì là
A. 24,79 lít.
B. 24,79 ml.
C. 24 lít.
D. 22,4 lít.
Chọn phát biểu sai khi nói về độ tan của một chất trong nước và nồng độ của dung dịch.
A. Nồng độ phần trăm của dung dịch cho biết số gam chất tan có trong 100 gam nước.
B. Nồng độ phần trăm của dung dịch cho biết số gam chất tan có trong 100 gam dung dịch.
C. Nồng độ mol của dung dịch cho biết số mol chất tan có trong 1 lít dung dịch.
D. Độ tan của một chất trong nước là số gam chất đó hòa tan trong 100 gam nước để tạo thành dung dịch bão hòa ở một nhiệt độ, áp suất xác định.
Trong các biến đổi dưới đây, có bao nhiêu sự biến đổi vật lí?
- Hòa tan muối ăn vào nước được dung dịch nước muối.
- Nước đá tan chảy.
- Đốt cháy than sinh ra khí carbon dioxide.
- Cô cạn nước muối thu được muối khan.
A. 3.
B. 1.
C. 4.
D. 2.
Trong các biến đổi dưới đây, có bao nhiêu sự biến đổi hóa học?
- Hòa tan muối ăn vào nước được dung dịch nước muối.
- Đốt cháy gas để đun nấu.
- Đốt cháy than sinh ra khí carbon dioxide.
- Cô cạn nước muối thu được muối khan.
A. 2.
B. 4.
C. 1.
D. 3.
Khối lượng mol của carbon dioxide (CO2) là
A. 44 gam/mol.
B. 12 gam/mol.
C. 32 gam/mol.
D. 28 gam/mol.
Khối lượng của 0,5 mol của carbon oxide (CO) là
A. 14 gam.
B. 12 gam.
C. 16 gam.
D. 28 gam.
Khí O2 nặng hay nhẹ hơn khí CO bao nhiêu lần?
A. Khí O2 nặng hơn khí CO 1,143 lần.
B. Khí O2 nhẹ hơn khí CO 1,143 lần.
C. Khí O2 nặng hơn khí CO 0,875 lần.
D. Khí O2 nhẹ hơn khí CO 0,875 lần.
Ở 25oC, 250 gam nước có thể hòa tan tối đa 80 gam KNO3. Độ tan của KNO3 ở 25oC là
A. 32 gam/100 gam nước.
B. 80 gam/100 gam nước.
C. 170 gam/100 gam nước.
D. 250 gam/100 gam nước.
Acid là
A. những hợp chất trong phân tử có nguyên tử hydrogen liên kết với gốc acid. Khi tan trong nước, acid tạo ra ion H+.
B. những hợp chất trong phân tử có nguyên tử hydrogen liên kết với gốc acid.
C. những hợp chất trong phân tử có nguyên tử hydrogen liên kết với gốc acid. Khi tan trong nước, acid tạo ra ion OH-.
D. những hợp chất trong phân tử có nguyên tử oxygen liên kết với gốc acid. Khi tan trong nước, acid tạo ra ion H+.
Acid nào có trong thành phần của giấm ăn?
A. Acetic acid.
B. Sulfuric acid.
C. Hydrochloric acid.
D. Nitric acid.
Base là
A. những hợp chất trong phân tử có nguyên tử kim loại liên kết với nhóm hydroxide. Khi tan trong nước, base tạo ra ion OH-.
B. những hợp chất trong phân tử có nguyên tử kim loại liên kết với gốc acid.
C. những hợp chất trong phân tử có nguyên tử kim loại liên kết với nhóm hydroxide. Khi tan trong nước, base tạo ra ion H+.
D. những hợp chất trong phân tử có nguyên tử kim loại liên kết với gốc acid. Khi tan trong nước, acid tạo ra ion H+.
Chọn phát biểu sai khi nói về base.
A. Tất cả các base là kiềm.
B. Base được chia làm hai loại chính là: Base tan và base không tan trong nước.
C. Khi tan trong nước, base tạo ra ion OH-
D. Kiềm là các base tan trong nước.
Chọn phát biểu sai khi nói về thang pH.
A. pH <7 thì dung dịch có môi trường base.
B. Thang pH được dùng để biểu thị độ acid, base của dung dịch.
C. pH = 7 thì dung dịch có môi trường trung tính..
D. pH > 7 thì dung dịch có môi trường base.
Chọn phát biểu sai khi nói về oxide.
A. Oxide là hợp chất của hydrogen với một nguyên tố khác.
B. Dựa vào khả năng phản ứng với acid và base, oxide được phân thành 4 loại.
C. Oxide là hợp chất của oxygen với một nguyên tố khác..
D. Oxide acid và oxide base đều có khả năng tạo ra muối.
Copper tác dụng với oxygen tạo ra copper (II) oxide. Phương trình hóa học của phản ứng là
A. 2Cu + O2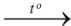 2CuO.
2CuO.
B. Cu + O2 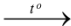 2CuO.
2CuO.
C. 2Cu + O2 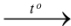 CuO.
CuO.
D. Cu + O2 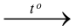 CuO.
CuO.
Phosphorus tác dụng với oxygen tạo ra điphosphorus pentoxide. Phương trình hóa học của phản ứng là
A. 4P + 5O2 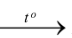 2P2O5.
2P2O5.
B. 2P + 5O2 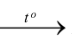 2P2O5.
2P2O5.
C. P + 5O2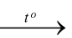 P2O5.
P2O5.
D. P + O2 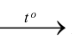 P2O5.
P2O5.
Hệ số thích hợp của các chất trong phản ứng: Na + O2 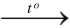 Na2O, lần lượt là
Na2O, lần lượt là
A. 4, 1, 2.
B. 2, 1, 1.
C. 1, 1, 2.
D. 2, 1, 2.
Cho các oxide sau: CuO, MgO, CO2, SO3, CaO, Na2O, SO2, Fe2O3. Số oxide tác dụng được với dung dịch KOH là
A. 3.
B. 4.
C. 5.
D. 2.
Cho các oxide sau: CuO, MgO, CO2, SO3, CaO, Na2O, SO2, Fe2O3. Số oxide tác dụng được với dung dịch HCl là
A. 5.
B. 4.
C. 3.
D. 2.
Cho các oxide sau: MgO, CO, Al2O3, SO3, NO, SO2, Fe2O3. Số oxide có khả năng tạo muối là
A. 5.
B. 4.
C. 3.
D. 2.
