Bộ 3 đề thi giữa kì 2 Hóa 12 Chân trời sáng tạo có đáp án (Đề 2)
20 câu hỏi
Cho biết số thứ tự của Al trong bảng tuần hoàn là 13. Số electron lớp ngoài cùng của Al là
1.
2.
3.
4.
Trong quá trình điện phân KCl nóng chảy với các điện cực trơ, ở cathode xảy ra quá trình
oxi hóa ion K+.
khử ion K+.
oxi hóa ion Cl–.
khử ion Cl–.
Cặp oxi hóa – khử của kim loại là
dạng oxi hóa và dạng khử của cùng một nguyên tố kim loại
dạng oxi hóa và dạng khử của cùng một hợp chất của kim loại.
dạng oxi hóa và dạng khử của các dạng thù hình của một nguyên tố kim loại.
dạng oxi hóa và dạng khử của một cation kim loại và kim loại đó.
Kim loại có tính dẫn nhiệt, dẫn điện, tính dẻo, ánh kim là do
kim loại có cấu trúc mạng tinh thể.
kim loại có tỉ khối lớn.
các electron tự do trong kim loại gây ra.
kim loại có bán kính nguyên tử và điện tích hạt nhân nhỏ.
Trong công nghiệp, nhôm được tách ra từ quặng bauxite bằng cách nào sau đây?
Nung nóng quặng bauxite.
Nung nóng quặng bauxite với carbon.
Nung nóng quặng bauxite với hydrogen.
Điện phân nóng chảy quặng bauxite.
Kim loại cơ bản trong duralumin là
Al
Zn.
Cu.
Mg.
Một dây phơi quần áo gồm một đoạn dây đồng nối với một đoạn dây thép. Hiện tượng nào xảy ra ở chỗ nối hai đoạn dây khi để lâu ngày?
Sắt và đồng đều không bị ăn mòn.
Sắt bị ăn mòn.
Sắt và đồng đều bị ăn mòn.
Đồng bị ăn mòn.
Một loại pháo hoa có chứa một số thành phần như sodium nitrate, sodium oxalate và cryolite. Khi cháy, loại pháo hoa này sẽ tạo ra màu gì trên bầu trời đêm?
Vàng.
Xanh.
Đỏ.
Tím.
Trong pin nhiên liệu, người ta sử dụng phản ứng giữa hydrogen và oxygen. Biến thiên enthalpy chuẩn của phản ứng oxi hoá hoàn toàn 2 mol là –483,6 kJ. Ý nghĩa của thông tin về enthalpy cho biết
pin nhiên liệu toả ra 483,6 kJ khi sử dụng hết 2 mol
pin nhiên liệu thu vào 483,6 kJ khi sử dụng hết 2 mol
phản ứng trong pin nhiên liệu thuộc loại phản ứng tự diễn biến.
phản ứng trong pin nhiên liệu thuộc loại phản ứng giải phóng năng lượng.
Cho kim loại Fe lần lượt phản ứng với các dung dịch: FeCl3, Cu(NO3)2, AgNO3, MgCl2. Số trường hợp xảy ra phản ứng hoá học là
1.
2.
3.
4.
Thực hiện các thí nghiệm sau:
(1) Nhúng sợi dây bạc trong dung dịch HNO3.
(2) Đốt dây nhôm trong không khí.
(3) Lấy sợi dây đồng quấn quanh đinh sắt rồi nhúng vào dung dịch HCl.
(4) Nhúng thanh kẽm trong dung dịch CuSO4.
Số trường hợp xuất hiện ăn mòn điện hoá là
2.
3.
4.
5.
Để bảo quản kim một số kim loại mạnh, người ta thường ngâm chìm các kim loại đó vào trong dầu hoả. Hãy cho biết kim loại nào sau đây không bảo quản được bằng cách cho vào dầu hoả?
Na.
Li.
Ca.
K.
Sử dụng thiết bị sau với dòng điện một chiều, thực hiện mạ một chiếc thìa bằng kim loại như hình bên dưới:
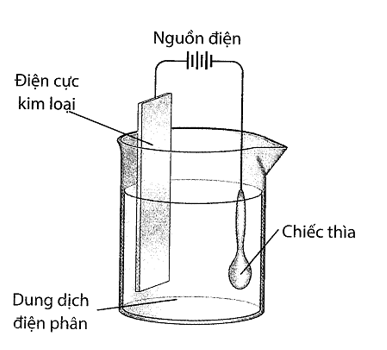
Cho các phát biểu sau:
a). Bạc sẽ bám lên chiếc thìa bởi vì bạc là kim loại rất hoạt động.
b). Dung dịch điện phân là muối bạc tan tốt trong nước.
c). Điện cực kim loại được làm bằng bạc.
d). Chiếc thìa được nối với cực âm của nguồn điện.
Thực hiện thí nghiệm: Đốt muối của một số kim loại kiềm
Bước 1: Lấy mẫu muối LiCl, NaCl và KCl cho vào các chén sứ có đánh số lần lượt là 1, 2, 3.
Bước 2: Cho khoảng 3−5 mL alcohol C2H5OH nguyên chất vào mỗi chén sứ.
Bước 3: Đốt cháy các mẫu muối trong chén sứ trên.
a). Sau bước 3, cả 3 chén đều cháy và cho các màu ngọn lửa khác nhau.
b). Sau bước 2 các mẫu muối tan một phần trong alcohol
c). Trình tự màu của 3 ngọn lửa lần lượt là: màu tím, màu vàng và màu đỏ tía.
d). Có thể dùng thí nghiệm này để nhận biết các hợp chất khác của hợp chất kim loại kiềm.
Năm 1866, Georges Leclanché đã phát minh ra một loại pin bao gồm anode bằng kẽm và cathode bằng mangan dioxide bọc trong một vật liệu xốp, nhúng trong lọ đựng dung dịch ammonium chloride. Cathode được trộn vào một ít carbon để cải thiện độ dẫn điện và hấp thụ điện. Pin cung cấp một điện áp khoảng 1,4 – 1,5V.
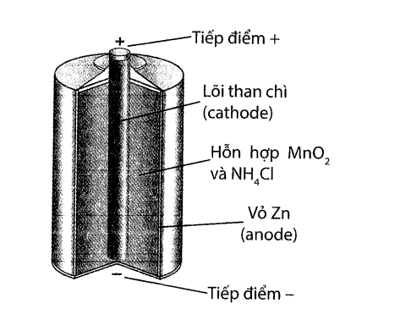
- Ở anode xảy ra bán phản ứng:
- Ở cathode xảy ra bán phản ứng:
Cho các phát biểu sau:
a). Ở anode xảy ra quá trình khử kẽm trên bề mặt của anode.
b). Ở anode xảy ra quá trình nhường electron (quá trình oxi hóa).
c). Anode chứa nhiều electron nên điện tích dương hơn cathode.
d). Ở cathode xảy ra quá trình oxi hóa thành
Số phát biểu đúng là?
Nguyên tố X tạo được ion Xn+ có cấu hình electron là 1s22s22p6, X là nguyên tố thuộc nhóm A trong bảng tuần hoàn các nguyên tố hoá học. Xác định số nguyên tố hóa học thỏa mãn với điều kiện trên?
Cho 6,00 gam hợp kim của bạc vào dung dịch HNO3 loãng (dư), đun nóng đến phản ứng hoàn toàn, thu được dung dịch có 4,25 gam AgNO3. Tính thành phần phần trăm về khối lượng của Ag trong hợp kim.
Điện phân 2 lít dung dịch NaCl 0,5 M với điện cực trơ, màng ngăn xốp bằng dòng điện có cường độ không đổi 0,2 A. Sau 1930 giây thì dừng điện phân, thu được dung dịch X (giả thiết thể tích dung dịch không đổi). Dung dịch X có pH bằng bao nhiêu? (Làm tròn kết quả đến hàng phần mười).
a) Trong các hoạt động của pin điện hóa Al-Zn nồng độ của các ion trong dung dịch biến đổi như thế nào?
b) Hãy giải thích trường hợp sau: Một vật được làm bằng hợp kim sắt (gang, thép) bị gỉ rất nhanh trong trường hợp bề mặt của vật tiếp xúc nước muối hoặc nước chanh.
a) Viết phương trình hóa học của phản ứng xảy ra khi thực hiện phản ứng giữa potassium lần lượt với lượng dư chlorine, oxygen và lưu huỳnh. Giả sử potassium bị oxi hóa hết trong mỗi phản ứng.
b) Cho một lượng nước thích hợp vào mỗi sản phẩm thu được ở ý a) để thu được các dung dịch có nồng độ khoảng 0,1 M. Dự đoán pH của mỗi dung dịch thu được và giải thích.





