Bộ 2 Đề kiểm tra Giữa học kì 2 Hóa 10 Chân trời sáng tạo có đáp án- Đề 1
32 câu hỏi
Phản ứng hoá học xảy ra trong thí nghiệm nào sau đây là phản ứng oxi hoá – khử?
Cho mẩu đá vôi vào dung dịch HCl.
Nhiệt phân Mg(OH)2 thì thu được MgO màu trắng.
Cho kim loại Al tác dụng với dung dịch HCl có khí thoát ra.
Nhỏ dung dịch AgNO3 vào dung dịch HCl thấy có kết tủa trắng.
Quy tắc xác định số oxi hoá nào sau đây là không đúng?
Trong đa số các hợp chất, số oxi hoá của hydrogen là +1.
Kim loại kiềm (nhóm IA) luôn có số oxi hoá +1 trong hợp chất.
Oxygen luôn có số oxi hoá là -2.
Trong hợp chất, fluorine có số oxi hoá là –1.
Số oxi hoá của phosphorus trong hợp chất PH3 là
-3.
+3.
+3.
+5.
Số oxi hoá của nitrogen trong hợp chất NH4+ là
-4.
+4.
-3.
+3.
Sulfur trong hợp chất nào sau đây có số oxi hoá là +4?
H2S.
SO3.
H2SO4.
Na2SO3.
Cho các hợp chất sau: FeO; FeCl2; Fe(OH)3; Fe2O3; FeSO4. Số hợp chất trong đó sắt có số oxi hoá +2 là
1.
2.
4.
3.
Cho phương trình hoá học sau: 2H2S + 3O2 → 2SO2 + 2H2O. Chất khử trong phương trình hoá học là
O2.
H2S.
SO2.
H2O.
Chất bị oxi hoá là
chất nhường electron.
chất nhận electron.
chất có số oxi hoá giảm xuống sau phản ứng.
chất có số oxi hoá không thay đổi sau phản ứng.
Copper(II) oxide (CuO) bị khử bởi ammonia (NH3) theo phản ứng sau:
Tổng hệ số cân bằng (tối giản) của phản ứng là?
11.
12.
13.
14.
Nguyên tử carbon trong trường hợp nào sau đây vừa thể hiện tính khử, vừa thể hiện tính oxi hoá khi tham gia phản ứng hoá học?
C.
CO2.
CaCO3.
CH4.
Cho các phản ứng sau:
(a) 4HCl + PbO2 → PbCl2 + Cl2 + 2H2O.
(b) HCl + NH4HCO3 → NH4Cl + CO2 + H2O.
(c) 2HCl + 2HNO3 → 2NO2 + Cl2 + 2H2O.
(d) 2HCl + Zn → ZnCl2 + H2.
Số phản ứng trong đó HCl thể hiện tính khử là
A. 2. B. 3.
C. 1. D. 4.
2.
3.
1.
4.
Cho 6,4 gram Cu tác dụng hết với lượng dư dung dịch H2SO4 đặc, nóng thu được V lít khí SO2 ở điều kiện chuẩn. Giá trị của V là
4,958.
2,479.
3,720.
0,297.
Cho đinh sắt vào ống nghiệm chứa 3 ml HCl, sắt phản ứng với HCl theo phương trình hoá học sau: Fe + 2HCl → FeCl2 + H2. Nhận xét nào sau đây là đúng?
Fe nhường electron nên là chất bị khử.
Ion H+ nhận electron nên là chất oxi hoá.
Quá trình oxi hoá:
D. Quá trình khử: .
Quá trình khử: .
Cho phương trình hóa học: aAl + bH2SO4 → cAl2(SO4)3 + dSO2 + eH2O.
Tỉ lệ a : b là
1 : 1.
2 : 3.
1 : 3.
1 : 2.
Cho các phản ứng sau:
(a) Phản ứng nhiệt phân Cu(OH)2 tạo thành CuO.
(b) Phản ứng trung hoà (acid tác dụng với base).
(c) Phản ứng nung clinker xi măng.
(d) Phản ứng oxi hoá glucose trong cơ thể.
Số phản ứng thu nhiệt là
1.
2.
3.
4.
Cho phản ứng sau:
2H2(g) + O2(g) → 2H2O(g)
Enthalpy tạo thành chuẩn của H2O(g) là
– 483,64 kJ/ mol.
483,64 kJ/ mol.
– 241,82 kJ/ mol.
241,82 kJ/ mol.
Cho các phản ứng sau:
(a) C(s) + O2(g) → CO2(g)
(b)
(c) CH4(g) + H2O(l) → CO(g) + 3H2(g)
(d) H2(g) + Cl2(g) → 2HCl(g)
Số phản ứng toả nhiệt là
4.
3.
2
1.
Cho giản đồ sau:
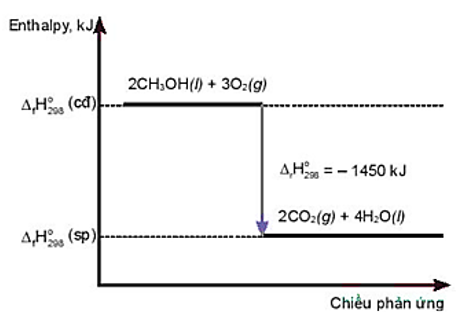
Phát biểu đúng là
Phản ứng thu nhiệt.
Nhiệt lượng thu vào của phản ứng là – 1450 kJ.
Phản ứng cần cung cấp nhiệt liên tục.
Nhiệt lượng toả ra của phản ứng là 1450 kJ.
Nhiệt kèm theo (nhiệt lượng toả ra hay thu vào) của một phản ứng hoá học ở áp suất không đổi (và thường ở một nhiệt độ xác định) gọi là
enthalpy tạo thành chuẩn của một chất.
enthalpy tạo thành của một chất.
biến thiên enthalpy chuẩn của phản ứng hoá học.
biến thiên enthalpy của phản ứng.
Cho phản ứng hoá học sau: 2Na(s) + Cl2(g) → 2NaCl(s). Biến thiên enthalpy chuẩn của phản ứng này được tính theo công thức là
Cho phản ứng sau: CaCO3(s) → CaO(s) + CO2(g).
Ở điều kiện chuẩn, biến thiên enthalpy của phản ứng là (Biết nhiệt tạo thành (kJ/mol) của CaCO3, CaO và CO2 lần lượt là -1 207, -635 và -393,5)
+178,5 kJ.
-178,5 kJ.
+ 357 kJ.
-357 kJ.
Cho các phát biểu sau:
(a). Tất cả các phản ứng cháy đều toả nhiệt.
(b). Phản ứng toả nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
(c). Tất cả các phản ứng mà chất tham gia có chứa nguyên tố oxygen đều toả nhiệt.
(d). Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt.
(e). Lượng nhiệt mà phản ứng hấp thụ hay giải phóng không phụ thuộc vào điều kiện thực hiện phản ứng và thể tồn tại của chất trong phản ứng.
(g). Sự cháy của nhiên liệu (xăng, dầu, khí gas, than, gỗ,...) là những ví dụ về phản ứng thu nhiệt vì cần phải khơi mào.
Số phát biểu đúng là
1.
2.
3.
4.
Phát biểu nào sau đây đúng?
Điều kiện chuẩn là điều kiện ứng với áp suất 1 bar (với chất khí), nồng độ 1 mol/ L (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298 K.
Điều kiện chuẩn là điều kiện ứng với nhiệt độ 298 K.
Áp suất 760 mmHg là áp suất ở điều kiện chuẩn.
Điều kiện chuẩn là điều kiện ứng với áp suất 1 atm, nhiệt độ 0 °C.
Phản ứng luyện gang trong lò cao xảy ra theo sơ đồ sau:
Fe2O3(s) + CO(g) Fe(s) + CO2(g)
Từ 1 mol Fe2O3 và 1 mol CO, giả sử chỉ xảy ra phản ứng theo sơ đồ trên với hiệu suất 100% thì giải phóng một lượng nhiệt là (Biết nhiệt tạo thành chuẩn của Fe2O3; CO; Fe; CO2 (kJ/ mol) lần lượt là -824,2; -110,5; 0 và -393,5)
8,27 kJ.
49,6 kJ.
12,4 kJ.
74,4 kJ.
Cho phản ứng hóa học sau: CH4(g) + Cl2(g) → CH3Cl(g) + HCl(g). Biến thiên enthalpy chuẩn của phản ứng này được tính theo công thức là
Cho phản ứng sau: H2(g) + Cl2(g) → 2HCl(g). Biến thiên enthalpy chuẩn của phản ứng là
Biết: Eb (H – H) = 436 kJ/mol, Eb (Cl – Cl) = 243 kJ/mol, Eb (H – Cl) = 432 kJ/ mol.
+158 kJ.
-158 kJ.
+185 kJ.
-185 kJ.
Phản ứng nào sau đây có thể tự xảy ra ở điều kiện thường?
Phản ứng nhiệt phân KClO3.
Phản ứng giữa H2 và O2 trong không khí.
Phản ứng giữa Mg và dung dịch H2SO4 loãng.
Phản ứng nhiệt phân thuốc tím.
Phản ứng tỏa nhiệt là
phản ứng hấp thụ năng lượng dưới dạng nhiệt.
phản ứng giải phóng năng lượng dưới dạng nhiệt.
phản ứng không có sự giải phóng năng lượng.
phản ứng có ∆rH > 0.
Trong phòng thí nghiệm, khí chlorine có thể được điều chế bằng cách cho MnO2 tác dụng với HCl đặc, đun nóng. Phản ứng hoá học xảy ra theo sơ đồ sau:
MnO2 + HCl MnCl2 + Cl2 + H2O
a) Lập phương trình hoá học của phản ứng theo phương pháp thăng bằng electron và chỉ rõ chất khử, chất oxi hoá.
b) Giả sử hiệu suất phản ứng đạt 100%. Tính khối lượng MnO2 cần dùng để thu được 2,479 lít khí Cl2 ở điều kiện chuẩn.
Cho phản ứng sau:
Fe2O3 (s) + 3CO (g) 2Fe (s) + 3CO2 (g) = –24,74 kJ
Vẽ sơ đồ biểu diễn biến thiên enthalpy của phản ứng.
Cho phản ứng sau: CH≡CH(g) + H2(g) → CH3-CH3(g)
Biết năng lượng liên kết (kJ/ mol) ở điều kiện chuẩn của H-H là 436, của C-C là 347, của C-H là 414 và của C≡C là 839. Hãy cho biết ở điều kiện chuẩn phản ứng thu nhiệt hay tỏa nhiệt?






