17 bài tập Hóa 10 Kết nối tri thức Bài 12: Liên kết cộng hóa trị (có lời giải)
17 câu hỏi
Viết công thức Lewis cho các phân tử H2O; CS2; SCl2 và CH4. Mỗi phân tử này có bao nhiêu cặp electron hóa trị riêng?
Hydrogen sulfide (H2S) và phosphine (PH3) đều là những chất có mùi khó ngửi và rất độc. Trình bày sự tạo thành liên kết cộng hóa trị trong các chất trên.
Viết ô orbital của lớp electron ngoài cùng cho nguyên tử H và F. Từ đó chỉ ra những AO nào có thể xen phủ tạo liên kết đơn trong các phân tử H2, F2 và HF.
Viết ô orbital của lớp electron ngoài cùng cho nguyên tử N. Từ đó chỉ ra những AO nào có thể xen phủ tạo liên kết ba trong phân tử N2
Cho giá trị năng lượng ở bảng sau:
Liên kết | Năng lượng liên kết (kJ/mol) |
O–H | 464 |
S–H | 368 |
a) Hãy tính tổng năng lượng liên kết trong mỗi phân tử H2S và H2O.
b) Nhiệt độ để bắt đầu phá vỡ liên kết (nhiệt độ phân hủy) trong hai chất trên ứng với một trong hai nhiệt độ sau: 400 0C hoặc 1000 0C. Em hãy dự đoán nhiệt độ phân hủy của chất nào cao hơn. Vì sao?
Khi phản ứng với H2, các phân tử như F2, N2 cần phải cắt đứt liên kết giữa các nguyên tử. Dựa vào năng lượng liên kết, em hãy dự đoán phản ứng của F2 hay của N2 với H2 sẽ thuận lợi hơn (dễ xảy ra hơn)?
Trình bày sự hình thành liên kết cho – nhận trong phân tử sulfur dioxide (SO2)
Viết công thức electron, công thức cấu tạo và công thức Lewis của các phân tử sau:
a) Bromine (Br2); b) Hydrogen sulfide (H2S);
c) Ammonia (NH3); d) Ethene (C2H4);
e) Ethyne (C2H2); g) Oxygen (O2)
Dựa vào giá trị độ âm điện, dự đoán loại liên kết (liên kết cộng hóa trị phân cực, liên kết cộng hóa trị không phân cực, liên kết ion) trong các phân tử: MgCl2, AlCl3, HBr, O2, H2 và NH3
Ammonia (NH3) khan (nguyên chất) được bơm vào đất dưới dạng khí, là nguồn phân đạm phổ biến ở Bắc Mỹ do giá thành và tuổi thọ tương đối lâu trong đất so với các dạng phân đạm khác. Do tính ổn định của ammonia khan trên đất lạnh, nông dân trồng ngô thường bón ammonia khan vào mùa thu để bắt đầu hoạt động gieo trồng vào mùa xuân. Giải thích sự tạo thành liên kết trong phân tử ammonia
Ozone (O3) là một chất khí có tính oxi hóa mạnh, phân tử gồm 3 nguyên tử oxygen. Ozone xuất hiện ở tầng đối lưu và tầng bình lưu của khí quyển. Tùy thuộc vào vị trí của ozone trong các tầng trên mà nó ảnh hưởng đến sự sống trên Trái Đất theo cách tốt, xấu khác nhau. Phân tử ozone có sự hiện diện liên kết cho – nhận. Viết công thức Lewis và công thức cấu tạo của ozone
Ammonium () là chất thải của quá trình trao đổi chất ở động vật. Với cá và động vật không xương sống dưới nước, ion ammonium được bài tiết trực tiếp vào nước. Ở động vật có vú, cá mập và động vật lưỡng cư, ion ammonium được chuyển đổi trong chu trình urea thành urea (NH2)2CO. Ở chim, bò sát và ốc trên cạn, ion ammonium được chuyển hóa thành uric acid. Trình bày liên kết cho – nhận trong ion ammonium
Hydrogen sulfide (H2S) là một chất khí không màu, mùi trứng thối, độc. Theo tài liệu của Cơ quan Quản lí an toàn và sức khỏe Hoa Kì, nồng độ H2S khoảng 100 ppm gây kích thích màng phổi. Nồng độ khoảng 400 – 700 ppm, H2S gây nguy hiểm đến tính mạng chỉ trong 30 phút. Nồng độ trên 800 ppm gây mất ý thức và nuy cơ làm tử vong ngay lập tức.
a) Viết công thức Lewis và công thức cấu tạo của H2S.
b) Em hiểu thể nào về nồng độ ppm của H2S trong không khí?
c) Một gian phòng trống (250C; 1 bar) có kích thước 3m x 4m x 6m bị nhiễm 10 gam khí H2S. Tính nồng độ của H2S trong gian phòng trên. Đánh giá mức độ độc hại của H2S trong trường hợp này
Nhận xét mối tương quan gữa độ dài liên kết và năng lượng liên kết dựa theo kết quả bảng sau:
| C–C | C=C | C≡C |
Độ dài liên kết ( | 1,54 | 1,34 | 1,20 |
Năng lượng liên kết (kJ/mol) | 347 | 614 | 839 |
Cho biết phân tử BF3 có cấu trúc phẳng, phân tử CCl4 có cấu trúc hình tứ diện đều. Hãy cho biết có bao nhiêu phân tử phân cực và không phân cực dưới đây? Giải thích.
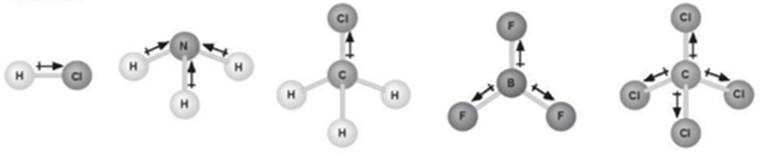
Giải thích vì sao độ âm điện của nitrogen (3,04) xấp xỉ độ âm điện của chlorine (3,16) nhưng ở điều kiện thường, nitrogen kém hoạt động hơn nhiều so với chlorine
a) Ở 250C và 0,99 atm, khả năng tan của carbon dioxide (CO2) trong nước là 1,45 gam/L, kém hơn nhiều so với sulfur dioxide (CO2) là 94 gam/L. Giải thích nguyên nhân sự khác biệt.
b) Nhận xét độ tan của carbon dioxide trong nước theo nhiệt độ dựa trên đồ thị sau:
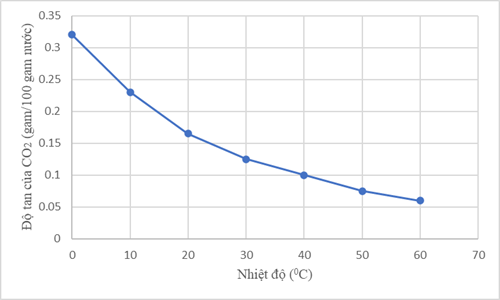
c) Nước giải khát có gas là gì? Vì sao người ta thường ướp lạnh các loại nước giải khát có gas trước khi sử dụng?
d) Vì sao trong những ngày hè nóng bức, cá thường phải ngoi lên mặt nước để thở, trong khi mùa lạnh, điều này không xảy ra?







