Trắc nghiệm tổng hợp Hóa 9 có đáp án (Phần 2)
385 câu hỏi
Định nghĩa và phân loại oxit.
Trong các oxit dưới đây, oxit nào là oxit axit, oxit nào là oxit bazơ, oxit nào là oxit lưỡng tính: FeO, ZnO, Al2O3, CaO, Mn2O7, P2O5, N2O5, SiO2.
Cho các oxit: CaO, SiO2, Fe2O3, Fe3O4, P2O5. Chất nào tan trong nước, chất nào tan trong dung dịch kiềm? Chất nào dùng để hút ẩm? Viết phương trình phản ứng xảy ra.
Trình bày tính chất của canxi oxit.
Để canxi oxit (vôi sống) lâu ngày trong không khí sẽ bị kém phẩm chất. Hãy giải thích hiện tượng này và viết phương trình hóa học có thể xảy ra.
Có ba lọ đựng chất bột màu rắng: Na2O, MgO, P2O5. Hãy nêu phương pháp thực nghiệm để nhận biết ba chất và viết phương trình phản ứng xảy ra.
Có hỗn hợp hai chất rắn là CaO và Fe2O3, bằng phương pháp hóa học nào có thể tách riêng được Fe2O3? Viết phương trình phản ứng xảy ra.
Viết các phương trình hóa học thực hiện những biến hóa hóa học theo sơ đồ sau:
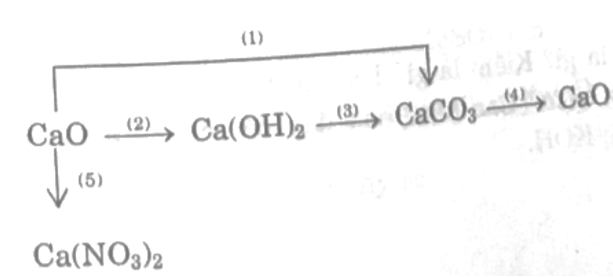
Hoàn thành các chuỗi biến hóa sau:
a.
b.
Hoàn thành chuỗi biến hóa:
Có hỗn hợp khí gồm CO2 và O2. Làm thế nào có thể thu được khí O2 tinh khiết từ hỗn hợp trên? Trình bày cách làm và viết phương trình phản ứng xảy ra.
Có 4 gói bột oxit màu đen tương tự nhau: CuO, MnO2, AgO và FeO. Chỉ dùng dung dịch HCl có thể nhận biết được những oxit nào?
Có 3 chất là Mg, Al, Al2O3. Chỉ được dùng một hóa chất làm thuốc thử phân biệt ba chất trên. Viết phương trình phản ứng.
Có ba lọ đựng chất bột màu trắng: Na2O, MgO, P2O5. Hãy nêu phương pháp thực nghiệm để nhận biết ba chất trên và viết phương trình phản ứng xảy ra.
Định nghĩa và phân loại axit.
a. Hãy nêu phương pháp chính để điều chế axit. Cho các thí dụ minh họa.
b. Viết 4 phản ứng thông thường tạo thành các axit H2SO4, H3PO4, HCl, HNO3.
Hãy trình bày tính chất hóa học của axit sunfuric.
Khi cho khí cacbonic vào nước có nhuộm quỳ tím thì nước chuyển sang màu đỏ, khi đun nóng thì màu nước lại chuyển thành màu tím. Hãy giải thích hiện tượng.
Bazơ là gì? Kiềm là gì? Hãy kể tên các bazơ là kiềm. Hãy nêu cách gọi tên bazơ. Các bazơ sau đây có tên riêng gì? NaOH; dung dịch Ca(OH)2; KOH .
Cho biết nhôm hiđroxit là hợp chất lưỡng tính, viết các phương trình phản ứng của nhôm hiđroxit với các dung dịch HCl và NaOH.
a. Phản ứng nào đặc trưng cho oxit bazơ, phản ứng nào chỉ đặc trưng cho oxit bazơ kiềm?
b. Phản ứng nào đặc trưng cho mọi bazơ? Phản ứng nào đặc trưng cho bazơ kiềm?
Trình bày tính chất hóa học của natri hiđroxit.
Làm thế nào để điều chế được canxi hiđroxit từ canxi oxit? Phương pháp này có thể áp dụng để điều chế đồng (II) hiđroxit từ đồng (II) oxit được không? Vì sao?
Định nghĩa và phân loại muối.
Muối X vừa tác dụng được với dung dịch HCl, vừa tác dụng được với dung dịch NaOH. Hỏi muối X thuộc loại muối trung hòa hay muối axit? Cho ví dụ minh họa.
Định nghĩa phản ứng trao đổi. Điều kiện để phản ứng trao đổi xảy ra, cho thí dụ minh họa. Phản ứng trung hòa có phải là phản ứng trao đổi không?
Khí CO2 được điều chế bằng phản ứng giữa axit HCl và CaCO3 có lẫn hơi nước và khí hiđro clora HCl. Làm thế nào để thu được CO2 tinh khiết?
Hoàn thành các phương trình phản ứng sau:
a. H2SO4 + Ba(NO3)2 e. FeSO4 + NaOH
b. HCl + AgNO3 f. Ba(NO3)2 + Na2SO4
c. HNO3 + CaCO3 g. MgSO4 + BaCl2
d. CuCl2 + KOH h. FeCl3 + NaOH
Giải thích tại sao phản ứng lại xảy ra.
Hãy cho biết trong dung dịch có thể đồng thời tồn tại các chất sau đâu được không?
a. NaOH và HBr.
b. H2SO4 và BaCl2.
c. KCl và NaNO3.
d. Ca(OH)2 và H2SO4.
e. NaCl và KOH.
Bổ túc và cân bằng các phương trình sau:
a.
b.
c.
d.
e.
f.
g.
Cho biết trong dung dịch đồng thời (có thể) tồn tại các chất sau đây được không?
a. KCl và NaNO3.
b. KOH và HCl.
c. Na3PO4 và CaCl2.
d. HBr và AgNO3.
e. BaCl2 và H2SO4.
g. NaHCO3 và HCl.
Có 4 chất rắn: đá vôi, xô đa, muối ăn, kali sunfat. Làm cách nào để phân biệt chúng khi chỉ được dùng nước và một hóa chất? Viết phương trình phản ứng.
Có ba ống nghiệm đựng ba chất lỏng trong suốt, không màu là ba dung dịch NaCl; HCl; Na2CO3. Không dùng thêm một chất nào khác (kể cả quỳ tím), làm thế nào để nhận ra từng chất?
Hòa tan 15,5g Na2O vào nước tạo thành 0,5 lít dung dịch.
a. Tính nồng độ mol/l của dung dịch thu được.
b. Tính thể tích dung dịch H2SO4 20% (d = 1,14 g/ml) cần để trung hòa dung dịch trên.
c. Tính nồng độ mol/l của dung dịch sau phản ứng.
a. Tìm công thức của oxit sắt trong đó Fe chiếm 70% khối lượng.
b. Khử hoàn toàn 2,4 gam hỗn hợp CuO và FexOy cùng số mol như nhau bằng hiđro thu được 1,76 gam kim loại. Hòa tan kim loại đó bằng dung dịch HCl dư thấy thoát ra 0,448 lít H2 (ở đktc). Xác định công thức của oxit sắt.
Cho 9,4g K2O vào nước. Tính khối lượng SO2 cần thiết phản ứng với dung dịch trên để tạo thành:
a. Muối trung hòa.
Cho 9,4g K2O vào nước. Tính khối lượng SO2 cần thiết phản ứng với dung dịch trên để tạo thành:
b. Muối axit.
c. Hỗn hợp muối axit và muối trung hòa theo tỉ lệ số mol là 1 : 2.
a. Hòa tan hoàn toàn 1,44 gam kim loại hóa trị II bằng 250ml dung dịch H2SO4 0,3M. Để trung hòa lượng axit dư cần dùng 60ml dung dịch NaOH 0,5M. Hỏi đó là kim loại gì?
b. Trộng 300ml dung dịch HCl 0,5M với 200ml dung dịch Ba(OH)2 nồng độ a mol/l thu được 500ml dung dịch trong đó nồng độ HCl là 0,02M. Tính a.
Cần thêm bao nhiêu gam SO3 vào 100g dung dịch H2SO4 10% để được dung dịch H2SO4 20%?
Để hòa tan hoàn toàn 5,1g oxit kim loại hóa trị III, người ta phải dùng 43,8g dung dịch HCl 25%. Hỏi đó là oxit của kim loại nào?
Người ta dẫn khí CO2 vào 1,2 lít dung dịch Ca(OH)2 1M thấy tạo ra 5g một muối không tan cùng với một muối tan.
a. Tính thể tích khí CO2 đã dùng (đktc).
b. Tính khối lượng và nồng độ M của muối tan.
c. Tính thể tích CO2 (đktc) trong trường hợp chỉ tạo ra muối không tan. Tính khối lượng muối không tan đó.
Dung dịch X chứa hỗn hợp HCl và H2SO4. Lấy 50ml dung dịch X cho tác dụng với AgNO3 dư thấy tạo thành 2,87 gam kết tủa. Lấy 50ml dung dịch X cho tác dụng với BaCl2 dư thấy tạo thành 4,66 gam kết tủa.
a. Tính nồng độ mol của mỗi axit trong dung dịch X.
b. Cần dùng bao nhiêu ml dung dịch NaOH 0,2M trung hòa 50ml dung dịch X.
Sau khi nung 8g một hỗn hợp kẽm cacbonat và kẽm oxit, người ta thu được 6,24g ZnO.
a. Tính % khối lượng hỗn hợp ban đầu.
b. Khí sinh ra được cho vào một dung dịch canxi hiđroxit. Tính khối lượng canxi hiđroxit để phản ứng chỉ tạo thành muối không tan.
Để trung hòa một dung dịch chứa 189g HNO3, đầu tiên người ta dùng dung dịch có chứa 112g KOH. Sau đó người ta lại đổ thêm dung dịch Ba(OH)2 25% cho trung hòa hết axit. Hãy:
a. Viết phương trình phản ứng đã xảy ra.
b. Tính khối lượng dung dịch Ba(OH)2 đã dùng.
Viết các phương trình thực hiện các biến hóa sau:
Tính lượng axit sunfuric thu được từ 60kg quặng pirit nếu hiệu suất phản ứng là 85% so với lí thuyết.
Tính lượng axit sunfuric thu được từ 60kg quặng pirit nếu hiệu suất phản ứng là 85% so với lí thuyết.
Hòa tan 3,1g Na2O vào nước để được 2 lít dung dịch
a. Cho biết nồng độ M của dung dịch thu được.
b. Muốn làm trung hòa dung dịch trên phải cần bao nhiêu gam dung dịch H2SO4 20%?
c. Tính nồng độ phân tử gam của muối tạo thành sau phản ứng. Biết rằng dung dịch H2SO4 20% có khối lượng riêng 1,14 g/ml.
Cho 11g dung dịch H2SO4 20% vào 400g dung dịch BaCl2 5,2%.
a. Viết phương trình phản ứng và tính khối lượng kết tủa tạo thành.
b. Tính nồng độ % của những chất có trong dung dịch sau khi tách bỏ kết tủa.
a. Người ta có thể điều chế khí anhidrit sunfurơ bằng cách cho H2SO4 đặc tác dụng với lưu huỳnh ở nhiệt độ cao, hay với đồng kim loại khi đun nóng. Viết các phản ứng hóa học của phản ứng.
b. Oxi hóa hoàn toàn 8 lít anhidrit sunfurơ (SO2) đo ở đktc. Sản phẩm thu được cho tan trong 57,2 ml dung dịch H2SO4 60% khối lượng riêng 1,5 g/ml. Tính nồng độ % của dung dịch axit thu được.
Trộn 30ml dung dịch có chứa 2,22g canxi clorua với 70ml dung dịch chứa 1,7g bạc nitrat.
a. Viết phương trình phản ứng đã xảy ra.
b. Tính lượng kết tủa thu được
c. Tính nồng độ mol/l của chất còn lại trong dung dịch. Cho rằng thể tích dung dịch sau phản ứng thay đổi không đáng kể.
Cho 38,2g hỗn hợp Na2CO3 và K2CO3 vào dung dịch HCl. Dẫn lượng khí sinh ra qua nước vôi trong có dư thu được 30g kết tủa. Tính khối lượng mỗi muối trong hỗn hợp.
Từ 80 tấn quặng pirit chứa 40% lưu huỳnh người ta sản xuất được 92 tấn axit sunfuric.
a. Hãy tính hiệu suất của quá trình sản xuất.
b. Từ lượng axit sunfuric này người ta có thể pha chế được bao nhiêu tấn dung dịch H2SO4 23%.
Hòa tan 13,3g hỗn hợp gồm NaCl và KCl vào nước được 500g dung dịch A. Lấy dung dịch A cho phản ứng với AgNO3 dư được 2,87g kết tủa.
a. Tính số gam mỗi muối ban đầu dùng.
Để hòa tan 2,4g oxit một kim loại hóa trị II cần dùng 2,19g axit HCl. Hỏi đó là oxit kim loại nào?
b. Tính nồng độ % các muối trong dung dịch A.
Cho 1,568 lít khí cacbonic (đktc) lội chậm qua dung dịch có hòa tan 3,2g NaOH. Hãy xác định thành phần định tính và định lượng chất được sinh ra sau phản ứng.
a. Viết các phản ứng phản ứng để thực hiện các biến hóa theo sơ đồ ghi dưới đây:
b. Trộn một dung dịch chứa 5,1g natri clorua với một dung dịch chứa 5,1g bạc nitrat. Tính lượng kết tủa được tạo thành sau phản ứng.
Cần dùng bao nhiêu lít dung dịch NaOH 0,5M để trung hòa 250ml dung dịch X chứa axit HCl 2M và H2SO4 1,5M.
Trộn 50ml dung dịch Na2CO3 0,2M với 100ml dung dịch CaCl2 0,15M thì thu được một lượng kết tủa đúng bằng lượng kết tủa thu được khi trộn 50ml Na2CO3 cho trên với 100ml dung dịch BaCl2 nồng độ a mol. Tính nồng độ a.
Cho 1 mol/l hợp chất clorua chưa biết hóa trị vào một dung dịch bạc nitrat bạc lấy dư. Ta thu được một chất kết tủa màu trắng, đem sấy khô và cân nặng 2,65g. Hãy xác định công thức của sắt clorua.
a. Có 3 gói phân hóa học KCl; NH4NO3 và supe phốt phát. Dựa vào phản ứng đặc trưng nào để phân biệt chúng?
b. Người ta điều chế phân đạm rê bằng cách cho khí cacbonic tác dụng với amoniac H3 ở nhiệt độ áp suất cao và có xúc tác theo phương trình hóa học:
Tính thể tích khí CO2 và NH3 (đktc) cần lấy để sản xuất 10 tấn urê, hiệu suất của quá trình là 80%.
Hòa tan hoàn toàn 55g hỗn hợp Na2CO3 và BaSO3 trong 250 mol/l dung dịch HCl 14,6%. Biết phản ứng chỉ tạo ra muối trung hòa.
a. Tính thể tích khí thu được sau phản ứng (đkc)
b. Tính nổng độ % của muối có trong dung dịch sau phản ứng.
Để hòa tan hoàn toàn 3,6g magie phải dùng bao nhiêu ml dung dịch hỗn hợp HCl 1M và H2SO4 0,75M.
Cho 5,6 lít khí CO2 lội qua dung dịch NaOH 20%.
(D = 1,22 g/mol)
a. Tính khối lượng muối tạo thành.
b. Tính nồng độ % các chất có trong dung dịch sau phản ứng.
Cho dung dịch H2SO4 vào dung dịch NaOH thu được 3,6g muối sunfat và 2,84g muối trung tính. Tính lượng dung dịch H2SO4 49% và dung dịch 20% đã dùng.
Hòa tan 49,6 mol/l hỗn hợp gồm một muối sunfat và một muối cacbonat của cùng một kim loại hóa trị I vào nước thu được dung dịch A. Chia dung dịch A làm 2 phần bằng nhau.
Phần I: Cho phản ứng với lượng dư dung dịch axit sunfuric thu được 2,24 lít khí (đktc).
Phần II: Cho phản ứng với lượng dư dung dịch BaCl2 thu được 43g kết tủa trắng.
a. Tìm công thức 2 muối ban đầu.
b. Tính % khối lượng các muối trên có trong hỗn hợp.
Tính thể tích dung dịch KOH 5,6% (D = 1,045) cần dùng làm trung hòa hết 350ml dung dịch H2SO4 0,5M.
Cho axit clohiđric phản ứng với 6g hỗn hợp dạng bột gồm Mg và MgO.
a. Tính thành phần % khối lượng của MgO vó trong hỗn hợp nếu phản ứng tạo ra 2,24 lít khí H2 (đktc).
b. Tính thể tích dung dịch HCl 20% (D = 1,1 g/ml) vừa đủ để phản ứng với hỗn hợp đó.
Dung dịch A chứa hỗn hợp NaOH và Ba(OH)2. Để trung hòa 50ml dung dịch A cần dùng 60ml dung dịch HCl 0,1M. Khi cho 50ml dung dịch A tác dụng với một lượng dư Na2CO3 thấy tạo thành 0,197 gam kết tủa. Tính nồng độ mol/l của NaOH và Ba(OH)2 trong dung dịch A.
Hòa tan hoàn toàn 27,4g hỗn hợp gồm M2CO3 và MHCO3 (M là kim loại kiềm) bằng 500ml dung dịch HCl 1M thấy thoát ra 6,72 lít CO2 (đktc). Để trung hòa lượng axit còn đủ phải dùng 50ml dung dịch NaOH 2M.
a. Xác định 2 muối ban đầu.
b. Tính % khối lượng các muối trên.
Thả 12g hỗn hợp nhôm và bạc vào dung dịch H2SO4 7,35%. Sau khi phản ứng kết thúc, người ta thu được 13,44 lít khí hiđro (đktc).
a. Tính % khối lượng mỗi kim loại có trong hỗn hợp.
b. Tính thể tích dung dịch H2SO4 cần dùng biết khối lượng riêng d = 1,025 g/ml.
Cho 100g hỗn hợp 2 muối clorua của cùng một kim loại A có hóa trị II và II tác dụng hoàn toàn với một dung dịch NaOH lấy dư. Biết khối lượng của hiđroxit kim loại hóa trị II là 19,8g và khối lượng clorua kim loại hóa trị II bằng 0,5 khối lượng mol của a.
a. Xác định kim loại A.
b. Tính % khối lượng của 2 muối trong hỗn hợp.
Những oxit sau: SO2; CO2; CO; CaO; MgO; CaO; Na2O; Al2O3; N2O5; K2O. Những oxit nào vừa tác dụng được với nước, vừa tác dụng được với axit hoặc vừa tác dụng được với nước, vừa tác dụng được với kiềm?
(1): SO2, CO, CO2, CaO, Na2O.
(2): SO2, CO2, N2O5.
(3): Na2O, CaO, Al2O3, MgO, CuO.
(4): Na2O, CaO, K2O.
(5): CuO, Al2O3, MgO, CO, K2O.
(2) (4).
(1) (2) (3).
(2) (3) (4).
(3) (5).
Hợp chất nào sau đây là bazơ?
Đồng (II) nitrat.
Kali clorua.
Lưu huỳnh đioxit.
Canxi hiđroxit.
Một trong những thuốc thử sau có thể dùng để phân biệt dung dịch natri sunfat và dung dịch natri cacbonat.
Dung dịch bari clorua.
Dung dịch axit clohiđric.
Dung dịch chì (II) nitrat.
Dung dịch natri hiđroxit.
Ttrong các oxit dưới đây: Al2O3; CaO; CO; Mn2O7; P2O5; N2O5; NO; SiO2; ZnO; Fe2O3.
Oxit axit:
Al2O3, CO, P2O5, SiO, NO.
P2O5, N2O5, ZnO, Mn2O7.
N2O5, P2O5, SiO2, Mn2O7.
Al2O3, SiO2, NO.
Ttrong các oxit dưới đây: Al2O3; CaO; CO; Mn2O7; P2O5; N2O5; NO; SiO2; ZnO; Fe2O3.
Oxit bazơ:
Al2O3, CaO, Fe2O3, SiO2.
CaO, Fe2O3.
Mn2O7, Fe2O3, ZnO, Al2O3.
CaO, SiO2, NO, Al2O3, CO.
Ttrong các oxit dưới đây: Al2O3; CaO; CO; Mn2O7; P2O5; N2O5; NO; SiO2; ZnO; Fe2O3.
Oxit lưỡng tính:
Al2O3, ZnO.
Mn2O7, SiO2, NO, ZnO.
Fe2O3, CO, Al2O3, P2O5.
Fe2O3, ZnO, CO, P2O5.
Ttrong các oxit dưới đây: Al2O3; CaO; CO; Mn2O7; P2O5; N2O5; NO; SiO2; ZnO; Fe2O3.
Oxit không tạo muối:
CaO, CO, SiO2.
CO, NO.
NO, ZnO, Mn2O7.
CaO, NO, Mn2O7, SiO2.
Để một mẩu natri hiđroxit trên miếng kính trong không khí, sau vài ngày thấy có chất rắn màu trắng phủ ngoài. Nếu nhỏ vài giọt dung dịch HCl vào chất rắn màu trắng thấy có khí không màu, không mùi thoát ra. Chất rắn màu trắng này là sản phẩm của phản ứng natri hiđroxit với:
Oxi trong không khí.
Hơi nước trong không khí.
Cacbon dioxit và oxi trong không khí.
Cacbon dioxit trong không khí.
Có ba oxit màu trắng: MgO, Al2O3, Na2O. Có thể nhận biết được các chất đó bằng thuốc thử sau đây không?
Chỉ dùng nước.
Chỉ dùng axit.
Chỉ dùng kiềm.
Dùng nước và kiềm
Những thí nghiệm nào sau đây sẽ tạo ra chất kết tủa khi trộn:
(1) Dung dịch natri clorua và dung dịch chì nitrat.
(2) Dung dịch natri cacbonat và dung dịch chì kẽm sunfat.
(3) Dung dịch natri sunfat và dung dịch nhôm clorua.
(4) Dung dịch kẽm sunfat và dung dịch đồng (II) clorua.
(5) Dung dịch bari clorua và dung dịch nitrat
(1) (2) (5).
(1) (2) (3).
(2) (4) (5).
(3) (4) (5).
(1) H2 + … = Cu + H2O
(2) … + O2 = 2H2O
(3) C + H2O = CO + …
(4) Mg + H2O = … + H2
(5) Mg + 2HCl = … + H2
Các chất được điền vào ô trống lần lượt theo thứ tự
Mg; H2; Cl; O2; H2.
CuO; H2; H2; MgO; MgCl2.
H2; Cu; Mg; O2; H2O.
H2; CuO; MgO; O2; H2.
Có những chất sau:
A. Đồng
B. Đồng (II) oxit.
C. Magie cacbonat.
D. Magie;
E. Magie oxit.
Chất nào nói trên tác dụng với dung dịch axit clohiđric hoặc axit sunfuric loãng sinh ra:
1. Chất khí cháy được trong không khí.
2. Chất khí làm đục nước vôi trong.
3. Dung dịch có màu xanh.
4. Dung dịch không màu và nước.
Có 4 oxit sau:
I. SO3
II. CaO
III. CrO3
IV. MgO
Tập hợp nào sau đây là oxit axit?
I + II.
II + III.
I + III.
III + IV.
Cho phương trình phản ứng sau:
H2SO4, Na2SO4.
N2O5, NaNO3.
HCl, NaCl.
(A) (B) đều đúng.
Có sơ đồ chuyển hóa sau: Biết (X) là chất rắn
X là FeS2; Y là SO3.
X là FeS2 hoặc S; Y là SO3.
X là O2; Y là SO3.
Tất cả đều đúng.
Có năm ống nghiệm chứa các dung dịch sau: Ba(NO3)2, H2SO4, NaOH và Na2CO3. Biết rằng chỉ dùng một hóa chất duy nhất để nhận biết các hóa chất ở trong ống nghiệm.
Dùng phenolphtalein không màu.
Dùng giấy quỳ tím.
Dùng dung dịch Axit HCl.
Dùng dung dịch BaCl2.
Có những chất rắn sau: MgO, P2O5, Ba(OH)2, Na2SO4. Dùng những thuốc thử nào có thể phân biệt được các chất trên?
Dùng H2O, giấy quỳ tím.
Dùng axit H2SO4, phenolphtalein không màu.
Dùng dung dịch NaOH, quỳ tím.
Tất cả đều sai.
Có năm dung dịch sau đây: Na2CO3, BaCl2, CH3COONa, Ba(HCO3)2 và NaCl. Chỉ dùng dung dịch H2SO4 có thể nhận biết được mấy chất? Số chất biết được là:
1.
2.
3.
5.
Để loại bỏ khí CO2 có lẫn trong hỗn hợp (O2, CO2). Người ta cho hỗn hợp đi qua dung dịch chứa:
HCl.
Na2SO4.
NaCl.
Ca(OH)2.
Nhỏ một giọt quỳ tím vào dung dịch NaOH, dung dịch có màu xanh, nhỏ từ từ dung dịch HCl cho tới dư vào dung dịch có màu xanh trên thì:
Màu xanh vẫn không thay đổi.
Màu xanh nhạt dần rồi mất hẳn.
Màu xanh nhạt dần, mất hẳn rồi chuyển sang màu đỏ.
Màu xanh đậm thêm dần.
Những cặp chất nào sau đây cùng tồn tại trong một dung dịch?.
KCl và NaNO3.
HCl và AgNO3.
KOH và HCl.
NaHCO3 và NaOH
Để hòa tan hết 5,1g M2O3 phải dùng 43,8g dung dịch HCl 25%. Công thức của M2O3 là:
Fe2O3.
Al2O3.
Cr2O3.
Tất cả đều sai.
Trình bày tính chất hóa học chung của kim loại.
a. Hãy kể tính chất vật lý của nhôm.
b. Nhôm là một nguyên tố hóa học tạo được các oxit, hiđroxit lưỡng tính. Hãy viết phương trình phản ứng hòa tan oxit và hiđroxit nhôm bằng dung dịch KOH và H2SO4.
Nêu tính chất vật lý, tính chất hóa học của sắt. Về mặt hóa trị sắt có gì khác so với nhôm?
Thế nào là một kim loại hoạt động hóa học? Kim loại hoạt động hóa học yếu? Hãy sắp xếp kim loại sau đây theo thứ tự hoạt động hóa học giảm dần: Al, Ag, Cu, Ni, Na.
Cho các kim loại Cu, Al, Fe, Ag, những kim loại nào tác dụng với axit HCl? Những kim loại nào tác dụng với axit H2SO4, dung dịch CuSO4 và dung dịch AgNO3. Viết phương trình phản ứng.
Có một dung dịch đựng muối sắt II và một dung dịch muối sắt III đựng trong 2 ống nghiệm khác nhau. Làm thế nào để nhận biết hai dung dịch đó? Lấy muối sunfat làm ví dụ và viết phương trình phản ứng.
a. Viết các phương trình phản ứng biểu diễn các biến hóa sau:
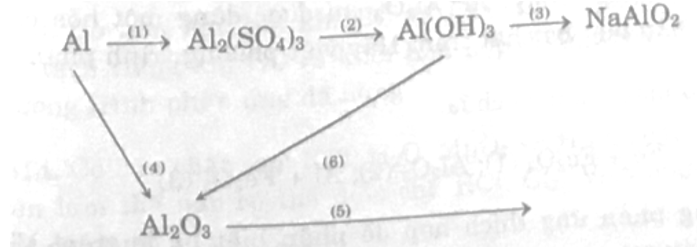
b. Tại sao không dùng dụng cụ bằng nhôm để chứa dung dịch kiềm?
a. Cho các kim loại Mg, Al, Fe lần lượt tác dụng với các dung dịch HCl, NaoH, CuSO4, AgNO3. Viết phương trình phản ứng xảy ra (nếu có).
b. Chỉ được dùng kim loại để phân biệt được các dung dịch sau đây hay không?
NaCl; HCl, NaNO3.
Có ba lọ không nhãn, mỗi lọ đựng một trong những kim loại sau: sắt, nhôm, bạc. Hãy cho biết tên kim loại đựng trong mỗi lọ bằng phương pháp hóa học và viết các phương trình phản ứng đã dùng.
Đặt hai cốc trên hai đĩa cân, rót dung dịch HCl vào hai cốc khối lượng axit ở hai cốc bằng nhau. Hai đĩa cân ở vị trí thăng bằng. Thêm vào cốc thứ nhất một lá sắt, cốc thứ hai một lá nhôm, khối lượng hai lá kim loại bằng nhau. hãy cho biết vị trí của hai đĩa cân trong mỗi trường hợp sau:
a. Hai lá kim loại đều tan hết.
b. Thể tích hiđro sinh ra ở mỗi cốc bằng nhau (do cùng điều kiện to, áp suất).
Viết phương trình phản ứng để thực hiện các chuỗi biến hóa sau:
a.
Viết phương trình phản ứng để thực hiện các chuỗi biến hóa sau:
Có ba chất là Mg, Al, Al2O3 chỉ được dùng một hóa chất làm thuốc thử phân biệt ba chất trên. Hãy viết phương trình phản ứng.
Ba lọ mất nhãn có chứa:
Fe + Fe2O3 (1); Al2O3 (2); Al + Fe2O3 (3)
Dùng những phản ứng thích hợp để phân biệt ba lọ trên. Viết các phản ứng xảy ra.
Nêu tính chất của phi kim? Người ta thường căn cứ vào đâu để đánh giá sự mạnh yếu của phi kim?
a. Hãy kể các phi kim thường gặp, các hóa trị của chúng, cho ví dụ minh họa.
b. Hãy viết công thức của các oxit: cacbon, phốt pho, lưu huỳnh mà em biết. Trong các oxit đó, oxit nào là oxit axit, viết các axit tương ứng.
Nêu các tính chất lí học và hóa học của clo, viết các phương trình phản ứng minh họa. Tại sao nói clo là phi kim rất mạnh?
Nước Clo mới điều chế thì làm mất màu dung dịch quỳ tím. Nhưng nước Clo để lâu ngoài ánh sáng thì làm cho quỳ ngã sang màu đỏ. Tại sao?
Tại sao dạng thù hình của nguyên tố cacbon có những tính chất khác nhau?
Hãy so sánh những tính chất vật lí và tính chất hóa học của CO và CO2. Viết phương trình minh họa.
Bằng phương pháp hóa học, hãy làm khô khí ẩm (lẫn hơi nước) của cacbon (II) oxit; cacbon (IV) oxit, hiđro clorua. Giải thích.
Vì sao muối cacbonat tác dụng được với nhiều axit và sản phẩm không phải là axit mới? Cho ví dụ minh họa.
Có ba lọ đựng riêng biệt ba chất khí: oxi, hiđro và khí cacbonic. Làm thế nào nhận ra khí cacbonic bằng hóa chất? Nếu dùng tàn đóm đỏ thì có thể nhận ra cả ba khí không?
Có hỗn hợp hai khí CO và CO2. Bằng phương pháp hóa học, hãy tách riêng khí CO ra khỏi hỗn hợp. Trình bày cách làm và viết phương trình phản ứng đã dùng.
Có bốn chất sau: KCl, H2O, MnO2, và H2SO4 đặc. Từ những chất trên làm thế nào có thể điều chế HCl, Cl2. Viết phương trình phản ứng đã dùng.
Hoàn thành các phương trình phản ứng (ghi rõ điều kiện, nếu có).
Viết các phương trình phản ứng thực hiện biến hóa sau (ghi rõ điều kiện, nếu có):
Viết phương trình phản ứng biểu diễn chuỗi biến hóa sau:
Viết đầy đủ các phương trình phản ứng sau:
Cân bằng phương trình hóa học và cho biết cacbon trong mỗi trường hợp là chất oxi hóa hay chất khử?
Cho các chất sau: KCl, CaCl2, MnO2, H2SO4 đặc. Đem trộn lẫn hai hoặc ba chất với nhau. Trộn như thế nào thì thành hiđro clorua? Trộn thế nào thì thành clo? Viết phương trình phản ứng xảy ra.
Viết phương trình xảy ra trong các trường hợp sau.
a. Đun nóng Ca(HCO3)2 tác dụng với axit HCl và Ca(OH)2.
b. Tác dụng giữa Ca(HCO3)2 với axit HCl và Ca(OH)2.
Dùng bảng tuần hoàn các nguyên tố hóa học, hãy:
a. Đọc tên các nguyên tố trong chu kì 3.
b. Viết công thức oxit, công thức hợp chất với hiđro của chúng.
c. Nguyên tố nào có tính kim loại mạnh nhất? Tính chất phi kim mạnh nhất?
Cho nhôm tác dụng với axit HCl.
a. Tính thể tích dung dịch HCl 1,5M cần dùng để tác dụng hết với 8,1g nhôm.
b. Tính khối lượng muối tạo thành.
Một sợi dây Al có khối lượng là 16,2g được nhúng vào dung dịch CuSO4 25%.
a. Tính khối lượng dung dịch CuSO4 25% cần dùng để làm tan hết dây Al trên.
b. Tính khối lượng Cu tạo thành sau phản ứng.
Đốt cháy hết 2,7g nhôm bằng khí oxi rồi lấy sản phẩm thu được hòa tan trong dung dịch HCl 14,6%.
a. Viết phương trình phản ứng xảy ra.
b. Tính thể tích khí O2 (ở đktc) đã dùng.
c. Tính khối lượng dung dịch HCl vừa đủ để phản ứng.
Cho một miếng Al nặng 20g vào 400ml dung dịch CuCl2 0,5M. Khi nồng độ dung dịch CuCl2 giảm 25% thì lấy miếng Al ra, rửa sạch, sấy khô, thì cân nặng bao nhiêu gam? Giả sử Cu bám hết vào miếng Al.
Cho nhôm tác dụng mạnh với axit HCl.
a. Tính thể tích dung dịch HCl 1,5M cần dùng để tác dụng hết với 8,1g nhôm.
b. Tính khối lượng muối tạo thành.
Cho 21g hỗn hợp bột nhôm và nhôm oxit tác dụng với axit HCl dư làm thoát ra 13,44l (đktc)
a. Tính khối lượng mỗi chất có trong hỗn hợp ban đầu.
b. Tính thể tích dung dịch HCl 36% (d = 1,18) để vừa đủ hòa tan hỗn hợp đó.
a. Tính khối lượng dung dịch HCl 20% cần dùng để tác dụng hết 8,4g Fe.
b. Tính thể tích khí bay ra ở đktc.
c. Nếu đốt cháy khí này thì cần bao nhiêu lít oxi ở đktc?
Cho một bản sắt có khối lượng 50g vào một dung dịch đồng sunfat. Sau một thời gian nhấc bản sắt ra, khối lượng bản sắt là 51g. Tính số phân tử gam muối sắt tạo thành sau phản ứng. Biết rằng tất cả Cu sinh ra đều bám trên bản sắt.
Nguyên tố A có hóa trị III trong hợp chất với oxi, biết rằng cứ 6,4g oxit của A tác dụng vừa đủ với 0,4 lít dung dịch HCl 0,6M. Xác định kim loại A.
Ngâm một lá Fe có khối lượng 5g trong 50ml dung dịch CuSO4 15% có khối lượng riêng là 1,12 g/ml. Sau một thời gian phản ứng, lấy lá Fe ra khỏi dung dịch CuSO4 rồi rửa nhẹ, làm khô, cân nặng 5,16g.
a. Viết phương trình phản ứng xảy ra.
b. Xác định nồng độ phần trăm của chất còn lại trong dung dịch.
Tính thể tích clo thu được ở đktc khi cho 8,7g MnO2 tác dụng với axit HCl đặc, nếu hiệu suất phản ứng là 85%.
Hòa tan hoàn toàn 11,9 gam hợp kim Zn – Al bằng dung dịch HCl thu được 8,96 lít H2 (đktc). Tính % khối lượng mỗi kim loại trong hợp kim.
Hòa tan hoàn toàn 24g hỗn hợp Al và Mg bằng một lượng dung dịch HCl vừa đủ. Thêm một lượng NaOH dư vào dung dịch sau phản ứng thấy xuất hiện một lượng kết tủa. Lọc lấy kết tủa rửa sạch rồi nung nhiệt độ cao đến khối lượng không đổi thu được 4g một chất rắn.
a. Xác định % khối lượng các kim loại trong hỗn hợp.
b. Tính thể tích trong hỗn hợp và thể tích dung dịch HCl 2M cần dùng, biết kết tủa Al(OH)3 tan được trong dung dịch NaOH dư theo phản ứng:
Có một oxit sắt chưa rõ công thức. Chia một lượng oxit này làm hai phần bằng nhau:
- Hòa tan hết phần I phải dùng 150ml dung dịch HCl 3M.
- Cho một luồng CO dư đi qua phần II nung nóng, phản ứng xong thu được 8,4g sắt.
Tìm công thức oxit sắt trên.
Hòa tan hỗn hợp Al – Cu bằng dung dịch HCl cho tới khi khí ngừng thoát ra thấy còn lại chất rắn X. Lấy a gam chất rắn X nung trong không khí tới phản ứng hoàn toàn thu được 1,36 a gam oxit. Hỏi Al bị hòa tan hết hay không?
Một hỗn hợp gồm bột nhôm và magie. Đem hòa tan 12,6g hỗn hợp này trong dung dịch HCl 1M người ta thu được 13,44 lít khí hiđro (đktc). Tính thành phần % của Al và Mg trong hỗn hợp.
Trộn lít dung dịch HCl (dung dịch A) với lít dung dịch HCl (dung dịch B) được 1 lít dung dịch C. Lấy thể tích dung dịch C tác dụng với dung dịch AgNO3 dư thu được 8,61g kết tủa trắng, Tính nồng độ mol/l của các dung dịch A, B. Biết nồng độ của dung dịch A gấp 4 lần nồng độ của dung dịch B.
Hòa tan m gam MgCO3 trong dung dịch HCl dư thu được 1,12 lít khí CO2 (đo ở đktc). Dẫn khí CO2 thoát ra ở trên vào dung dịch nước vôi trong dư thu được chất kết tủa.
a. Viết các phương trình phản ứng xảy ra.
b. Tính khối lượng m (g) MgCO3 đã dùng.
c. Tính khối lượng kết tủa thu được.
Bạn X làm thí nghiệm tìm hiểu về tính hoạt động của các kim loại P, Q, M, N có kết quả như sau:
- Kim loại P đẩy được kim loại Q ra khỏi dung dịch muối.
- Kim loại Q đẩy được hiđro ra khỏi dung dịch axit.
- Kim loại Q đẩy được kim loại M ra khỏi dung dịch muối.
- Kim loại M đẩy được kim loại N ra khỏi dung dịch muối.
Qua kết quả thí nghiệm, bạn X sắp xếp tính hoạt động kim loại như sau:
P > Q > M < N.
P < Q < M < N.
Một bạn học sinh làm thí nghiệm để biết được mức độ hoạt động của kim loại, bằng cách lấy các kim loại M, N, P, Q cho tác dụng riêng biệt ở từng ống nghiệm với cùng thể tích và nồng độ dung dịch HCl có kết quả như sau:
Kim loại | Tác dụng với dung dịch axit HCl |
M | Khí hiđro giải phóng ra nhanh. |
N | Không quan sát được hiện tượng gì. |
P | Khí hiđro giải phóng ra chậm. |
Q | Khí hiđro giải phóng ra rất nhanh, dung dịch nóng lên. |
Từ kết quả trên, dãy kim loại nào phù hợp với chiều hoạt động của kim loại tăng dần?
Q < P < M < N.
M < Q, N < P.
Q < M < P < N.
N < M < P < Q.
Kim loại M tác dụng với dung dịch HCl sinh ra khí hiđro. Dẫn khí hiđro đi qua oxit của kim loại N nóng, oxit này bị khử cho kim loại N. M và N có thể là:
Đồng và Chì (Cu và Pb).
Chì và Kẽm (Pb và Zn).
Kẽm và Đồng (Zn và Cu).
Đồng và Bạc (Cu và Ag).
Ngâm một lá sắt sạch trong dung dịch đồng (II) sunfat.
Câu trả lời nào sau đây là đúng nhất?
Đồng được giải phóng, nhưng sắt không biến đổi.
Sắt bị hòa tan một phần và đồng được giải phóng.
Không có chất nào mới được sinh ra, chỉ có sắt bị hòa tan.
Có những kim loại sau:
Hãy chọn một kim loại:
a. Phản ứng mạnh với dung dịch axit clohiđric.
Đồng (Cu).
Phatin (Pt).
Nhôm (Al).
Kẽm (Zn).
b. Không tác dụng với oxi thậm chí kim loại nóng đỏ.
Đồng (Cu).
Phatin (Pt).
Nhôm (Al).
Kẽm (Zn).
c. Nhẹ, dẫn điện và dẫn nhiệt tốt.
Đồng (Cu).
Phatin (Pt).
Nhôm (Al).
Kẽm (Zn).
d. Trở thành màu đen khi đốt trong không khí.
Đồng (Cu).
Phatin (Pt).
Nhôm (Al).
Kẽm (Zn).
Cho các kim loại K; Ca; Al lần lượt tác dụng với dung dịch HCl. Nếu cho cùng số mol, mỗi kim loại trên tác dụng với axit HCl thì kim loại nào cho nhiều hiđro hơn?
Al.
K.
K và Ca.
Ca.
Cho 65g kim loại kẽm tác dụng với axit clohiđric cho 136g ZnCl2 và giải phóng 22,4 lít khí hiđro (đktc). Khối lượng axit HCl cần dùng là:
73g.
72g.
36,5g.
71g.
Cho 8,4g bột sắt cháy hết trong 2,24 lít khí oxi tạo ra oxit sắt từ (Fe3O4). Khối lượng oxit sắt tạo thành là:
11,4g.
11,6g.
12g.
20g.
Trong phòng thí nghiệm người ta điều chế khí hiđro bằng cách cho Zn tác dụng với axit clohiđric HCl theo sơ đồ sau:
Kẽm + axit clohiđric kẽm clorua + khí hiđro.
Nếu cho 13g Zn tác dụng hết với dung dịch HCl 0,4M thì thể tích khí hiđro thu được là bao nhiêu?
3 lít.
3,3 lít.
3,36 lít.
5,36 lít.
Tính chất nào sau đây không phải là của khí clo?
Tan hoàn toàn trong nước.
Có màu vàng lục.
Có tính tẩy trắng khi ẩm.
Mùi hắc, rất độc.
Biết nhiều phi kim tác dụng được với oxi để tạo oxit phi kim tương ứng. Vậy dãy phi nào dưới đây tác dụng được với oxi?
C, S, P, Si.
Cl2, Br2, C, N2.
I, F, Ne, Si.
He, P, S, Br2.
Dãy những phi kim nào dưới đây không tác dụng được với nhau?
N2, H2, S, O2, C.
P, H2, S, Cl2, I2.
O2, Cl2, I2, Si.
B, Br2, I2, P.
Cho các hỗn hợp khí sau:
1. H2 và O2. 2. SO2 và O2. 3. H2 và Cl2
tồn tại trong những điều kiện nào?
Tồn tại bất cứ điều kiện nào.
Tồn tại ở nhiệt độ thấp không có xúc tác (hoặc trong bóng tối).
Không thể tồn tại vì có phản ứng xảy ra.
Tất cả đều sai.
Một trong những quá trình nào sau đây không sinh ra khí cacbonix?
Đốt cháy khí đốt tự nhiên.
Sản xuất gang thép.
Sản xuất vôi sống.
Quang hợp của cây xanh.
Tính chất vật lí nào sau đây là của cacbon oxit (CO)?
Khí cháy, không độc, không màu.
Khí cháy, độc, không màu.
Khí không cháy, không màu, rất nhẹ (bằng 1/7 khối lượng của không khí).
Khí màu lục nhạt, độc, nặng hơn không khí (gấp 2,5 lần không khí).
Bằng phương pháp hóa học làm thế nào để nhận ra sự có mặt của mỗi khí trong hỗn hợp gồm: CO, CO2, SO3?
Dẫn hỗn hợp qua dung dịch BaCl2.
Dẫn hỗn hợp qua dung dịch Ca(OH)2.
Dẫn hỗn hợp qua dung dịch BaCl2, sau đó qua nước vôi trong dư,
Tất cả đều sai.
Có những khí ẩm (khí có lẫn hơi nước) sau đây:
a. Amoniac.
b. Sunfurơ.
c. Cacbon dioxit.
d. Hiđro clorua.
1. Khí ẩm nào có thể làm khô bằng axit sunfuric đặc?
b, c, a.
a, b, c.
b, c, d.
c, d, a.
2. Khí ẩm nào có thể làm khô bằng canxi oxit?
a.
a, d, b.
b, c, d.
c, d, a.
Hợp chất nào sau đây phản ứng được với clo?
NaCl.
NaOH.
CaCO3.
H2SO4.
Nguyên tố X tạo được hợp chất sau: XH3 và X2H5. Trong bảng hệ thống tuần hoàn các nguyên tố hóa học, nguyên tố X cùng nhóm với:
Agan.
Nitơ.
Oxi.
Flo.
Đốt cháy 10cm3 khí hiđro trong 10cm3 khí oxi. Thể tích chất khí còn lại sau phản ứng:
5 cm3 hiđro.
10 cm3 hiđro.
Chỉ có 10 cm3 hơi nước.
5 cm3 oxi.
Khi cho 13g kẽm tác dụng với 0,3 mol HCl. Khối lượng muối ZnCl2 được tạo thành trong phản ứng này là:
20,4g.
10,2g.
30,6g.
40g.
Cho 1,35g nhôm tác dụng với dung dịch chứa 7,3g HCl. Khối lượng muối tạo thành là:
3,3375g.
6,755g.
7,775g.
10,775g.
Cho 8,125g Zn tác dụng với dung dịch loãng có chứa 18,25g axit clohiđric HCl. Thể tích khí H2 (ở đktc) sinh ra là:
2,8 lít.
2,75 lít.
2,81 lít.
3,85 lít.
Trộn 50ml dung dịch Ba(OH)2 0,04M với 150ml dung dịch HCl 0,06M thu được 200ml dung dịch N. Nồng độ mol/l của muối BaCl2 trong dung dịch B bằng:
0,05M.
0,01M.
0,17M.
0,08M.
Hòa tan hoàn toàn 2,84g hỗn hợp 2 muối cacbonat của 2 kim loại có hóa trị II thuộc chu kỳ khác nhau trong hệ thống tuần hoàn bằng dung dịch axit HCl ta thu được 0,672ml khí CO2 (đo ở đktc). Biết kim loại này có số mol gấp đôi kim loại kia. Kim loại đó là:
Ba và Ag.
Ca và Cu.
Fe và Zn.
Mg và Ca,
Nêu phương pháp hóa học để có thể phân biệt các chất trong mỗi nhóm chất sau:
a. Etilen và metan.
Nêu phương pháp hóa học để có thể phân biệt các chất trong mỗi nhóm chất sau:
b. Etilen, hiđro và khí cacbonic.
Nêu phương pháp hóa học để có thể phân biệt các chất trong mỗi nhóm chất sau:
c. Etilen, metan và hiđro.
a. Viết công thức cấu tạo của metan. Các liên kết trong phân tử metan gọi là liên kết gì?
b. Cho clo và metan vào một ống nghiệm. Làm thế nào để phản ứng có thể xảy ra. Làm thế nào để biết các phản ứng đã xảy ra?
Trình bày phương pháp hóa học để làm sạch các tạp chất:
a. Loại CO2 khỏi C2H2.
Trình bày phương pháp hóa học để làm sạch các tạp chất:
b. Loại C2H4 khỏi CO2.
Nêu phương pháp hóa học để phân biệt các khí sau: cacbon (II) oxit; khí cacbonic; metan.
Viết các phương trình phản ứng của benzen với khí clo, khi có mặt bột Fe xúc tác (phản ứng thế) và khi có mặt ánh sáng tử ngoại xúc tác (phản ứng cộng hợp).
Cho benzen tác dụng với hiđro khi đun nóng, có mặt Ni xúc tác. Viết phương trình phản ứng dưới dạng công thức cấu tạo.
Hoàn thành chuỗi biến hóa sau:
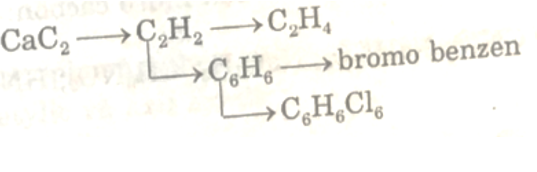
Trình bày phương pháp hóa học để thu được khí CH4 tinh khiết từ hỗn hợp khí gồm CH4 và C2H4. Viết phản ứng xảy ra.
Viết phản ứng đốt cháy metan và benzen. Có hiện tượng gì khác nhau trong hai phản ứng đốt cháy?
Bốn lọ mất nhãn đựng khí:
H2 (1); CO2 (2); CO2 + CH4 (3); CO2 + C2H4 (4)
Dùng những phản ứng hóa học thích hợp để phân biệt 4 lọ trên.
Có thể dùng nước brom để phân biệt 3 chất khí CH4, C2H4, C2H2 được không? Nếu được hãy nói rõ cách làm.
Viết công thức cấu tạo và so sánh điểm khác nhau về thành phần nguyên tố, cấu tạo phân tử và tính chất hóa học giữa metan và etilen.
Viết phương trình phản ứng cháy CnH2n+2.
Cho biết những phương pháp chủ yếu để chế biến dầu mỏ. Nêu một số sản phẩm chính khi chưng cất dầu mỏ.
Hãy giải thích các hiện tượng:
a. Để dập tắt những đám xăng dầu, người ta không dùng nước mà dùng cát hoặc chăn dạ trùm lên ngọn lửa.
b. Khi ngọn đèn dầu có bấc ngắn lụi dần, vì dầu đã cạn, người ta đổ nước vào dầu còn lại thì đèn lại sáng lên.
c. Khi vặn bấc đèn lên cao quá thì sinh ra nhiều muội đèn.
Phát biểu quy luật về cấu tạo phân tử chất hữu cơ.
Dựa vào tiêu chuẩn nào để xác định một chất vô cơ hay hữu cơ?
Hãy chỉ rõ chất nào là hữu cơ, chất nào là vô cơ, chất nào hidrocacbon, chất nào là dẫn xuất của hidrocacbon
C6H12; CH4O; NaHCO3; NaC6H5; CH3NO2; HNO2; CH3Br
a. Có thể phân biệt muối ăn và đường kính bằng cách đốt cháy hay không?
b. Khi đốt cháy khí A thu được CO2 và H2O, khi đốt cháy khí B thu được CO2 và SO2, còn khi đốt cháy khí C thu được CO2, H2O và N2. Hỏi các chất A, B, C có phải là hợp chất hữu cơ không?
Trình bày phương pháp hóa học để làm sạch tạp chất:
Loại C2H5OH khỏi CH3COOH.
Có ba chất lỏng chứa trong 3 bình khác nhau rồm rượu etylic, axit axetic, benzen. Bằng phương pháp hóa học, hãy nhận biết chúng.
Viết phương trình phản ứng xảy ra khi cho axit axetic tác dụng lần lượt với kali hiđroxit, vôi tôi, bột magie và đá vôi.
Cho 2 chất lỏng là axit axetic và rượu etylic. Trình bày hai phương pháp phân biệt chúng bằng phản ứng hóa học.
Từ tinh bột hoặc từ vỏ bào mùn cưa (xenlulozơ), viết các phản ứng điều chế giấm ăn.
Công thức của rượu etylic là C2H6O hoặc C2H5OH. Ý nghĩa của công thức thứ hai là gì?
Điền công thức hóa chất thích hợp vào chỗ có dấu … và cân bằng các phương trình phản ứng.
Este là gì? Phản ứng este hóa là gì? Viết phương trình phản ứng minh họa.
Trình bày phương pháp hóa học để phân biệt ba chất lỏng sau: benzen, rượu etylic và axit axetic.
Hãy kể tên một loại chất béo có nguồn gốc động vật và một loại chất béo có nguồn gốc thực vật.
Có gì khác nhau căn bản giữa dầu lạc và dầu bôi trơn máy móc về thành phần cấu tạo và tính chất hóa học?
Lần lượt cho natri, magie, kali hiđroxit và canxi cacbonat vào ba ống nghiệm chứa rượu etylic, axit axetic và etyl axetat. Viết phương trình của các trường hợp có xảy ra phản ứng hóa học.
Dựa vào bài 396 hãy nêu phương pháp hóa học để phân biệt rượu etylic, axit axetic và benzen, mà chỉ cần sử dụng kim loại làm thuốc thử (nêu rõ cách làm, hiện tượng hóa học xảy ra; giải thích hiện tượng và viết phương trình phản ứng minh họa).
Nêu phương pháp hóa học để phân biệt các chất sau: rượu etylic, axit axetic, dung dịch glucozơ. Viết phương trình phản ứng minh họa.
a. Trình bày phương pháp hóa học để phân biệt bốn dung dịch không màu sau: rượu etylic, axit axetic, glucozơ và saccarozơ.
a. Tính dẻo là gì? Tại sao để làm dụng cụ thực phẩm phải chọn chất dẻo?
b. Tính đàn hồi khác tính dẻo như thế nào? Cao su thô, cao su lưu hóa và nhựa ebonic (sản phẩm lưu hóa cao su bằng một lượng lớn lưu huỳnh) thứ nào có tính đàn hồi cao hơn cả?
Đá vôi vôi sống đất đèn
a.
b. Rượu etylic
Cho biết ở 20oC benzen có khối lượng riêng là 0,879 g/ml. Nếu hóa lỏng 7,8kg hơi benzen xuống 20oC thì thu được bao nhiêu lít benzen?
Cho 1 lít benzen (d = 0,879) tác dụng với 112 lít Cl2 (đktc) khi có mặt xúc tác là bột sắt thì thu được 450g clo benzen. Tính hiệu suất phản ứng.
Khi đun nóng 5 mol axetilen với than hoạt tính ở 600oC người ta thu được hỗn hợp khí gồm C2H2 và khí sản phẩm, trong đó khí sản phẩm chiếm 75% về thể tích.
a. Tính hiệu suất phản ứng.
b. Làm lạnh khí sản phẩm tới nhiệt độ phòng thì thu được bao nhiêu ml chất lỏng (d = 0,879 g/ml)
Đốt 24 cm3 hỗn hợp axetilen và metan phải dùng 54 cm3 oxi, các thể tích khí đo ở đktc. Tính thành phần % của hỗn hợp và tìm thể tích khí CO2 sinh ra.
Cho brom tác dụng với benzen tạo ra brom benzen. Tính khối lượng benzen cần dùng để điều chế 15,7g brom benzen biết hiệu suất phản ứng là 80%.
Cho 5,6 lít (đktc) hỗn hợp CH4 và C2H2 đi qua nước vrom dư thấy có 4g brom tham gia phản ứng. Tính % thể tích mỗi khí trong hỗn hợp.
Cho biết 2,8 lít (đktc) hỗn hợp khí CH4; C2H4 và C2H2 tác dụng vừa đủ với 500ml dung dịch Br2 0,04M. Hỏi % thể tích của CH4 biến đổi trong khoảng nào?
Một loại khí tự nhiên có chứa 92% metan, 4% etan (về thể tích) và một số khí khác không cháy. Hỏi cần bao nhiêu thể tích oxi để đốt cháy hết 1 m3 khí tự nhiên này?
Đốt 11,2 lít hỗn hợp metan và etan (đktc) và cho sản phẩm khí thu được qua dung dịch NaOH thì tạo thành 250ml dung dịch xô đa 2,6M. Xác định thành phần % theo thể tích hỗn hợp.
Tìm thể tích rượu etylic nguyên chất có trong 650ml rượu 40o.
Cho glucozơ lên men rượu. Tính khối lượng rượu và thể tích khí CO2 thu được từ 50g glucozơ, biết rằng phản ứng xảy ra hoàn toàn, thể tích đo ở đktc.
Cho 10ml rượu etylic 92o tác dụng hết với Na. Tính thể tích H2 bay ra (đktc). Biết khối lượng riêng của rượu etylic nguyên chất là 0,80 g/ml, của nước là 1 g/ml.
Để xác định độ rượu của một loại rượu etylic (gọi là rượu X), người ta lấy 10ml rượu X cho tác dụng hết với Na thấy bay ra 2,564 lít H2 (đktc). Tính độ rượu của rượu X (coi Vdd rượu = Vrượu + Vnước)
Có 80 lít rượu 90o, phải đổ bao nhiêu lít nước vào đó để được rượu 40o. Giả sử khi đổ nước vào rượu thể tích hỗn hợp không đổi.
Cho 25ml rượu 90o tác dụng với Kali lấy dư.
a. Tính thể tích và khối lượng rượu nguyên chất đã tham gia phản ứng, biết rằng khối lượng riêng của rượu là 0,8 g/ml.
b. Tính thể tích hiđro thu được ở đktc.
Hỗn hợp A gồm 0,1 mol rượu etylic và a mol rượu X có công thức CnH2n(OH)2. Chia A thành hai phần bằng nhau:
- Phần thứ nhất cho tác dụng hết với Na thấy bay ra 2,8 lít H2 (ở đktc).
- Phần thứ hai đem đốt cháy hoàn toàn thu được 8,96 lít CO2 (ở đktc) và b gam nước.
a. Tìm các giá trị a, b.
b. Xác định công thức phân tử, viết công thức cấu tạo của X, biết rằng mỗi nguyên tử cacbon chỉ liên kết được với một nhóm –OH.
Cho 0,32g rượu đơn chức no tác dụng hết với Na thu được 112ml khí H2 ở đktc. Tìm công thức phân tử và công thức cấu tạo của rượu.
Cho 60g CH3COOH tác dụng 100g CH3CH2OH thu được 55g CH3COOCH2CH3. Tính hiệu suất phản ứng.
Dung dịch X chứa HCl và CH3COOH.
a. Để trung hòa 100ml dung dịch X cần dùng 30ml dung dịch NaOH 1M, cô cạn dung dịch đã trung hòa thì thu được 2,225g muối khan. Tính nồng độ mol/l của các axit trong dung dịch X.
b. Cần bao nhiêu ml dung dịch X để trung hòa 25ml dung dịch, hỗn hợp Ba(OH)2 0,2M và NaOH 0,05M.
Những chất nào sau đây đều là hidrocacbon?
FeCl; C2H6O; CH4; NaHCO3.
NaC6H5; CH4O; HNO3; C6H6.
CH4; C2H4; C2H2; C6H6.
CH3NO2; CH3Br; NaOH.
Một trong những phương pháp nào sau đây là tốt nhất để phân biệt khí metan và khí etilen?
Dựa vào tỉ lệ về thể tích khí oxi tham gia phản ứng đốt chát.
Sự thay đổi màu dung dịch nước brom.
So sánh khối lượng riêng (g/l).
Phân tích thành phần định lượng của các hợp chất.
Những chất nào sau đây khi tham gia phản ứng có phản ứng cộng và phản ứng thế?
Metan.
Benzen.
Axetilen.
Etilen.
Những hidrocacbon nào sau đây trongphat vừa có liên kết đơn, vừa có liên kết đôi?
Etilen.
Benzen.
Metan.
Axetilen.
Những hidrocacbon nào sau đây trong phân tử vừa có liên kết đơn, vừa có liên kết ba?
Etilen.
Benzen.
Metan.
Axetilen
Khí đốt nhiên liệu hidrocacbon, một trong những sản phẩm chính là khí A. Khí A tác dụng với hơi nước trong không khí tạo ra axit yếu. Tên của khí A là gì?
SO2.
CO2.
NH3.
CO.
Có 5 dung dịch sau đây: Na2CO3, BaCl2, CH3COOK, Ba(HCO3)2 và NaCl. Chỉ dùng dung dịch H2SO4 có thể nhận biết được mấy chất?
5.
2.
3.
4.
Để tẩy sạch vết dầu mỡ hoặc chất béo dính vào quần áo. Ta có thể dùng chất nào sau đây:
H2O.
Dầu hỏa.
Dung dịch nước clo.
Rượu etylic.
Một trong những chất nào sau đây không tác dụng với natri, giải phóng hiđro.
H2O.
Axit axetic.
Dầu hỏa.
Rượu etylic.
Một trong những chất nào sau đây không tác dụng với natri giải phóng khí hiđro?
Nước.
Axit axetic.
Rượu etylic.
Dầu hỏa.
Các loại thực phẩm nào là hợp chất cao phân tử (polime)?
Gluxit và chất béo.
Protit và Gluxit.
Protit và chất béo.
Gluxit, chất béo và Protit.
Các chất nào sau đây được sản xuất từ nguyên liệu là xenlulozơ?
Tơ nhân tạo.
Rượu etylic.
Boxit.
Glucozơ.
Xác định chất có trong sơ đồ sau:
X, Y, M là những chất nào trong các dãy chất sau?
CH4, CO2, CH3COOH.
C2H4, C2H5OH, H2O.
C2H5OH, CO2, CH3COOH.
A, B đều đúng.
Từ các chất CH3COOH, C2H5OH, CH4, CH3COONa. Hãy lập mối quan hệ của các chất theo sơ đồ sau:
Có mấy chuỗi biến hóa theo sơ đồ trên?
1.
2.
3.
4.
Từ các chất vô cơ nào sau đây điều chế được P.V.C, P.E và C6H12.
Na2CO3, S.
CaCO3, C.
K2CO3, P.
Tất cả đều được.
Ba gói bột màu trắng là glucozơ, tinh bột và saccarozơ, có thể phân biệt bằng cách sau đây không?
Hòa tan vào nước, và cho phản ứng với AgNO3/NH3.
Dùng dung dịch Iot và Cu(OH)2.
Dùng dung dịch nước vôi đặc (CaO.H2O) và dung dịch Iot.
Tất cả đều đúng.
Các yếu tố nào sau đây làm ảnh hưởng phản ứng xảy ra theo chiều thuận (chiều tạo sản phẩm) giữa axit axetic và rượu etylic?
1. Nhiệt độ.
2. Chất xúc tác.
3. Nồng độ của các chất phản ứng.
4. Bản chất các chất phản ứng.
1, 3.
2, 4.
1, 2, 3.
1, 2, 3, 4.
Có ba lọ chứa các dung dịch sau: rượu etylic, glucozơ và axit axetic. Có thể dùng các thuốc thử nào sau đây để phân biệt.
Giấy quỳ tím và Na.
Na và AgNO3/NH3.
Giấy quỳ tím và AgNO3/NH3.
Tất cả đều đúng.
Có thể phân biệt được các chất sau: Lòng trắng trứng, glucozơ và đường saccarozơ bằng 1 thuốc thử duy nhất sau không?
Na.
Cu(OH)2.
HNO3.
Dung dịch Iot.
Có 2 chất lỏng axit axetic và rượu etylic. Có mấy cách phân biệt các chất đó?
1.
2.
3.
4.
Phân tích 5g chất hữu cơ, cho sản phẩm qua bình đựng đá bọt tẩm H2SO4 đặc, bình nặng thêm 5,4g. Thành phần % khối lượng của hiđro là:
3%.
8%.
10%.
12%.
Đốt chát 1,6g chất hữu cơ gồm 2 nguyên tố là A và hiđro, thu được 3,6g nước. Thành phần % khối lượng của A là:
50%.
75%.
80%.
Không xác định được.
Khi đốt cháy hoàn toàn hidrocacbon X thu được tỉ lệ số mol CO2 và hơi nước bằng 2 : 1. Vậy X là:
C2H4.
C6H12.
C3H8.
C2H2.
Trộn hai thể tích khí CH4 và 1 thể tích khí C2H4 thu được ở 6,72 lít hỗn hợp khí (đo ở đktc). Đốt cháy hết hỗn hợp khí trên, thể tích khí CO2 thu được ở đktc là:
6,72 lít.
8,96 lít.
9 lít.
10,5 lít.
Hỗn hợp khí A (đktc) chứa những thể tích như nhau CH4 và C3H8. Vậy 1 lít hỗn hợp A nặng:
0,72kg.
1,20g.
1,34g.
Các giá trị cho trên đều không phù hợp.
Đốt cháy một hidrocacbon X ta thu được số mol CO2 và H2O theo tỉ lệ 2 : 1. X là một chất không có đồng phân. Vậy X có công thức phân tử là:
C2H2.
C6H6.
C4H4.
C4H8.
Khi hòa tan 50g đường glucozơ (C6H12O6) vào 250g nước ở 20oC thì thu được dung dịch bão hòa. Độ tan của đường ở 20oC là:
20g.
10g.
15g.
30g.
Cho 3,8g hỗn hợp natri cacbonat và natri hiđro cacbonat tác dụng với dung dịch axit clohiđric thấy thoát ra 896ml khí (đktc).
a. Tính thành phần % về khối lượng của hai muối trong hỗn hợp đầu.
b. Tính thể tích dung dịch HCl 20% (D = 1,1) đã dùng.
Hòa tan 2,8g CaO vào 140g dung dịch H2SO4 20%.
a. Viết phương trình phản ứng xảy ra.
c. Tính khối lượng CaCO3 sinh ra.
d. Tính nồng độ % cửa các chất còn lại sau phản ứng.
Đốt cháy 0,64g lưu huỳnh ta được chất A. Hòa tan chất A vào 200g H2O thì thu được dung dịch B. Tính C% của dung dịch B.
Nung nóng 136g hỗn hợp hai bazơ Mg(OH)2 và Fe(OH)3 thì khối lượng hỗn hợp giảm đi 36g.
a. Tính khối lượng của hai oxit thu được.
b. Biết hai oxit có tỉ lệ số mol là 1 : 1.
Tính khối lượng của mỗi oxit và mỗi bazơ trong hỗn hợp đầu.
Trung hòa 400ml dung dịch H2SO4 2M bằng dung dịch NaOH 20%.
a. Viết phương trình phản ứng xảy ra.
b. Tính khối lượng dung dịch NaOH cần dùng.
Hòa tan hết 128g hỗn hợp Mg và MgO phải dùng 400ml dung dịch HCl 2M.
a. Tính % khối lượng chất ban đầu.
c. Nếu thay dung dịch NaOH bằng dung dịch vôi tôi thì phải dùng bao nhiêu ml dung dịch vôi tôi nồng độ 7,4% (D = 1,05 g/ml) để trung hòa dung dịch axit đã cho.
b. Cho một lượng NaOH dư vào dung dịch sau phản ứng sẽ thu được bao nhiêu gam kết tủa?
Hòa tan 6,2g Na2O vào 193,8g nước ta thu được một dung dịch A có tính bazơ. Cho A phản ứng với 200g dung dịch CuSO4 16%. Nung nóng kết tủa thu được cho đến khi thành một chất màu đen.
a. Tính C% dung dịch A.
b.Tính khối lượng chất rắn màu đen.
c. Tính thể tích dung dịch HCl 2M cần để hòa tan hết chất rắn màu đen.
Điều chế đạm urê bằng cách cho khí CO2 tác dụng với NH3 ở nhiệt độ và áp suất cao có chất xúc tác theo phương trình sau:
Tính thể tích khí CO2 và NH3 ở đktc cần dùng để sản xuất 10 tấn urê. Biết H% của phản ứng là 80%.
Hòa tan một lượng sắt vào 500ml dung dịch H2SO4 (vừa đủ) thu được 33,6 lít khí hiđro (đktc).
a. Tính khối lượng sắt đã dùng.
b. Khối lượng sắt (III) sunfat kết tinh. FeO.5H2O có thể thu được là bao nhiêu?
c. Tính nồng độ M của dung dịch H2SO4 ban đầu.
d. Tính thể tích oxi cần để đốt cháy hoàn toàn lượng hiđro trên
Tìm công thức hóa học của một hợp chất chứa 40% Cu, 20% S và 40% oxi.
Nguyên tố R có hóa trị III: oxit của nó có khối lượng 40,8g cho tác dụng với axit clohiđric có dư thì thu được 106,8g muối. Xác định tên nguyên tố R.
Có bao nhiêu kg Al điều chế được từ 1 tấn quặng nhôm oxit chứa 95% nhôm oxit?
Cho 3,25g sắt clorua (chưa biết hóa trị) tác dụng với dung dịch AgNO3 thì thu được 8,61g AgCl. Xác định công thức của sắt clorua.
Cho kim loại Al dư vào 400ml dung dịch HCl 1M. Dẫn khí sinh ra qua ống nghiệm đựng CuO nung nóng thì được 11,25g Cu. Tính H% của quá trình phản ứng.
Một miếng sắt cân nặng 2,8g để ngoài không khí ẩm, sau khi bị biến đổi hoàn toàn thành gỉ sắt có công thức 2Fe2O3.3H2O. Hỏi khối lượng sắt được tăng là bao nhiêu?
a. Tính thể tích dung dịch axit HCl 10M cần thiết để tác dụng vừa đủ với 135g nhôm.
b. Tính thể tích hiđro thu được từ phản ứng trên.
Cho H2SO4loãng dư tác dụng với Mg và Fe thì thu được 2,016 lít khí (đktc). Nếu hợp kim này tác dụng với dung dịch FeSO4 có dư thì khối lượng của hợp kim tăng lên 1,68g. Tìm khối lượng mỗi kim loại trong hợp kim.
Đốt cháy hết 2,7g nhôm bằng khí õi rồi lấy sản phẩm thu được hòa tan trong dung dịch HCl 14,6%.
1. Viết phương trình phản ứng xảy ra.
2. Tính thể tích O2 (ở đktc) đã dùng.
3. Tính khối lượng dung dịch HCl vừa đủ để phản ứng.
Cho 20,05g hỗn hợp bột Al và Fe2O3 trong bình kín rồi đun nóng để thực hiện phản ứng nhiệt nhôm theo phương trình phản ứng:
Phản ứng thực hiện xong lấy chất rắn thu được cho tác dụng với dung dịch HCl thì thu được 3,36 lít khí, Nếu cũng lấy 20,5g hỗn hợp trên tác dụng với H2SO4loãng dư thì có 5,04 lít khí sinh ra. Biết thể tích các khí đều đo ở đktc.
a. Viết các phương trình phản ứng xảy ra.
b. Tính khối lượng các chất thu được sau phản ứng nhiệt nhôm.
Người ta thường điều chế cacbua canxi bằng cách nung bôi sống trong lò điện. Ta có sơ đồ phản ứng:
vôi sống + cacbon cacbon oxit + CaC2
a. Viết phương trình phản ứng.
b. Tính khối lượng CaC2 điều chế được nếu nung 2800kg vôi sống. Cho rằng hao hụt trong sản xuất là 0,5%.
Để khử hoàn toàn 24g hỗn hợp Fe2O3 và CuO cần dùng 8,96 lít CO (đktc). Tính % khối lượng mỗi oxit trong hỗn hợp ban đầu và % khối lượng mỗi kim loại trong chất rắn thu được sau phản ứng. Nếu thay CO bằng H2 thì thể tích H2 là bao nhiêu?
Cho 10g hợp kim gồm Al; Cu và Mg vào dung dịch HCl có dư thì thu được 11,98 lít H2 (đktc) và 0,31g một chất không tan. Hãy xác định thành phần % về khối lượng của mỗi kim loại đó.
Tiến hành điện phân 5l dung dịch NaCl 2M (d = 1,2) theo phản ứng:
Sau khi ở anốt (cực dương) thoát ra 89,6 lít Cl2 (đktc) thì ngừng điện phân. Giả sử nước bay hơi không đáng kể. Tính nồng độ % của chất tan trong dung dịch sau điện phân.
Nung nóng 2,4g hỗn hợp CuO và một oxit sắt (FexOy) rồi cho luồng khí CO đi qua cho đến khi khử hết các oxit thì thu được 1,76g chất rắn. Nếu hòa tan chất rắn đó bằng dung dịch HCl dư thì thấy có 0,448 lít khí H2 (đktc) thoát ra. Xác định công thức của oxit sắt đó. Cho biết số mol của 2 oxit trong hỗn hợp bằng nhau.
Trong một bình kín chứa SO2 và O2 theo tỉ lệ số mol 1 : 1 và một ít bột xúc tác V2O5. Nung nóng bình một thời gian thu được hỗn hợp khí trong đó khí sản phẩm chiếm 35,3% thể tích. Tính hiệu suất phản ứng tạo thành SO3.
Đốt cháy 16l hỗn hợp khí CO và CO2 cần 2l khí oxi (đo cùng điều kiện nhiệt độ và áp suất). Hãy xác định thành phần phần trăm theo thể tích của mỗi khí trong hỗn hợp ban đầu,
Cần phải lấy bao nhiêu gam Na2CO3.10H2O và bao nhiêu gam nước để pha chế được 1000g dung dịch Na2CO3 5,3%?
Nguyên tố R tạo thành hợp chất khí với hiđro ứng với công thức chung là RH4. Trong hợp chất này, hiđro chiếm 25% về khối lượng. Hãy xác định tên của nguyên tố R.
Oxit của một nguyên tố ứng với công thức chung là RO3 có chứa 60% về khối lượng là oxi. Hãy cho biết.
a. Công thức phân tử của oxit.
b. Oxit này tác dụng với nước tạo ra chất gì? Viết phương trình phản ứng.
Đốt 5,6 lít etilen. Hãy tính thể tích không khí cần dùng, biết rằng oxi chiếm 20% thể tích không khí (đktc).
Cho nhôm cacbua tác dụng với nước thì được khí metan và nhôm hiđroxit.
a. Tính lượng nhôm cacbua cần dùng để có 4,8g metan.
b. Để dung hòa bazơ tạo thành sau phản ứng, phải dùng một khối lượng dung dịch axit clohiđric 10% là bao nhiêu?
Cho hỗn hợp A gồm khí metan và axetilen. Đốt cháy 5,6l hỗn hợp này được 8,96l khí CO2 ở đktc.
a. Xác định thành phần % theo thể tích của hỗn hợp A.
b. Tính thể tích oxi cần dùng.
Đốt cháy một hỗn hợp 25cm3 metan và etylen cần 60cm3 oxi.
a. Tính thể tích mỗi chất khí.
b. Tính thành phần % về thể tích mỗi chất khí.
Để đốt cháy hoàn toàn 6,72l hỗn hợp khí A gồm CO và CH4 phải dùng vừa hết 6,72l oxi. Tính thành phần phần trăm của các chất có trong hỗn hợp A theo thể tích và theo khối lượng, biết rằng các thể tích khí đều đo ở điều kiện tiêu chuẩn.
Để đốt cháy hoàn toàn một thể tích hơi của hợp chất A, cần dùng 2,5 thể tích khí oxi (ở cùng điều kiện). Phản ứng làm tạo thành 8,8g khí cacbonic và 1,8g nước. Hãy xác định công thức phân tử và công thức cấu tạo của A, biết rằng ở điều kiện tiêu chuẩn, 1l hơi của hợp chất này nặng 1,161g.
Thành phần của một loại khí thiên nhiên có chứa 96% CH4, 2% N2 và 2% CO2 theo thể tích. Đốt cháy hoàn toàn một lượng khí này rồi dẫn toàn bộ sản phẩm tạo thành vào dung dịch nước vôi trong (dư), thu được 80g kết tủa. Tính thể tích khí (đktc) đã đem đốt,
Có một hỗn hợp khí gồm etilen và axetilen chia làm hai phần bằng nhau:
Phần I: Dẫn hỗn hợp khí qua bình chứa dung dịch nước vrom thấy khối lượng của bình tăng lên 0,68g.
Phần II: Đem đốt hoàn toàn hỗn hợp phải dùng 1,568 lít oxi. Tính % thể tích hỗn hợp ban đầu.
Hỗn hợp khí X gồm CH4 và CxHy có tỉ lệ thể tích 1 : 1. Biết 1 lít hỗn hợp khí X (ở đktc) nặng 0,9275g. Vậy công thức phân tử của CxHy là:
C2H6.
C2H2.
C3H8.
C4H8.
Đun 8,9kg (C17H35COO)3C3H5 với một dư NaOH.
a. Tính lượng glixerin thu được.
b. Tính lượng xà phòng bánh thu được, nếu phản ứng xảy ra hoàn toàn và trong xà phòng có chứa 60% khối lượng C17H35COONa?
Phân tích một hợp chất hữu cơ, người ta thấy cứ 3 phần khối lượng cacbon thì có 0,5 phần khối lượng hiđro và 4 phần khối lượng oxi. Biết rằng 1 dm3 chất đó ở đktc nặng 1,34g. Tìm CTPT của hợp chất hữu cơ đó.
Cho 60g CH3COOH tác dụng với 100g C2H5OH ta thu được 55g este là etyl axetat. Tính hiệu quất phản ứng xảy ra.
Khi đốt cháy 0,6g một hợp chất hữu cơ, người ta thu được 0,88g CO2 và 0,36g H2O. Hãy xác định CTPT của hợp chất hữu cơ đó. Biết phân tử khối của nó là 60 đvc.
Một hợp chất A gồm 3 nguyên tố C; H; O. Đốt cháy hoàn toàn 3,78g chất A thì thu được 8,25g CO2 và 4,77g H2O.
a. Tìm CTPT của chất A, biết phân tử khối của A là 60 đvc.
b. Viết các CTPT của chất A.
Đốt cháy hoàn toàn 0,9g một hợp chất hữu cơ có thành phần gồm các nguyên tố C, H, O thì thu được 1,32g CO2 và 0,54g H2O. Phân tử khối của hợp chất hữu cơ là 180 đvc. Hãy xác định CTPT của hợp chất hữu cơ đó.
Cho 220ml rượu etylic lên men giấm, dung dịch thu được cho trung hòa vừa đủ bằng dung dịch NaOH và thu được 208g muối khan. Tính H% của phản ứng lên men giấm. Biết Drượu = 0,8 g/ml.
Đốt cháy 3,86g hỗn hợp gồm etylic và benzen, cho sản phẩm đốt cháy hấp thụ hoàn toàn vào 50ml dung dịch NaOH 0,8M thì thu được dung dịch Y. Cho thêm 1 lượng CaCl2 có dư vào dung dịch Y thấy tạo thành 18g kết tủa. Tính % về khối lượng của rượu etylic và benzen trong hỗn hợp ban đầu.








