Trắc nghiệm tổng hợp Hóa 9 có đáp án (Phần 1)
272 câu hỏi
Hãy chỉ ra đâu là chất, đâu là vật thể trong các ý sau:
a. Phần lớn xoong, nồi, ấm đun đều bằng nhôm.
b. Lưỡi dao bằng sắt, cán dao bằng nhựa.
c. Không khí gồm oxi, nitơ, khí cacbonic.
d. Nước biển gồm nước, muối và một số chất khác.
Hãy nêu những biểu hiện được coi là tính chất của chất. Em biết những tính chất gì của muối ăn, của đường? Thử so sánh một vài điểm giống và khác nhau về tính chất giữa đường và muối ăn.
Thành phần và tính chất của nước cất khác với nước tự nhiên như thế nào?
Căn cứ vào những tính chất nào mà:
a. Đồng, nhôm được dùng làm ruột dây điện còn cao su, nhựa được làm vỏ dây điện?
b. Bạc dùng để tráng gương?
c. Nhôm được dùng làm xoong, nồi?
d. Than dùng để đốt lò?
Cho biết khí cacbonic là một chất có thể làm đục nước vôi trong. Làm thế nào để nhận biết được khí này có trong hơi thở của ta?
Dựa vào tính chất vật lí và hóa học của các chất, hãy phân biệt các chất sau:
a. Bột sắt và bột lưu huỳnh.
b. Đường và tinh bột.
c. Et-xăng và nước.
Khi nào chất được voi là nguyên chất (tinh khiết hóa học)? Tính chất của chất tinh khiết khác với chất không tinh khiết như thế nào?
Hỗn hợp là gì? Trong hỗn hợp tính chất riêng của mỗi chất có còn giữ nguyên hay không?
Dựa vào tính chất nào của tinh bột khác với đường có thể tách riêng tinh bột ra khỏi hỗn hợp tinh bột và đường? (Nêu cách làm)
Vì sao nói: không khí, nước đường là những hỗn hợp? Có thể thay đổi độ ngọt của đường bằng cách nào?
Không khí là hỗn hợp gồm hai chất khí chính là oxi và nitơ. Biết oxi lỏng sôi ở nhiệt độ −183oC, nitơ lỏng sôi ở nhiệt độ −196oC. Làm thế nào để tách riêng được oxi và nitơ lỏng?
Làm thế nào để tách:
a. Nước ra khỏi cát?
b. Tách rượu etylic ra khỏi nước? (Cho biết nhiệt độ sôi của rượu etylic là 78,3oC).
a. Nguyên tử được tạo thành từ ba loại hạt nhỏ hơn nữa, đó là những hạt nào?
b. Hãy nói tên, kí hiệu và điện tích của những hạt mang điện.
c. Những nguyên tử cùng loại có cùng số hạt nào trong hạt nhân?
Vì sao nói khối lượng của hạt nhân được coi là khối lượng nguyên tử.
Viết CTHH của các hợp chất sau:
a. Vôi sống (canxi oxit) biết trong phân tử có một nguyên tử Ca và một nguyên tử O.
b. Kẽm clorua biết trong phân tử có một nguyên tử kẽm và hai nguyên tử clo.
c. Đường, biết trong phân tử có 12 nguyên tử C, 22 nguyên tử H và 11 nguyên tử O. Xác định phân tử khối của vôi sống, kẽm clorua và của đường.
a. Hóa trị của nguyên tố hóa học được quy định bằng gì? Nêu ví dụ.
b. Có thể xác định hóa trị gián tiếp qua nguyên tố nào?
Mol là gì?
a. Một mol nguyên tử gồm bao nhiêu nguyên tử? Lấy ví dụ 1 mol N; 1 mol P; 1 mol Ca; 1 mol Fe.
b. Một mol nguyên tử có bao nhiêu phân tử? Lấy ví dụ với 1 mol N2; 1 mol NaCl; 1 mol CaO; 1 mol CaCO3.
a. Tính thành phần % về khối lượng các nguyên tố S và O trong khí SO3.
b. Tính khối lượng nguyên tố S và O có trong 12,8g khí SO3.
Trong 9,8g H2SO4. Hỏi:
a. Có bao nhiêu mol phân tử (ptg).
b. Có bao nhiêu phân tử H2SO4.
c. Có bao nhiêu mol nguyên tử H; O; S.
d. Tỉ lệ số nguyên tử các nguyên tố trong H2SO4.
a. Tính khối lượng của 0,2 mol O2; 0,5 mol NaOH.
b. Cần lấy bao nhiêu mol HCl để có được 14,6g HCl.
c. Tính khối lượng mol nguyên tử của kim loại M, biết 0,5 mol M có khối lượng
c. Tính khối lượng mol nguyên tử của kim loại M, biết 0,5 mol M có khối lượng
Lập công thức hóa học của hợp chất gồm 2 nguyên tố C và O, biết rằng trong 1 mol chất đó có 12g C, chiến 27,27% về khối lượng.
Một loại quặng sắt chứa 90% oxit Fe3O4 (còn 10% là tạp chất không có sắt). Hãy tính:
a. Khối lượng sắt có trong 1 tấn quặng đó.
b. Khối lượng quặng cần lấy để được 1 tấn sắt.
Hãy giải thích tại sao:
a. Khi nung nóng canxi cacbonat (đá vôi) thấy khối lượng giảm đi.
b. Khi nung nóng một miếng đồng thì thấy khối lượng tăng lên.
a. Để đốt cháy m gam chất X cần dùng 4,48 lít O2 (ở đktc) thu được 2,24 lít CO2 (đktc) và 2,6 gam H2O. Tính m.
b. Để đốt cháy 16 gam chất Y cần dùng 44,8 lít O2 (đktc) thu được khí cacbonic và hơi nước theo tỉ lệ số mol 1 : 2. Tính khối lượng khí CO2 và H2O tạo thành.
Tính số mol nguyên tử n có trong:
a. 6g cacbon.
b. 6g magie.
c. 2,8 g nitơ.
d. 4,8g oxi.
Lập phương trình hóa học của phản ứng giữa axit clohiđric tác dụng với kẽm theo sơ đồ sau: . Biết rằng sau phản ứng thu được 0,3 mol khí hiđro. Hãy tính:
a. Khối lượng kẽm đã phản ứng.
b. Khối lượng axit HCl đã phản ứng
Khi đốt chát 4,6g một hợp chất bằng oxi thì thu được 8,8g CO2 và 5,4g H2O. Hãy cho biết:
a. Hợp chất do nguyên tố nào tạo nên.
b. Tính khối lượng các nguyên tố có trong lượng chất trên.
Tính % khối lượng của các nguyên tố có trong các hợp chất sau:
H2O; H2SO4; C2H5OH; CH3−COOH; CnH2n+2; FexOy
Tính khối lượng m của:
a. 0,5 mol Mg và 0,5 mol Zn.
b. 0,3 mol N và 0,3 mol O.
c. 2 mol NH3 và 2 mol O2.
d. 0,4 mol MgO và 0,4 mol Al2O3.
Nếu dùng 11,2g Fe và 3,2g S thì sau phản ứng sẽ thu được những chất nào và với khối lượng là bao nhiêu?
Để điều chế hỗn hợp nổ, người ta phải trộn oxi lỏng với bột than theo tỉ lệ nào về khối lượng để được hỗn hợp nổ mạnh nhất?
Từ tỉ lệ khối lượng các nguyên tố hiđro và õi, hãy tính tỉ lệ số nguyên tử các nguyên tố tạo thành nước. Tỉ lệ đó có phù hợp với CTHH của nước không?
Tính thành phần % về khối lượng của nguyên tố O có trong:
a. Khí cacbonoxit CO.
b. Natri oxit Na2O.
c. Nhôm oxit Al2O3.
Ở chất nào có nhiều oxi hơn cả?
Xác định công thức phân tử của các chất X, Y, Z biết thành phần phần trăm khối lượng như sau:
a. Chất X chứa 85,71% cacbon và 14,29% hiđro, một lít khí X (đktc) nặng 1,25g.
b) Chất Y chứa 80% cacnon và 20% hiđro.
c. Chất X chứa 40% cacbon, 6,67% hiđro và 53,35% oxi. Biết mỗi phân tử Z có 2 nguyên tử oxi.
Trong 8g lưu huỳnh có bao nhiêu mol? Bao nhiêu nguyên tử S? Phải lấy bao nhiêu gam kim loại Na để có số nguyên tử Na nhiều gấp 2 lần số nguyên tử lưu huỳnh S?
Cho sơ đồ của phản ứng phân hủy thủy phân oxit: Hãy lập PTHH và:
a. Tính khối lượng khí oxi sinh ra khi có 0,1 mol HgO đã phân hủy.
b. Tính khối lượng thủy ngân Hg sinh ra khi có 43,4g HgO phân hủy.
c. Tính khối lượng oxit thủy ngân đã phân hủy khi có 14,07g Hg sinh ra.
a. Sắt tạo được 3 oxit FeO; Fe2O3; Fe3O4. Nếu hàm lượng của Fe trong oxit là 70% (khối lượng) thì đó là oxit nào của sắt?
b. Nếu hamg lượng % của một kim loại trong muối cacbonat là 40% thì hàm lượng % của kim loại đó trong muối phốt phát là bao nhiêu?
Một bình kín có dung tích chứa đấy không khí (đktc). Người ta đưa vào bình 10g phốt pho để đốt. Hỏi lượng phốt pho trên có cháy hết không? Cho rằng oxi chiếm thể tích không khí.
Những công thức hóa học sau đây cho biết những ý gì?
a. Cu.
b. Cl2.
c. H2SO4.
Cho các sơ đồ phản ứng sau:
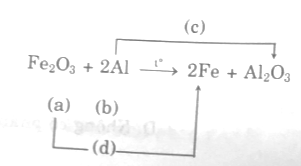
Hãy lập PTHH của các phản ứng đó và cho biết chúng thuộc loại phản ứng nào? Nếu là phản ứng oxi hóa khử thì hãy cho biết chất nào là chất khử? Chất nào là chất oxi hóa.
Hòa tan 14g vôi sống chứa 20% tạp chất vào một lượng nước dư. Tính khối lượng chất tạo thành sau phản ứng.
Tính khối lượng oxi cần thiết để đốt cháy 1kg than. Biết rằng than chứa 4% tạp chất không cháy. Tính khối lượng khí cacbonic sinh ra trong phản ứng cháy này.
Dùng chữ số, công thức hóa học và kí hiệu hóa học để diễn đạt các ý sau:
a. Hai phân tử nước.
b. Sáu nguyên tử đồng.
c. Năm phân tử canxi oxit (vôi sống).
Người ta đốt lưu huỳnh trong một bình chứa 10g oxi. Sau phản ứng người ta thu được 12,8g khí sunfurơ SO2.
a. Tính khối lượng lưu huỳnh đã cháy.
b. Tính khối lượng oxi còn thừa sau phản ứng.
Cho các sơ đồ phản ứng:
Hãy lập PTHH của phản ứng trên và cho biết trong các sản phẩm tạo thành, chất nào là oxit, chất nào là axit, chất nào là bazơ?
Phân tích 3,16g một hợp chất gồm 3 nguyên tố K; Mn; O thì thu được 0,78g K; 1g Mn.
a. Biết hợp chất trên có phân tử khối là 158. Hãy xác định công thức hóa học và gọi tên hợp chất.
b. Đem phân hủy hoàn toàn lượng hợp chất trên thì thu được bao nhiêu lít khí sau phản ứng (đo ở đktc).
c. Nếu dùng toàn bộ thể tích khí thu được ở (b). Cho tham gia phản ứng tiếp với dây sắt đã được mồi lửa (lấy dư). Tính khối lượng sắt đã tham gia vào phản ứng. Tính khối lượng sản phẩm được tạo thành sau phản ứng.
Khi đốt cháy kẽm sunfua (ZnS), chất này tác dụng với oxi tạo thành hai oxit: kẽm oxit (trong đó kẽm hóa trị II) và khí sunfurơ. Còn khi đốt cháy quặng pirit sắt FeS2 trong oxi thì được sắt III oxit Fe2O3 và khí sunfurơ. Hãy viết phương trình hóa học của các phản ứng đó.
Viết CTHH của các axit mà trong thành phần hóa học lần lượt có các gốc axit sau: (có hóa trị kèm theo)
Br (I); S (II); NO3 (I); SO3 (II); SO4 (II)
CO3 (II); PO4 (III); ClO3 (I); MnO4 (I)
Hoàn thành các phản ứng sau:
Trong những chất dùng làm phân hóa học (phân đạm) sau đây, chất nào có tỉ lệ về khối lượng Nitơ (hàm lượng Nitơ hay hàm lượng đạm) cao nhất?
Natri nitrat NaNO3.
Canxi nitrat (Ca(NO3)2.
Amoni dunfat (NH4)2SO4
Amoni nitrat NH4NO3.
Phân urê CO(NH2)2.
Các hợp chất sau: Khí metan CH4; khí axetilen C2H2; rượu etylic (cồn) C2H6O khi cháy trong oxi đề tạo thành khí cacbonic và hơi nước. Hãy viết PTHH của các phản ứng cháy của từng chất đó.
Các chất có CTHH sau:
K2O; HCl; Fe(OH)2; Fe(OH)3; H2SO4; CO
CO2; HNO3; H3PO4; FeSO4; Fe2(SO4)3
Hãy gọi tên từng chất và cho biết chất đó thuộc loại nào?
a. Dùng khí cacbon oxit khử oxi hoàn toàn của 23,2g oxit sắt từ. Sau đó cho toàn bộ sản phẩm rắn tác dụng vừa hết với axit clohiđric (ở đktc). Viết các phương trình đã xảy ra. Tính thể tích chất khí sinh ra ở phản ứng thứ 2 (đktc).
b. Nếu cho thể tích khí thu được ở trên phản ứng hết với khí õi. Tính khối lượng chất lỏng thu được sau phản ứng.
Tính hóa trị của các nguyên tố
a. Cacbon trong CH4; CCl4; CO; CO2.
b. Lưu huỳnh trong H2S; SO2; SO3.
c. Nhôm trong Al2O3; AlCl3; Al(OH)3.
Người ta điều chế kẽm oxi ZnO bằng cách đốt bột kẽm trong oxi.
a. Tính khối lượng oxi cần thiết để điều chế 40,5g kẽm oxit.
b. Muốn có lượng oxi nói trên thì phải phân hủy bao nhiêu gam kaliclorat (KClO3)?
Cho các công thức hóa học sau, hãy sửa lại những công thức viết sai.
MgCl2; KO2; PH2; KCO3; AgNO3
Al(NO3)3; Al2(SO4)3; K2PO4; Zn(OH)2
Cho 6g cacbon phản ứng với 24g khí oxi.
a. Viết phương trình phản ứng
b. Chất nào còn thừa sau phản ứng? Thừa bao nhiêu gam?
c. Tính thể tích chất được tạo thành sau phản ứng (biết rằng chất này có thể làm đục nước vôi trong).
Hãy cho biết ý nghĩa của phương trình hóa học. Lấy ví dụ minh họa.
Không khí là một hỗn hợp nhiều chất? Hiện tượng nào chứng tỏ trong không khí
a. Có khí oxi.
b. Có khí cacbonic.
Trong phòng thí nghiệm có 3 lọ mất nhãn đựng 3 dung dịch riêng biệt: dung dịch NaOH, dung dịch H2SO4 và dung dịch NaCl. Làm thế nào để nhận ra từng chất?
a. Tính khối lượng của 2,24 lít cacbon (II) oxit (đktc); 5,6 lít khí oxi (đktc).
b. Tính thể tích (đo ở đktc) của 15g khí hiđro.
Hỏi có bao nhiêu mol nguyên tử đồng trong:
a. 64g đồng.
b. 3,2g đồng.
c. 3,01.1023 nguyên tử đồng.
Hãy cho biết 3,01.1023 phân tử oxi:
a. Có bao nhiêu phân tử gam khí oxi?
b. Có khối lượng bao nhiêu gam?
c. Có thể tích bao nhiêu lít (đktc).
Tính thể tích khí hiđro (đktc) điều chế được khí cho:
a. 42g sắt tác dụng với axit clohiđric dư.
b. Kẽm dư tác dụng với dung dịch chứa 0,2 ptg axit sunfuric.
Đốt cháy hoàn toàn 126g sắt trong bình chứa khí oxi.
a. Viết phương trình phản ứng.
b. Tính thể tích khí oxi đã tham gia phản ứng trên (đktc).
c. Tính khối lượng kali clorat cần dùng để khi phân hủy thì thu được một thể tích khí oxi bằng với thể tích khí oxi đã sử dụng ở phản ứng trên (đktc).
a. Tính số nguyên tử gam có trong:
- 30g nguyên tố cacbon.
- 80g nguyên tố oxi.
- 40g nguyên tố magie.
b. Tính số phân tử gam trong:
- 108g nước H2O.
- 8g khí oxi O2.
- 22g khí cacbon.
- 8g đồng (II) oxit CuO.
Một hỗn hợp gồm 1,5 phân tử gam oxi; 2,5 phân tử gam N2; 0,5 phân tử gam CO2 và 0,5 phân tử gam SO2.
a. Tính tổng số phân tử gam khí có trong hỗn hợp đó.
b. Tính thể tích của hỗn hợp đó.
c. Tính khối lượng của hỗn hợp đó.
Đốt cháy hoàn toàn 18,6 gam phốt pho trong bình chứa khí oxi, ta thu được một chất bột màu trắng là phốt pho (V) oxit.
a. Viết phương trình phản ứng.
b. Tính thể tích khí oxi (đktc) đã tham gia phản ứng.
c. Cho một lượng nước dư vào bình lắc đều. Sau khi hòa tan hết bột trắng, chất lg lỏng trong bình có thể làm giấy quỳ tím hóa đỏ.
Cho 13g kẽm vào một dung dịch chứa 0,5 mol axit clohiđric.
a. Tính thể tích hiđro thu được ở đktc.
b. Nếu nhúng quỳ tím vào sau khi phản ứng kết thúc, quỳ tím chuyển sang màu gì?
Cho phân hủy nước bằng phương pháp điện phân, người ta thu được 28 lít khí oxi (đktc).
a. Viết phương trình phản ứng.
b. Tính khối lượng nước đã bị phân hủy.
c. Lấy toàn bộ thể tích khí oxi nói trên để đốt cháy hoàn toàn 12,8g lưu huỳnh.
Viết phương trình phản ứng.
Tính thể tích khí oxi còn dư lại sau phản ứng (đktc).
Khi cho khí hiđro đi qua bột sắt III oxit Fe2O3 nung nóng, người ta thu được sắt theo sơ đồ phản ứng:
a. Nếu sau phản ứng, người ta thu được 42g sắt thì khối lượng sắt (III) oxit đã tham gia phản ứng là bao nhiêu gam?
b. Khối lượng nước tạo thành trong phản ứng trên là bao nhiêu gam?
Người ta nung 10 tấn đá vôi (canxi cacbonat) CaCO3 phản ứng tạo thành vôi sống (canxi oxit) CaO và khí cacbonic.
a. Tính lượng vôi sống thu được.
b. Tính thể tích khí cacbonic sinh ra (đktc).
Cho 0,53 gam muối cacbonat kim loại hóa trị I tác dụng hết với dung dịch HCl thấy thoát ra 112ml khí cacbonic (đktc). Hỏi đó là muối kim loại gì?
a. Dung dịch là gì? Hãy kể vài loại dung môi thường gặp. Cho thí dụ về chất tan là chất rắn, chất lỏng, chất khí.
b. Độ tan của một chất là gì? Độ tan phụ thuộc vào yếu tố nào? Thế nào là dung dịch bão hòa, chưa bão hòa?
Tính nổng độ % của dung dịch điều chế được khi hòa tan 50g muối vào 750g nước.
Tính nổng độ % của dung dịch thu được khi hòa tan 4,48l khí hiđro clorua (HCl) ở điều kiện tiêu chuẩn vào 500cm3 nước.
Xác định nồng độ % của dung dịch thu được khi hòa tan 25g đồng sunfat ngậm nước (CuSO4.5H2O) vào 175ml nước.
Hòa tan hoàn toàn 6,66 gam tinh thể Al2(SO4)3.nH2O vào nước thành dung dịch A. Lấy dung dịch A cho tác dụng với dung dịch BaCl2 dư thì thu được 0,699 gam kết tủa. Xác định xt của tinh thể muối sunfat của nhôm ngâm nước.
a. Hòa tan 24,4g BaCl2.xH2O vào 175,6g nước thu được dung dịch 10,4%. Tính x.
b. Cô cạn rất từ từ 20ml dung dịch CuSO4 0,2M thu được 10 gam tinh thể CuSO4.yH2O. Tính y.
Hòa tan 60g NaOH vào nước thành 500ml dung dịch. Tìm nồng độ phân tử gam của dung dịch.
Xác định nồng độ phân tử gam của dung dịch thu được khi hòa tan 12,5g CuSO4.5H2O vào 87,5ml nước.
Tính số gam muối ăn và số gam nước cần lấy để pha chế được 120g dung dịch nồng độ 5%.
Phải lấy bao nhiêu ml dung dịch H2SO4 96% (d = 1,84 g/ml) để trong đó có chứa 2,45g H2SO4.
Tính nồng độ % của các dung dịch thu được trong các trường hợp:
a. Hòa tan 4g NaOH vào 200ml dung dịch NaOH (10% (d = 1,1 g.ml).
b. Hòa tan 56 lít khí amoniac vào 157,5ml nước.
Hòa tan 3,94 gam BaCO3 bằng 500ml dung dịch HCl 0,4M. Cần dùng bao nhiêu ml dung dịch NaOH 0,5M để trung hòa lượng axit dư.
Hòa tan 155g natri oxit vào 145g nước để tạo thành dung dịch có tính kiềm. Tính nồng độ % thu được.
Hòa tan 2,3 gam natri kim loại vào 197,8 gam nước.
a. Tính nồng độ % dung dịch thu được.
b. Tính nồng độ mol/l dung dịch thu được (dung dịch có khối lượng riêng d = 1,08 g/ml).
Tìm nồng độ phân tử gam của dung dịch thu được khi trộn 200ml dung dịch NaOH 0,01M với 50ml dung dịch NaOH 1M. Cho rằng không có sự thay đổi thể tích khi trộn lẫn.
Có 500ml dung dịch HNO3 20% (d = 1,2 g/ml) được làm bay hơi chỉ còn lại 200g dung dịch. Tính nồng độ % của dung dịch sau khi bay hơi.
Có thể pha chế bao nhiêu gam dung dịch MgSO4 3% từ 100g MgSO4.7H2O.
Tính thể tích nước cần thêm vào 250ml dung dịch HCl 1,25M để tạo thành dung dịch HCl 0,5M (giả sử sự hòa tan không làm thay đổi thể tích dung dịch thu được).
Trộn 50ml dung dịch HNO3 nồng độ x mol/l với 150 ml dung dịch Na(OH)2 0,2M thu được dung dịch A. Cho một ít quỳ tím vào dung dịch A thấy có màu xanh. Thêm từ từ 100ml dung dịch HCl 0,1M vào dung dịch A thấy quỳ trở lại màu tím. Tính nồng độ x.
Cho thêm nước vào 400g dung dịch axit clohiđric (HCl) nồng độ 3,65% để tạo thành 2 lít dung dịch. Tính nồng độ phân tử gam của dung dịch thu được.
a. Độ tan của muối ăn ở 20oC là 36g. Xác định nồng độ % của dung dịch bão hòa ở nhiệt độ đó.
b. Nồng độ dung dịch bão hòa muối ăn ở 20oC là 26,5%. Tính độ tan của muối ăn ở cùng nhiêt độ.
Phải thêm bao nhiêu gam nước vào 200g dung dịch KOH 20% để được dung dịch KOH 16%?
Hòa tan hoàn toàn 4g MgO bằng dung dịch H2SO4 19,6% (vừa đủ). Tính nồng độ % dung dịch muối tạo thành sau phản ứng.
Cần lấy bao nhiêu gam CaCl2.6H2O để khi hòa tan vào được thì thu được 200ml dung dịch canxi clorua 0% (d = 1,28 g/ml)?
Tính lượng tinh thể CuSO4. 5H2O cần dùng để điều chế 500ml dung dịch CuSO4 8% (D = 1,1 g/mol).
Để hòa tan 6,3g Zn thì tiêu tốn hết m (g) dung dịch HCl 30%.
a. Tính khối lượng m của dung dịch HCl đã dùng.
b. Tính nồng độ % của dung dịch thu được sau phản ứng.
Tính chất nào sau đây cho biết chất đó là tinh khiết:
Không tan trong nước.
Không màu, không mùi.
Khi đun thấy sôi ở nhiệt độ nhất định.
Có vị ngọt, mặn hoặc chua.
Chất nào sau đây được coi là tinh khiết?
(1) Nước suối.
(2) Nước cất.
(3) Nước khoáng.
(4) Nước đá sản xuất từ nhà máy.
(5) Nước lọc.
(1).
(2), (3) và (4).
(2) và (5).
(2).
Có một chất lỏng không màu không mùi đựng trong một ống nghiệm. Nhúng ống nghiệm này vào cốc thủy tinh đựng nước sôi, nhận thấy chất lỏng sôi ngay. Dự đoán nào về nhiệt độ sôi của chất lỏng là đúng nhất?
Dưới 0oC.
Giữa 0oC và nhiệt độ phòng.
Giữa nhiệt độ phòng và 100oC.
100oC.
Phép lọc được dùng để tách một hỗn hợp gồm:
Muối ăn với nước.
Muối ăn với đường.
Đường với nước.
Nước với cát.
Phép chưng cất được dùng để tách một hỗn hợp gồm:
Nước với muối ăn.
Nước với rượu.
Cát với đường.
Bột sắn với lưu huỳnh.
Có thể thay đổi độ ngọt của đường bằng cách:
Thêm đường.
Thêm nước.
A và B đều đúng.
A và B đều sai.
Cho các nguyên tử với các thành phần cấu tạo sau:
X (6n; 5p; 5e)
Y (10p; 10p; 10n)
Z (5e; 5p; 5n)
T (11p; 11e; 12n)
Ở đây có bao nhiêu nguyên tố hóa học?
4
3
2
1
Dãy chất nào dưới đây gồm toàn kim loại?
Nhôm, đồng, lưu huỳnh, bạc.
Sắt, chỉ, kẽm, thủy ngân.
Oxi, nitơ, cacbon, canxi.
Vàng, magie, nhôm, clo.
Cho dãy kí hiệu các nguyên tố sau: O, Ca, N, Fe, S.
Theo thứ tự tên các nguyên tố lần lượt là:
Oxi, cacbon, nhôm, đồng, sắt.
Oxi, canxi, neon, sắt, lưu huỳnh.
Oxi, cacbon, nitơ, kẽm, sắt.
Oxi, canxi, nitơ, sắt, lưu huỳnh.
Trong số các chất dưới đây, thuộc loại đơn chất có:
Nước.
Muối ăn.
Thủy ngân.
Khí cacbonic.
Trong số các chất dưới đây, thuộc loại hợp chất có:
Khí hiđro.
Nhôm.
Phốt pho.
Đá vôi.
Phương pháp thích hợp nhất để tách được muối ăn từ nước biển:
Phương pháp chưng cất.
Phương pháp bay hơi.
Phương pháp lọc.
Tất cả đều đúng.
Câu sau đây gồm hai phần: “ Nước cất là một hợp chất vì nước cất sôi ở đúng 100oC”.
Hãy chọn phương án đúng trong số các phương án sau:
Ý trong phần I đúng, ý trong phần II sai.
Ý trong phần I sai, ý trong phần II đúng.
Cả hai ý đều đúng và ý phần II giải thích ý phần I.
Cả hai ý đều đúng nhưng ý phần II không giải thích ý phần I.
Công thức hóa học viết sau là:
K2O.
CO3.
Al2O3.
FeCl2.
Từ công thức hóa học Na2CO3 cho biết ý nào đúng:
(1) Hợp chất trên do 3 đơn chất Na, C, O tạo nên.
(2) Hợp chất trên do 3 nguyên tố Na, C, O tạo nên.
(3) Hợp chất trên có PTK = 23 + 12 + 16 = 51.
(4) Hợp chất trên có PTK = .
(1), (2), (3).
(2), (3), (4).
(1), (4).
(2), (4).
Trong các công thức hóa học sau, công thức hóa hoạc nào là của hợp chất:
(1) CH4, K2SO4, Cl2, O3, NH3.
(2) O2, CO2, CaO, N2, H2O2.
(3) H2O, Ca(HCO3)2, Fe(OH)3, CuSO4.
(4) Br2, HBr, CO, Hg, Ni.
(5) PbO, HI, HNO3, Cr2O3, NO.
(1), (2), (5).
(3), (5).
(2), (4), (5).
(1), (4).
Trong các cách viết công thức hóa học sau, cách viết nào đúng:
(1) CH4; H2O2; O3; Ca(OH)2; MgO.
(2) CO; Fe2O2; CuO2; Hg2O; Ag2O.
(3) N2; N2O2; CH3; Cu3(SO4)2; Zn(OH)2.
(4) Fe3O4; Mg(OH)2Cl; Ca(HCO3)2; NaAlO2.
(5) Cr2O; AgOH; NaCl2; K2O; Al2O3.
(1), (4).
(3), (5).
(1), (2), (5).
(2), (3), (4).
Cho biết công thức hóa học hợp chất của nguyên tố X với O và hợp chất của nguyên tố Y với H như (X, Y là những nguyên tố nào đó): XO; TH3. Hãy chọn công thức hóa học đúng cho hợp chất của X và Y trong các công thức sau đây:
XY3.
X3Y.
X2Y3.
X3Y2.
Theo hóa trị của sắt, trong hợp chất có công thức hóa học là Fe2O3, hãy chọn công thức hóa học đúng trong số các công thức hợp chất có phân tử gồm Fe liên kết với (SO4) hóa trị (II) sai:
FeSO4.
Fe2SO4.
Fe2(SO4)2.
Fe2(SO4)3.
Cho các chất sau: Cl2; H2SO4; Cu(NO3)2; Al2(SO4)3.
Khối lượng phân tử khối lần lượt là:
71; 98; 188; 315.
71; 98; 116; 342.
71; 98; 188; 342.
71; 98; 188; 234.
Phân tử khí ozon gồm ba nguyên tử oxi. Công thức hóa học của ozon là:
3O.
3O2.
O3.
2O3.
Để chỉ hai phân tử hiđro ta viết:
2H2.
2H.
4H2.
4H.
Phát biểu nào sau đây là sai:
Trong thành phần phân tử nước cũng như khí sunfu rơ đều chứa nguyên tố oxi.
Phân tử oxi được tạo bởi hai nguyên tố oxi.
Công thức hóa học của vôi sống là CaO.
Thành phần khối lượng các nguyên tố trong phân tử khí sunfu rơ là: mS : mO = 1 : 1.
Một hợp chất X có thành phần gồm 2 nguyên tố C và O. Biết tỉ lệ khối lượng của C đối với O là mC : mO = 3 : 8. Công thức phân tử của X là:
CO.
CO2.
CO3
Tất cả đều sai.
Một hợp chất Y có phân tử khối là 58 đvc, cấu tạo từ 2 nguyên tố C và H trong đó C chiếm 82,76% khối lượng của hợp chất. Công thức phân tử của Y là:
CH4.
C2H4.
C4H8.
C4H10.
Các hiện tượng sau đây, hiện tam giác nào có sự biến đổi hóa học?
a. Sắt được cắt nhỏ thành từng đoạn và tán thành đinh.
b. Vành xa đạp bằng sắt bị phủ một lớp gỉ là chất màu nâu đỏ.
c. Rượu để lâu trong không khí thường bị chua.
d. Đèn tín hiệu chuyển từ màu xanh sang màu đỏ.
e. Dây tóc trong bóng đèn điện nóng và sáng lên khi dòng điện chạy qua.
a, b, c, d.
a, b, d, e.
b, c.
a, c, d, e.
Những hiện tượng sau, hiện tượng nào là hiện tượng hóa học?
a. Về mùa hè thức ăn thường bị thiu.
b. Đun đường, đường ngả màu nâu rồi đen đi.
c. Các quả bóng bay trên trời rồi nổ tung.
d. Cháy rừng gây ô nhiễm lớn cho môi trường.
e. Nhiệt độ Trái đất nóng lên làm băng ở hai cực Trái đất tan dần.
a, b, d.
a, b, c, e.
b, c, d.
a, b, e.
Trong số những quá trình và sự việc dưới đây, đâu là hiện tượng vật lí:
a. Hòa tan muối ăn vào nước ta được dung dịch muối ăn.
b. Có thể lặp lại thí nghiệm với chất vừa dùng để làm thí nghiệm trước đó.
c. Cồn để trong lọ không kín bị bay hơi.
d. Nước bị đóng băng ở hai cực Trái đất.
e. Cho vôi sống CaO hòa tan vào nước.
a, b, c, d.
a, b, d.
b, c, d.
a, d, e.
Phản ứng của nguyên tố X với nguyên tố Y được biểu diễn trong sơ đồ dưới đây (nguyên tử X, Y kí hiệu lần lượt là (O) và ).
Phương trình nào dưới đây biểu diễn tốt nhất phản ứng này:
Phân tích một khối lượng hợp chất M, người ta nhận thấy thành phần khối lượng của nó có 50% là lưu huỳnh và 50% là oxi. Công thức của hợp chất M có thể là:
SO2.
SO3.
SO4.
S2O3.
Một hợp chất X có thành phần gồm 2 nguyên tố C và O. Biết tỉ lệ về khối lượng của C đối với O là mC : mO = 3 : 8. X có công thức phân tử là công thức nào sau đây?
CO.
CO2.
CO3.
A, B, C đều sai.
Cho biết công thức hóa học hợp chất của nguyên tố X với H và hợp chất Y với Cl như sau: XH2; YCl3. Hãy chọn công thức thích hợp cho hợp chất của X và Y trong số các công thức sau đây:
XY3.
XY.
X3Y2.
X2Y3.
Oxit của một nguyên tố hóa học có hóa trị II chứa 20% oxi (về khối lượng). Oxit có công thức hóa học là:
CaO.
CuO.
FeO.
MgO.
Oxit nào giàu oxi nhất (hàm lượng % oxi lớn nhất)?
Al2O3.
N2O3.
P2O5.
Fe3O4.
Quặng nào giàu sắt nhất?
Hematit chứa 60% Fe2O3.
Hematit nâu chứa 62% Fe2O3.H2O.
Xiderit chứa 50% FeCO3.
Manhetit chứa 69,6% Fe3O4.
Hai nguyên tử Y kết hợp với ba nguyên tử O tạo ra phân tử oxit. Trong phân tử oxit, oxi chiếm 30% về khối lượng. Đó là nguyên tố kim loại nào sau đây?
Ca
Fe
Cu
Zn
Một hợp chất hữu cơ có nguyên tố cacbon chiếm 80% và 20% là hiđro. Tỉ khối của hợp chất với hiđro bằng 15. Công thức hóa học của hợp chất hữu cơ là:
CH3.
C3H9.
C2H6.
C3H8.
Một loại quặng sắt chứa 90% Fe3O4. Khối lượng sắt có trong một tấn quặng đó là:
0,65 tấn.
0,6517 tấn.
0,66 tấn.
0,76 tấn.
Phát biểu nào dưới đây là đúng:
Thành phần % khối lượng nguyên tố oxi trong nước lớn hơn thành phần % khối lượng nguyên tố oxi trong khí cacbonic.
Thành phần % khối lượng nguyên tố oxi trong nước nhỏ hơn thành phần % khối lượng nguyên tố oxi trong khí cacbonic.
Thành phần % khối lượng nguyên tố oxi trong nước bằng thành phần % khối lượng nguyên tố oxi trong khí cacbonic.
Không xác định được.
8,8g khí cacbonic có cùng số mol phân tử với:
18g nước.
6,4g khí sunfurơ.
9g nước.
12,8g khí sunfurơ.
Cần lấy bao nhiêu gam oxi để có số phân tử bằng nửa số phân tử có trong 22g CO2?
8g.
8,5g.
9g.
16g.
Cho tỉ khối của khí A đối với khí B là 2,125 và tỉ khối của khí B đối với oxi là 0,5. Khối lượng mol của khí A là:
33.
34.
68.
34,5.
Cho biết 400cm3 một chất khí ở đktc có khối lượng 1,143g. Khối lượng mol phân tử của chất khí đó là:
64g.
64,01g.
64,01g.
70g.
Cho các chất sau:
a. Fe3O4.
b. KClO3.
c. KMnO4.
d. CaCO3.
e. Không khí.
g. H2O.
Những chất được dùng để điều chế oxi trong phòng thí nghiệm là:
a, b, c, e.
b, c, e, g.
b, c.
b, c, e.
Người ta thu khĩ oxi bằng cách đẩy nước là nhờ dựa vào tính chất:
Khí oxi tan trong nước.
Khí oxi ít tan trong nước.
Khí oxi khó hóa lỏng.
Khí oxi nhẹ hơn nước.
Người ta còn thu khí oxi bằng cách đẩy không khí là nhờ dựa vào tính chất:
Khí oxi nhẹ hơn không khí.
Khí oxi nặng hơn không khí.
Khí oxi dễ trộn lẫn với không khí.
Khí oxi ít tan trong nước.
Sự oxi hóa chậm là:
Sự oxi hóa mà không tả nhiệt.
Sự oxi hóa mà không phát sáng.
Sự oxi hóa tỏa nhiệt mà không phát sáng.
Sự tự bốc cháy.
Khi phân hủy có xúc tác 122,5g kali clorat KClO3, thể tích khí oxi thu được là:
33,6l.
3,36l.
11,2l.
1,12l.
Số gam kali pemanganat KMnO4 cần dùng để điều chế được 2,24l khí oxi (đktc) là:
20,7g.
42,8g.
14,3g.
31,6g.
Trong các oxit sau đây: SO3, CuO, Na2O, CaO, CO2, Al2O3, oxit nào tác dụng được với nước?
SO3, CuO, Na2O.
SO3, Na2O, CO2, CaO.
SO3, Al2O3, Na2O.
Tất cả đều tác dụng.
Cho những oxit sau: SO2, K2O, Li2O, CaO, MgO, CO, NO, N2O5, P2O5. Những oxit vừa tác dụng với nước, vừa tác dụng với axit là:
SO2, Li2O, CaO, MgO, NO.
Li2O, CaO, K2O.
Li2O, N2O5, NO, CO, MgO.
K2O, Li2O, SO2, P2O5.
Có 3 oxit sau: MgO, SO3, Na2O. Có thể nhận biết được các chất đó bằng thuốc thử sau đây không?
Chỉ dùng nước.
Chỉ dùng dung dịch kiềm.
Chỉ dùng axit.
Dùng nước và giấy quỳ tím.
Khu mỏ sắt ở Trại Cau (Thái Nguyên) có một loại quặng sắt. Khi phân tích một mẫu quặng này, người ta nhận thấy có 2,8g sắt. Trong mẫu quặng trên, khối lượng sắt (III) oxit Fe2O3 ứng với hàm lượng sắt nói trên là:
6g.
8g.
4g.
3g.
Tỉ lệ khối lượng của nitơ và oxi trong một oxit là 7 : 20. Công thức của oxit là:
N2O.
N2O3.
NO2.
N2O5.
Cho 28,4g đi photpho pentaoxit P2O5 vào cốc chứa 90g H2O để tạo thành axit photphoric H3PO4. Khối lượng axit H3PO4 tạo thành là:
19,6g.
58,8g.
39,2g.
40g.
Cho các oxit có công thức hóa học sau: CO2, CO, Mn2O7, SiO2, P2O5, NO2, N2O5, CaO, Al2O3. Các oxit axit được sắp xếp như sau:
CO, CO2, MnO2, Al2O3, P2O5.
CO2, Mn2O7, SiO2, P2O5, NO2, N2O5.
CO2, Mn2O7, SiO2, MnO2, CaO.
SiO2, Mn2O7, P2O5, N2O5, CaO.
Có 4 lọ đựng riêng biệt: nước cất, dung dịch axx sunfuric H2SO4, dung dịch natri hiđroxit NaOH, dung dịch muối ăn NaCl. Bằng cách nào có thể nhận biết được mỗi chất trong các lọ?
Giấy quỳ tím.
Giấy quỳ tím và đun cạn.
Nhiệt phân và phenolphtalein.
Dung dịch NaOH.
Có 4 lọ mất nhãn đựng 4 chất bột màu trắng gồm: CaO, Na2O, MgO và P2O5. Dùng thuốc thử nào để nhận biết các chất trên?
Dùng nước và dung dịch axit H2SO4.
Dùng dung dịch axit H2SO4 và phenolphtalein.
Dùng nước và giấy quỳ tím.
Không có chất nào khử được.
Cho 11,2g sắt tác dụng với dung dịch axit sunfuric loãng có chứa 12,25g H2SO4. Thể tích H2 (đktc) thu được là:
2,9 lít.
2,8 lít.
3 lít.
4 lít.
Phản ứng nào dưới đây là phản ứng hóa hợp?
Bột nhôm cháy theo phản ứng: Nhôm + khí oxi Nhôm oxit (Al2O3)
Cho biết khối lượng nhôm đã phản ứng là 54g và khối lượng nhôm oxit sinh ra là 102g. Vậy thể tích oxi đã dùng là thể tích nào dưới đây?
33 lít.
34 lít.
33,6 lít.
40,6 lít.
Khi đốt cháy 1 mol chất Y cần 6,5 mol O2 và thu được 4 mol CO2 và 5 mol H2O. Chất Y có công thức phân tử nào sau đây:
C4H10.
C4H8.
C4H6.
C5H12.
Trong giờ thực hành thí nghiệm, một học sinh đốt cháy 3,2 gam lưu huỳnh trong 1,12 lít oxi (đktc). Sau phản ứng sẽ có:
Lưu huỳnh dư.
Oxi thiếu.
Lưu huỳnh thiếu.
Oxi dư.
Người ta điều chế vôi sống (CaO) bằng cách nung đá vôi (CaCO3). Lượng vôi sống thu được từ 1 tấn đá vôi có chứa 10% tạp chất là 0,45 tấn. Hiệu suất phản ứng là:
89%.
90%.
98%.
89,28%.
Trong các phản ứng hóa học sau, phản ứng nào là phản ứng hóa hợp, phản ứng phân hủy, phản ứng oxi hóa khử, phản ứng thế?
2, 6, 8.
2, 6, 7, 8, 9.
2, 6, 8, 10.
1, 4, 5, 6, 8, 9.
Trong các phản ứng hóa học sau, phản ứng nào là phản ứng phân hủy?
1, 2, 7, 9.
4, 5, 6, 10.
1, 4.
Không có phản ứng nào
Trong các phản ứng hóa học sau, phản ứng nào là phản phản ứng thế?
3, 5, 6, 9.
3, 5, 9, 10.
1, 2, 3, 6, 9.
2, 3, 4, 8, 9.
Trong các phản ứng hóa học sau phản ứng oxi - hóa khử là?
6, 7, 8, 9, 10.
1, 3, 5, 7, 9.
7, 9, 10.
2, 3, 5, 7, 8.
Phản ứng nào dưới đây là phản ứng thế?
Phản ứng nào dưới đây không là phản ứng thế?
Cho sơ đồ phản ứng với các đặc điểm được ghi rõ như sau:
Cho biết phát biểu nào dưới đây là đúng:
Chất khử.
Chất oxi hóa.
Sự khử.
Sự khử.
Phản ứng nào dưới đây là phản ứng oxi hóa khử?
Phản ứng nào dưới đây không phải là phản ứng oxi hóa khử?
Các phương trình phản ứng sau, phản ứng nào là phản ứng oxi hóa khử?
2, 4, 5.
1, 4, 6.
4, 5, 6.
2, 3, 4.
Những oxit sau: SO2, CO2, CO, CaO, MgO, CuO, Na2O, Al2O3, N2O5, K2O. Những oxit nào vừa tác dụng được với nước, vừa tác dụng được với axit hoặc vừa tác dụng được với nước, vừa tác dụng được với kiềm?
SO2; CO; CO2; CaO; Na2O.
SO2; CO2; N2O5; Na2O; CaO; K2O.
CuO; Al2O3; MgO; CO; K2O.
Na2O; CaO; Al2O3; MgO; SO2; CO2.
Cho CuO tác dụng với dung dịch axit HCl sẽ có hiện tượng sau:
Chất khí cháy trong không khí với ngọn lửa màu xanh.
Chất khí làm đục nước vôi trong.
Dung dịch có màu xanh.
Không có hiện tượng gì.
Trong số những chất có công thức hóa học dưới đây, chất nào làm quỳ tím hóa đỏ?
H2O.
HCl.
NaOH.
Cu.
Trong phòng thí nghiệm có các kim loại kẽm và magie, các dung dịch axit sunfuric loãng H2SO4 và axit clohiđric HCl. Muốn điều chế được 1,12 lít khí hiđro (đktc) phải dùng kim loại nào, axit nào để chỉ cần một khối lượng nhỏ nhất?
Mg và H2SO4.
Mg và HCl.
Zn và H2SO4.
Zn và HCl.
Có những chất rắn sau: CaO, P2O5, MgO, Na2SO4. Dùng những thuốc thử nào để có thể phân biệt được các chất trên?
Dùng axit và giấy quỳ tím.
Dùng H2SO4 và phenolphtalein.
Dùng H2O và giấy quỳ tím.
Dùng dung dịch NaOH.
Bằng phương pháp hóa học làm thế nào để nhận ra sự có mặt của mỗi khí trong hỗn hợp gồm: CO, CO2, SO3?
Dẫn hỗn hợp qua dung dịch BaCl2.
Dẫn hỗn hợp qua dung dịch Ca(OH)2.
Dẫn hỗn hợp qua dung dịch BaCl2, sau đó qua nước vôi trong dư.
Tất cả đều sai.
Có 6 lọ mất nhãn chứa dung dịch các chất sau: HCl, H2SO4, BaCl2, NaCl, NaOH, Ba(OH)2. Hãy chọn một thuốc thử để nhận biết các dung dịch trên.
Quỳ tím.
Dung dịch phenolphtalein.
Dung dịch AgNO3.
Tất cả đều sai.
Trong số những chất dưới đây, chất nào làm cho quỳ tím hóa xanh?
Đường.
Muối ăn.
Nước vôi.
Dấm ăn.
Trong số những chất có công thức hóa học dưới đây, chất nào làm quỳ tím không đổi màu?
HNO3.
NaOH.
Ca(OH)2.
NaCl.
Dãy chất nào chỉ bao gồm toàn axit?
HCl; NaOH.
CaO; H2SO4.
H3PO4; HNO3.
SO2; KOH.
Dãy chất nào chỉ bao gồm toàn muối?
MgCl2, Na2SO4, KNO3.
Na2CO3, H2SO4, Ba(OH)2.
CaSO4, HCl, MgCO3.
H2O, Na3PO4, KOH.
Cho biết phát biểu nào dưới đây là đúng?
Gốc sunfat SO4 hóa trị I.
Gốc photphat PO4 hóa trị II.
Gốc nitrat NO3 hóa trị III.
Nhóm hiđroxit OH hóa trị I.
Dung dịch là:
Hỗn hợp gồm dung môi và chất tan.
Hợp chất gồm dung môi và chất tan.
Hỗn hợp đồng nhất gồm nước và chất tan.
Hỗn hợp đồng nhất gồm dung môi và chất tan.
Đồng (II) sunfat tan vào nước tạo thành dung dịch có màu xanh lơ. Màu xanh càng đậm nếu nồng độ dung dịch càng cao. Có 4 dung dịch được pha chế như sau (thể tích dung dịch coi bằng thể tích nước).
Dung dịch I: 100ml H2O và 2,4g CuSO4.
Dung dịch II: 300ml H2O và 6,4g CuSO4.
Dung dịch III: 200ml H2O và 3,2g CuSO4.
Dung dịch IV: 400ml H2O và 8,0g CuSO4.
Hỏi: Dung dịch nào có màu xanh đậm nhất?
(I).
(II).
(III).
(IV).
Dung dịch là hỗn hợp
Chất rắn trong chất lỏng.
Chất khí trong chất lỏng.
Đồng nhất của chất rắn và dung môi.
Đồng nhất của chất tan và dung môi.
Nồng độ phần trăm của dung dịch là:
Số gam chất tan trong 100g dung môi.
Số gam chất tan trong 100g dung dịch.
Số gam chất tan trong 1 lít dung dịch.
Số gam chất tan trong 1 lít dung môi.
Nồng độ mol/l của dung dịch là:
Số gam chất tan trong 1 lít dung dịch.
Số gam chất tan trong 1 lít dung môi.
Số mol chất tan trong 1 lít dung dịch.
Số mol chất tan trong 1 lít dung môi.
Độ tan của một chất trong nước ở một nhiệt độ xác định là:
Số gam chất đó có thể tan trong 100g dung dịch.
Số gam chất đó có thể tan trong 100g nước.
Số gam chất đó có thể tan trong 100g dung môi để tạo thành dung dịch bão hòa.
Số gam chất đó có thể tan trong 100g nước để tạo thành dung dịch bão hòa.
Lấy mỗi chất 10 gam hòa tan hoàn toàn vào nước thành 200ml dung dịch. Hỏi dung dịch chất nào có nồng độ mol lớn nhất?
Na2CO3.
Na2SO4.
NaH2PO4.
Ca(NO3)2.
Hòa tan 14,28g Na2CO3.10H2O vào 200g nước. Nồng độ % (khối lượng) của dung dịch là:
2,08%.
2,4%.
5,63%.
7,62%.
Trộn 2 lít dung dịch HCl vào 1 lít dung dịch HCl 0,5M. Nồng độ mol của dung dịch mới là:
2,82M.
2,81M.
2,83M.
Tất cả đều sai.
Cần phải dùng bao nhiêu lít H2SO4 có tỉ khối d = 1,84 và bao nhiêu lít nước cất để pha thành 10 lít dung dịch H2SO4 có d = 1,28?
6,66 lít H2SO4 và 3,34 lít H2O.
6,67 lít H2SO4 và 3,33 lít H2O.
6,65 lít H2SO4 và 3,35 lít H2O.
7 lít H2SO4 và 3 lít H2O.
Rót từ từ nước vào cốc đựng sẵn m gam Na2CO3.10H2O cho đủ 250ml. Khuấy cho muối tan hết, ta được dung dịch Na2CO3 0,1M. Khối lượng của m là:
6,61g.
7,15g.
10,03g.
3,46g.
Cô cạn 150ml dung dịch CuSO4 có khối lượng riêng là 1,2 g/ml thu được 56,25g CuSO4.5H2O. Nồng độ % của dung dịch CuSO4 là:
5,61%.
20%.
17,8%.
23,4%.








