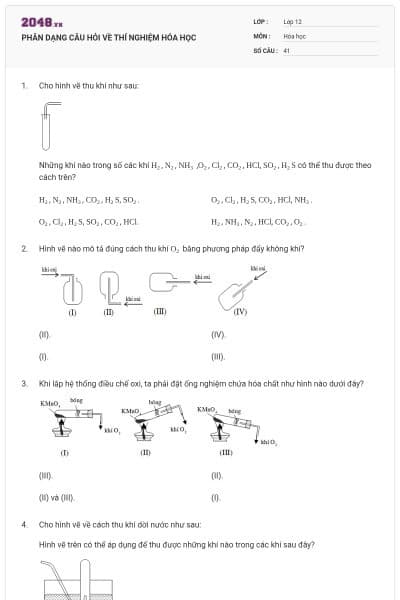
58 câu hỏi
Sản phẩm của phản ứng nhiệt phân hoàn toàn AgNO3 là :
Ag, NO2, O2
Ag2O, NO, O2
Ag, NO, O2
Ag2O, NO2, O2
Cho các cân bằng hóa học sau:
(a) H2 (k) + I2 (k) 2HI (k)
(b) 2NO2 (k) N2O4 (k)
(c) 3H2 (k) + N2 (k) 2NH3 (k)
(d) 2SO2 (k) + O2 (k) 2SO3 (k)
Ở nhiệt độ không đổi, khi thay đổi áp suất chung của mỗi hệ cân bằng, cân bằng hóa học nào ở trên không bị chuyển dịch?
(d).
(b).
(c).
(a).
Cho dãy các chất và ion : Cl2, F2, SO2, Na+, Ca2+, Fe2+, Al3+, Cr2+, , . Số chất và ion trong dãy đều có tính oxi hoá và tính khử là :
3.
6.
4.
5.
Cho phương trình hóa học (với a, b, c, d là các hệ số) :
aFeSO4 + bCl2 cFe2(SO4)3 + dFeCl3
Tỉ lệ a : c là :
2 : 1
3 :1
3 : 2.
4 : 1
Cho dãy gồm các phân tử và ion : Zn, S, FeO, SO2, Fe2+, Cu2+, HCl. Tổng số phân tử và ion trong dãy vừa có tính oxi hóa, vừa có tính khử là
7.
4
6.
5.
Trong một bình thuỷ tinh kín có cân bằng sau :
2NO2 N2O4 < 0 (hay + Q)
(màu nâu đỏ) (không màu)
Ngâm bình này vào nước đá. Màu của hỗn hợp khí trong bình biến đổi như thế nào ?
Ban đầu nhạt dần sau đó đậm dần
Màu nâu nhạt dần
Màu nâu đậm dần
Không thay đổi
Cho cân bằng : 2SO2 (k) + O2 (k) 2SO3 (k). Khi tăng nhiệt độ thì tỉ khối của hỗn hợp khí so với H2 giảm đi. Phát biểu đúng khi nói về cân bằng này là :
Phản ứng nghịch toả nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ.
Phản ứng thuận toả nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ
Phản ứng nghịch thu nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt đô
Phản ứng thuận thu nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ
Hệ cân bằng sau được thực hiện trong bình kín:
Cân bằng trên chuyển dịch theo chiều thuận khi
thêm khí H2 vào hệ
tăng áp suất chung của hệ
cho chất xúc tác vào hệ
giảm nhiệt độ của hệ
Cho phản ứng : FeSO4 + K2Cr2O7 + H2SO4 ® Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
Tổng hệ số cân bằng của các chất trong phản ứng là :
26
12
14.
30
Cho các chất Cl2, H2O, KBr, HF, H2SO4 đặc, nóng. Đem trộn từng cặp chất với nhau, số cặp chất có phản ứng oxi hoá - khử xảy ra là
3
5
2
4
Hoà tan x mol CuFeS2 bằng dung dịch HNO3 đặc nóng, thu được y mol NO2 (sản phẩm khử duy nhất). Biểu thức liên hệ giữa x và y là :
y =17x.
y =15x.
x =15y.
x =17y.
Cho các phản ứng :
(a) Sn + HCl (loãng)
(b) FeS + H2SO4 (loãng)
(c) MnO2 + HCl (đặc)
(d) Cu + H2SO4 (đặc)
(e) Al + H2SO4 (loãng)
(g) FeSO4 + KMnO4 + H2SO4
Số phản ứng mà H+ của axit đóng vai trò oxi hóa là :
3
6
2.
5
Trong phản ứng: K2Cr2O7 + HCl ® CrCl3 + Cl2 + KCl + H2O
Số phân tử HCl đóng vai trò chất khử bằng k lần tổng số phân tử HCl tham gia phản ứng. Giá trị của k là
4/7.
1/7.
3/14.
3/7.
Tổng hệ số (các số nguyên, tối giản) của tất cả các chất trong phương trình phản ứng giữa Cu với dung dịch HNO3 đặc, nóng là :
8
11
9.
10.
Cho các phát biểu sau :
(1) Phản ứng thuận nghịch là phản ứng xảy ra theo 2 chiều ngược nhau.
(2) Chất xúc tác có tác dụng làm tăng tốc độ phản ứng thuận và nghịch.
(3) Cân bằng hóa học là trạng thái mà phản ứng đã xảy ra hoàn toàn.
(4) Khi phản ứng thuận nghịch đạt trạng thái cân bằng hóa học, lượng các chất sẽ không đổi.
(5) Khi phản ứng thuận nghịch đạt trạng thái cân bằng hóa học, phản ứng dừng lại
Các phát biểu sai là
(3), (5).
(3), (4).
(2), (3).
(4), (5).
Cho cân bằng hoá học : N2 (k) +3H2 (k) 2NH3 (k) (*)
Cân bằng trên chuyển dịch theo chiều thuận khi :
giảm áp suất của hệ phản ứng
thêm chất xúc tác vào hệ phản ứng
tăng áp suất của hệ phản ứng
tăng nhiệt độ của hệ phản ứng
Trong một bình kín có cân bằng hóa học sau :
Tỉ khối hơi của hỗn hợp khí trong bình so với H2 ở nhiệt độ T1 bằng 27,6 và ở nhiệt độ T2 bằng 34,5. Biết T1> T2. Phát biểu nào sau đây về cân bằng trên là đúng?
Phản ứng thuận là phản ứng tỏa nhiệt
Khi tăng nhiệt độ, áp suất chung của hệ cân bằng giảm
Khi giảm nhiệt độ, áp suất chung của hệ cân bằng tăng
Phản ứng nghịch là phản ứng tỏa nhiệt
Cho phản ứng: FeO + HNO3 ® Fe(NO3)3 + NO + H2O.
Trong phương trình của phản ứng trên, khi hệ số của FeO là 3 thì hệ số của HNO3 là
4
6
10
8
Cho các phản ứng sau :
(a) 4HCl + PbO2 ® PbCl2 + Cl2 + 2H2O
(b) HCl + NH4HCO3 ® NH4Cl + CO2 + H2O
(c) 2HCl + 2HNO3 ® 2NO3 + Cl2 + 2H2O
(d) 2HCl + Zn ® ZnCl2 + H2
Số phản ứng trong đó HCl thể hiện tính khử là
2
4
1
3
Cho cân bằng hoá học : 2SO2 (k) + O2 (k) 2SO3 (k); phản ứng thuận là phản ứng toả nhiệt. Phát biểu đúng là :
Cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ
Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ SO3
Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ O2
Cân bằng chuyển dịch theo chiều thuận khi giảm áp suất hệ phản ứng
Cho hai hệ cân bằng sau trong hai bình kín:
C (r) + CO2 (k) 2CO(k); = 172 kJ; (1)
CO (k) + H2O (k) CO2 (k) + H2 (k); = – 41 kJ (2)
Có bao nhiêu điều kiện trong các điều kiện sau đây làm các cân bằng trên chuyển dịch ngược chiều nhau (giữ nguyên các điều kiện khác)?
(1) Tăng nhiệt độ.
(2) Thêm khí CO2 vào.
(3) Tăng áp suất.
(4) Dùng chất xúc tác.
(5) Thêm khí CO vào.
5
2
3
4
Cho sơ đồ sau :
SCuSSO2SO3H2SO4H2HClCl2
Hãy cho biết phản ứng nào trong các phản ứng trên không phải là phản ứng oxi hóa - khử ?
(4).
(4), (5), (6), (7).
(4), (6).
(1), (2), (3), (4), (5).
Cho dung dịch X chứa KMnO4 và H2SO4 (loãng) lần lượt vào các dung dịch : FeCl2, FeSO4, CuSO4, MgSO4, H2S, HCl (đặc). Số trường hợp có xảy ra phản ứng oxi hoá - khử là
5
3
6
4
Cho phản ứng: SO2 + KMnO4 + H2O ® K2SO4 + MnSO4 + H2SO4.
Trong phương trình hóa học của phản ứng trên, khi hệ số của KMnO4 là 2 thì hệ số của SO2 là
5
7
6
4
Cho các chất sau : FeBr3, FeCl2, Fe3O4, AlBr3, MgI, KBr, NaCl. Axit H2SO4 đặc nóng có thể oxi hóa bao nhiêu chất ?
7.
6.
5.
4.
Khi cho Cu tác dụng với dung dịch chứa H2SO4 loãng và NaNO3, vai trò của NaNO3 trong phản ứng là :
chất xúc tác
chất oxi hoá
môi trường
chất khử
Cho các chất : KBr, S, SiO2, P, Na3PO4, FeO, Cu và Fe2O3. Trong các chất trên, số chất có thể bị oxi hoá bởi dung dịch axit H2SO4 đặc nóng là :
4
5
7
6
Cho cân bằng sau trong bình kín:
2NO2 (khí) N2O4 (khí)
(nâu đỏ) (không màu)
Biết khi hạ nhiệt độ của bình thì màu nâu đỏ nhạt dần. Phản ứng thuận có
DH < 0, phản ứng thu nhiệt
DH < 0, phản ứng toả nhiệt
DH > 0, phản ứng toả nhiệt
DH > 0, phản ứng thu nhiệt
Cho cân bằng hóa học sau:
2SO2 (k) + O2 (k) 2SO3 (k) ; DH < 0
Cho các biện pháp : (1) tăng nhiệt độ, (2) tăng áp suất chung của hệ phản ứng, (3) hạ nhiệt độ, (4) dùng thêm chất xúc tác V2O5, (5) giảm nồng độ SO3, (6) giảm áp suất chung của hệ phản ứng. Những biện pháp nào làm cân bằng trên chuyển dịch theo chiều thuận ?
(2), (3), (4), (6).
(1), (2), (4).
(1), (2), (4), (5).
(2), (3), (5).
Cho phản ứng sau : Mg + HNO3 Mg(NO3)2 + NO + N2O + H2O (tỉ lệ số mol giữa NO và N2O là 2 : 1). Hệ số cân bằng tối giản của HNO3 trong phương trình hoá học là
18
20
12
30
Cho cân bằng hóa học : nX (k) + mY (k) pZ (k) + qT (k). Ở 50oC, số mol chất Z là x; Ở 100oC số mol chất Z là y. Biết x > y và (n+m) > (p+q), kết luận nào sau đây đúng?
Phản ứng thuận tỏa nhiệt, làm giảm áp suất của hệ
Phản ứng thuận tỏa nhiệt, làm tăng áp suất của hệ.
Phản ứng thuận thu nhiệt, làm tăng áp suất của hệ
Phản ứng thuận thu nhiệt, làm giảm áp suất của hệ
Cho phương trình hóa học của phản ứng: X + 2Y ® Z + T. Ở thời điểm ban đầu, nồng độ của chất X là 0,01 mol/l. Sau 20 giây, nồng độ của chất X là 0,008 mol/l. Tốc độ trung bình của phản ứng tính theo chất X trong khoảng thời gian trên là
4,0.10-4 mol/(l.s).
7,5.10-4 mol/(l.s).
1,0.10-4 mol/(l.s).
5,0.10-4 mol/(l.s).
Cho cân bằng (trong bình kín) sau :
CO (k) + H2O (k) CO2 (k) + H2 (k) H < 0 (*)
Trong các yếu tố: (1) tăng nhiệt độ; (2) thêm một lượng hơi nước; (3) thêm một lượng H2; (4) tăng áp suất chung của hệ; (5) dùng chất xúc tác. Dãy gồm các yếu tố đều làm thay đổi cân bằng của hệ là :
(2), (3), (4).
(1), (2), (3).
(1), (2), (4).
(1), (4), (5).
Cho dãy các chất và ion: Zn, S, FeO, SO2, N2, HCl, Cu2+, . Số chất và ion có cả tính oxi hoá và tính khử là
4
6
5
7
Biện pháp nào làm tăng hiệu suất tổng hợp SO3 từ SO2 và O2 trong công nghiệp ? Biết phản ứng tỏa nhiệt.
(a) Thay O2 không khí bằng O2 tinh khiết.
(b) Tăng áp suất bằng cách nén hỗn hợp.
(c) Thêm xúc tác V2O5.
(d) Tăng nhiệt độ để tốc độ phản ứng
(b), (c).
(a), (b).
(a).
(a), (b), (c), (d).
Cho phương trình hóa học :
Tỉ lệ a : b là
1 : 1
2 : 3
1 : 2
1 : 3.
Cho hai hệ cân bằng sau trong hai bình kín:
C (r) + CO2 (k) 2CO(k); = =172 kJ; (1)
CO (k) + H2O (k) CO2 (k) + H2 (k); = – 41 kJ (2)
Có bao nhiêu điều kiện trong các điều kiện sau đây làm các cân bằng trên chuyển dịch ngược chiều nhau (giữ nguyên các điều kiện khác)?
(1) Tăng nhiệt độ.
(2) Thêm khí CO2 vào.
(3) Tăng áp suất.
(4) Dùng chất xúc tác
(5) Thêm khí CO vào.
4
5
3
2
Cho hệ cân bằng trong một bình kín :
Cân bằng trên chuyển dịch theo chiều thuận khi
tăng nhiệt độ của hệ.
thêm khí NO vào hệ.
giảm áp suất của hệ
thêm chất xúc tác vào hệ
Cho phản ứng : Na2SO3 + KMnO4 + NaHSO4 ® Na2SO4 + MnSO4 + K2SO4 + H2O
Tổng hệ số của các chất (là những số nguyên, tối giản) trong phương trình phản ứng là :
47.
23.
31.
27.
Cho phản ứng : N2(k) + 3H2(k) 2NH3 (k); = -92 kJ. Hai biện pháp đều làm cân bằng chuyển dịch theo chiều thuận là
giảm nhiệt độ và giảm áp suất
tăng nhiệt độ và tăng áp suất
giảm nhiệt độ và tăng áp suất
tăng nhiệt độ và giảm áp suất
Cho các phản ứng sau :
4HCl + MnO2 ® MnCl2 + Cl2 + 2H2O
2HCl + Fe ® FeCl2 + H2
14HCl + K2Cr2O7 ® 2KCl + 2CrCl3 + 3Cl2 + 7H2O
6HCl + 2Al ® 2AlCl3 + 3H2
16HCl + 2KMnO4 ® 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Số phản ứng trong đó HCl thể hiện tính oxi hóa là :
2
4
3
1
Cho cân bằng hoá học: N2 (k) + 3H2 (k) 2NH3 (k); phản ứng thuận là phản ứng toả nhiệt. Cân bằng hoá học không bị chuyển dịch khi
thay đổi nhiệt độ
thay đổi áp suất của hệ
thêm chất xúc tác Fe
thay đổi nồng độ N2
Cho các cân bằng sau
(I) 2HI (k) H2 (k) + I2 (k);
(II) CaCO3 (r) CaO (r) + CO2 (k);
(III) FeO (r) + CO (k) Fe (r) + CO2 (k);
(IV) 2SO2 (k) + O2 (k) 2SO3 (k).
Khi giảm áp suất của hệ, số cân bằng bị chuyển dịch theo chiều nghịch là
4
2
3
1
Cho các phương trình phản ứng sau :
Trong các phản ứng trên, số phản ứng mà ion đóng vai trò chất oxi hóa là
2
4
3
1
Trong bình kín có hệ cân bằng hóa học sau:
Xét các tác động sau đến hệ cân bằng:
(a) Tăng nhiệt độ;
(b) Thêm một lượng hơi nước;
(c) giảm áp suất chung của hệ;
(d) dùng chất xúc tác;
(e) thêm một lượng CO2,
Trong những tác động trên, các tác động làm cân bằng chuyển dịch theo chiều thuận là
(a), (c) và (e).
(a) và (e).
(d) và (e).
(b), (c) và (d).
Cho cân bằng hóa học :
Biết phản ứng thuận là phản ứng thu nhiệt. Tác động nào sau đây vào hệ cân bằng để cân bằng đã cho chuyển dịch theo chiều thuận?
Giảm nhiệt độ
Tăng áp suất
Tăng nồng đột khí CO2
Tăng nhiệt độ
Cho cân bằng hóa học sau: 2NH3 (k) N2 (k) + 3H2 (k). Khi tăng nhiệt độ của hệ thì tỉ khối của hỗn hợp so với H2 giảm. Nhận xét nào sau đây là đúng?
Khi tăng áp suất của hệ, cân bằng chuyển dịch theo chiều thuận
Khi tăng nhiệt độ của hệ, cân bằng chuyển dịch theo chiều thuận
Phản ứng thuận là phản ứng tỏa nhiệt
Khi tăng nồng độ của NH3, cân bằng chuyển dịch theo chiều nghịch
Cho cân bằng sau : H2 (k) + I2 (k) 2HI (k) H >0. Hãy cho biết dãy yếu tố nào sau đây đều làm chuyển dịch cân bằng ?
nhiệt độ, áp suất, nồng độ
nhiệt độ, nồng độ
nhiệt độ, nồng độ và xúc tác
nhiệt độ, áp suất
Thực hiện phản ứng sau trong bình kín:
Lúc đầu nồng độ hơi Br2 là 0,072 mol/l. Sau 2 phút, nồng độ hơi Br2 còn lại là 0,048 mol/l. Tốc độ trung bình của phản ứng tính theo Br2 trong khoảng thời gian trên là
4.mol/(l.s)
8.mol/(l.s)
2.mol/(l.s)
6.mol/(l.s)
Nhiệt phân các muối sau : NH4Cl, (NH4)2CO3, NH4NO3, NH4HCO3. Trường hợp nào xảy ra phản ứng oxi hoá - khử ?
(NH4)2CO3
NH4Cl.
NH4HCO3.
NH4NO3
Cho chất xúc tác MnO2 vào 100 ml dung dịch H2O2, sau 60 giây thu được 3,36 ml khí O2 (ở đktc). Tốc độ trung bình của phản ứng (tính theo H2O2) trong 60 giây trên là
1,0.10-3 mol/(l.s)
2,5.10-4 mol/(l.s).
5,0.10-4 mol/(l.s).
5,0.10-5 mol/(l.s).
Cho Fe (hạt) phản ứng với dung dịch HCl 1M. Thay đổi các yếu tố sau:
(1) Thêm vào hệ một lượng nhỏ dung dịch CuSO4.
(2) Thêm dung dịch HCl 1M lên thể tích gấp đôi.
(3) Nghiền nhỏ hạt sắt thành bột sắt.
(4) Pha loãng dung dịch HCl bằng nước cất lên thể tích gấp đôi.
Có bao nhiêu cách thay đổi tốc độ phản ứng?
1
4
3
2
Xét phản ứng phân hủy N2O5 trong dung môi CCl4 ở 45oC : N2O5 ® N2O4 + O2
Ban đầu nồng độ của N2O5 là 2,33M, sau 184 giây nồng độ của N2O5 là 2,08M. Tốc độ trung bình của phản ứng tính theo N2O5 là
6,80.10-4 mol/(l.s)
2,72.10-3 mol/(l.s).
6,80.10-3 mol/(l.s).
1,36.10-3 mol/(l.s).
Cho phản ứng :
Tổng các hệ số cân bằng (tối giản, có nghĩa) của phản ứng trên là
22
23
28
10
Cho ba mẫu đá vôi (100% CaCO3) có cùng khối lượng: mẫu 1 dạng khối, mẫu 2 dạng viên nhỏ, mẫu 3 dạng bột mịn vào ba cốc đựng cùng thể tích dung dịch HCl (dư, cùng nồng độ, ở điều kiện thường). Thời gian để đá vôi tan hết trong ba cốc tương ứng là t1, t2, t3 giây. So sánh nào sau đây đúng?
Cho cân bằng hoá học :
Cân bằng chuyển dịch theo chiều thuận khi
thêm PCl3 vào hệ phản ứng
tăng nhiệt độ của hệ phản ứng
thêm Cl2 vào hệ phản ứng
tăng áp suất của hệ phản ứng
Cho cân bằng hóa học: H2 (k) + I2 ?(k) 2HI (k); DH > 0.
Cân bằng không bị chuyển dịch khi
giảm áp suất chung của hệ
giảm nồng độ HI
tăng nhiệt độ của hệ
tăng nồng độ H2
Cho phản ứng :
Tổng các hệ số cân bằng (tối giản, có nghĩa) của phản ứng trên là
22
23
28
10