40 câu hỏi
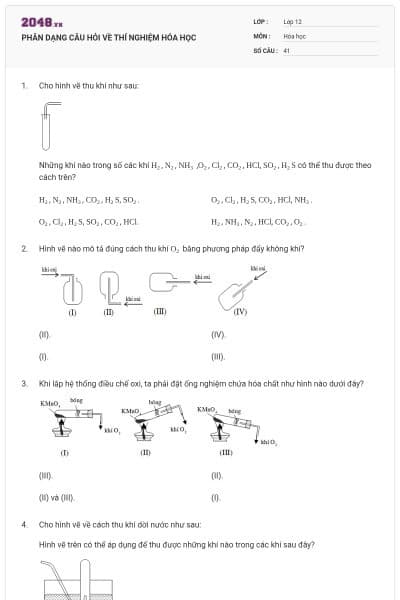
Cấu hình electron lớp ngoài cùng của nguyên tố nhóm VA là
ns2np5
ns2np3
ns2np2
ns2np4
Trong những nhận xét dưới đây, nhận xét nào không đúng?
Nguyên tử nitơ có 2 lớp electron và lớp ngoài cùng có 3 electron
Số hiệu của nguyên tử nitơ bằng 7
3 electron ở phân lớp 2p của nguyên tử nitơ có thể tạo được 3 liên kết cộng hóa trị với các nguyên tử khác
Cấu hình electron của nguyên tử nitơ là 1s22s22p3 và nitơ là nguyên tố p
Phát biểu không đúng là
Nitơ thuộc nhóm VA nên có hóa trị cao nhất là 5
Nguyên tử nitơ có 5 electron ở lớp ngoài cùng thuộc phân lớp 2s và 2p
Nguyên tử nitơ có 3 electron độc thân
Nguyên tử nitơ có khả năng tạo ra ba liên kết cộng hoá trị với nguyên tố khác
Ở nhiệt độ thường, nitơ khá trơ về mặt hoạt động hóa học là do
nitơ có bán kính nguyên tử nhỏ
nitơ có độ âm điện lớn nhất trong nhóm
phân tử nitơ có liên kết ba khá bền
phân tử nitơ không phân cực
Điểm giống nhau giữa N2 và CO2 là
đều không tan trong nước
đều có tính oxi hóa và tính khử
đều không duy trì sự cháy và sự hô hấp
đều gây hiệu ứng nhà kính
Cặp công thức của liti nitrua và nhôm nitrua là
LiN3 và Al3N
Li3N và AlN
Li2N3 và Al2N3
Li3N2 và Al3N2
Chất nào tác dụng với N2 ở nhiệt độ thường
Mg
O2
Na
Li
Khi có sấm chớp, khí quyển sinh ra khí
CO
NO
SO2
CO2
Nitơ phản ứng được với tất cả các chất trong nhóm nào sau đây để tạo ra hợp chất khí?
Li, Mg, Al
H2, O2
Li, H2, Al
O2, Ca, Mg
N2 thể hiện tính khử trong phản ứng với
H2
O2
Li
Mg.
Nitơ thể hiện tính oxi hóa khi tác dụng với chất nào sau đây?
Mg, H2
Mg, O2
H2, O2
Ca, O2
Cho các phản ứng sau:
Trong hai phản ứng trên thì nitơ
chỉ thể hiện tính oxi hóa
chỉ thể hiện tính khử
thể hiện tính khử và tính oxi hóa
không thể hiện tính khử và tính oxi hóa
Trong phòng thí nghiệm, người ta thu khí nitơ bằng phương pháp dời nước vì
N2 nhẹ hơn không khí
N2 rất ít tan trong nước
N2 không duy trì sự sống, sự cháy
N2 hoá lỏng, hóa rắn ở nhiệt độ rất thấp
Trong công nghiệp, người ta thường điều chế N2 từ
amoniac
axit nitric
không khí
amoni nitrat
Trong công nghiệp, N2 được tạo ra bằng cách nào sau đây?
Nhiệt phân muối NH4NO3 đến khối lượng không đổi
Chưng cất phân đoạn không khí lỏng
Phân hủy NH3
Đun nóng Mg với dung dịch HNO3 loãng
Trong công nghiệp, phần lớn lượng nitơ sản xuất ra được dùng để
làm môi trường trơ trong luyện kim, điện tử,...
tổng hợp phân đạm
sản xuất axit nitric
tổng hợp amoniac
Trong những nhận xét dưới đây, nhận xét nào là đúng?
Nitơ không duy trì sự cháy, sự hô hấp và là một khí độc
Vì có liên kết 3 nên phân tử nitơ rất bền và ở nhiệt độ thường nitơ khá trơ về mặt hóa học
Khi tác dụng với kim loại hoạt động, nitơ thể hiện tính khử
Số oxi hóa của nitơ trong các hợp chất và ion AlN, N2O4, NH4+, NO3-, NO2-, lần lượt là -3, +4, -3,+5,+4
Tìm các tính chất không thuộc về khí nitơ?
(a) Hóa lỏng ở nhiệt độ rất thấp (-196oC);
(b) Cấu tạo phân tử nitơ là
(c) Tan nhiều trong nước;
(d) Nặng hơn oxi;
(e) Kém bền, dễ bị phân hủy thành nitơ nguyên tử.
(a), (c), (d).
(a), (b).
(c), (d), (e).
(b), (c), (e)
X là một oxit nitơ, trong đó O chiếm 36,36% về khối lượng. Công thức của X là
NO
NO2
N2O
N2O5
X là một oxit nitơ, trong đó N chiếm 30,43% về khối lượng. Công thức của X là
NO
NO2
N2O.
N2O5
Các hình vẽ sau mô tả các cách thu khí thường được sử dụng khi điều chế và thu khí trong phòng thí nghiệm:
Kết luận nào sau đây đúng?
Hình 3: Thu khí N2, H2 và He
Hình 2: Thu khí CO2, SO2 và NH3
Hình 3: Thu khí N2, H2 và NH3
Hình 1: Thu khí H2, He và HCl
Cho hình vẽ về cách thu khí dời nước như sau:
Hình vẽ trên có thể áp dụng để thu được những khí nào trong các khí sau đây?
O2, N2, H2, CO2
NH3, O2, N2, HCl, CO2
NH3, HCl, CO2, SO2, Cl2
H2, N2, O2, CO2, HCl, H2S
Fe có thể được dùng làm chất xúc tác trong phản ứng điều chế NH3 từ N2 và H2:
Nhận xét nào sau đây là đúng khi nói về vai trò của Fe trong phản ứng trên?
Làm tăng nồng độ các chất trong phản ứng trên
Làm cân bằng chuyển dịch theo chiều thuận
Làm tăng tốc độ phản ứng.
Làm tăng hiệu suất phản ứng
Cho cân bằng hoá học:
Phản ứng thuận là phản ứng toả nhiệt. Cân bằng hoá học không bị chuyển dịch khi
thay đổi áp suất của hệ
thay đổi nồng độ N2
thay đổi nhiệt độ
thêm chất xúc tác Fe
Cho phản ứng:
Trong các yếu tố sau đây: (1) áp suất; (2) nhiệt độ; (3) nồng độ; (4) chất xúc tác, có mấy yếu tố ảnh hưởng đến cân bằng hóa học trên?
1
2
4
3
Cho phản ứng:
Hiệu suất của phản ứng giữa N2 và H2 tạo thành NH3 bị giảm nếu
giảm áp suất, tăng nhiệt độ
giảm áp suất, giảm nhiệt độ
tăng áp suất, tăng nhiệt độ
tăng áp suất, giảm nhiệt độ
Quá trình sản xuất amoniac trong công nghiệp dựa trên phản ứng thuận nghịch sau:
Khi phản ứng đạt tới trạng thái cân bằng, những thay đổi nào dưới đây làm cho cân bằng chuyển dịch theo chiều thuận: (1) tăng nhiệt độ, (2) tăng áp suất, (3) thêm chất xúc tác, (4) giảm nhiệt độ, (5) lấy NH3 ra khỏi hệ.
(2), (3), (4).
(1), (2), (3), (5).
(2), (4), (5)
(2), (3), (4), (5).
Cho biết phản ứng
là phản ứng toả nhiệt. Cho một số yếu tố: (1) tăng áp suất, (2) tăng nhiệt độ, (3) tăng nồng độ N2 và H2, (4) tăng nồng độ NH3, (5) tăng lượng xúc tác. Các yếu tố làm tăng hiệu suất của phản ứng nói trên là
(2), (4).
(1), (3).
(2), (5).
(3), (5).
Trong phản ứng tổng hợp amoniac:
Để tăng hiệu suất phản ứng tổng hợp phải
giảm nhiệt độ và áp suất
tăng nhiệt độ và áp suất
tăng nhiệt độ và giảm áp suất
giảm nhiệt độ vừa phải và tăng áp suất
Cho cân bằng hóa học (trong bình kín) sau:
Trong các yếu tố:
(1) Thêm một lượng N2 hoặc H2;
(2) Thêm một lượng NH3;
(3) Tăng nhiệt độ của phản ứng;
(4) Tăng áp suất của phản ứng;
(5) Dùng thêm chất xúc tác.
Có bao nhiêu yếu tố làm cho tỉ khối của hỗn hợp khí trong bình so với H2 tăng lên?
3
5
4
2
Phát biểu không đúng là
Trong điều kiện thường, NH3 là khí không màu, mùi khai
Khí NH3 nặng hơn không khí
Khí NH3 dễ hoá lỏng, tan nhiều trong nước
Liên kết giữa N và 3 nguyên tử H là liên kết cộng hoá trị có cực
Một lít nước ở 20oC hoà tan được bao nhiêu lít khí amoniac?
200
400
500
800
Cho hình vẽ mô tả thí thí nghiệm như sau:
Hình vẽ mô tả thí nghiệm để chứng minh
tính tan nhiều trong nước của NH3
tính bazơ của NH3
tính tan nhiều trong nước và tính bazơ của NH3
tính khử của NH3
Tính bazơ của NH3 do
trên N còn cặp electron tự do
phân tử có 3 liên kết cộng hóa trị phân cực
NH3 tan được nhiều trong nước
NH3 tác dụng với nước tạo NH4OH
Dung dịch amoniac trong nước có chứa
NH4+, NH3
NH4+, NH3, H+.
NH4+, OH-.
NH4+, NH3, OH-.
Trong dung dịch amoniac là một bazơ yếu là do:
Amoniac tan nhiều trong nước
Phân tử amoniac là phân tử có cực
Khi tan trong nước, amoniac kết hợp với nước tạo ra các ion NH4+ và OH-.
Khi tan trong nước, chỉ một phần nhỏ các phân tử amoniac kết hợp với ion H+ của nước tạo ra các ion NH4+ và OH-.
Khí amoniac làm giấy quỳ tím ẩm
chuyển thành màu đỏ
chuyển thành màu xanh
không đổi màu
mất màu.
Hiện tượng xảy ra khi cho giấy quỳ khô vào bình đựng khí amoniac là
Giấy quỳ chuyển sang màu đỏ
Giấy quỳ chuyển sang màu xanh
Giấy quỳ mất màu
Giấy quỳ không chuyển màu
Nhúng 2 đũa thuỷ tinh vào 2 bình đựng dung dịch HCl đặc và NH3 đặc. Sau đó đưa 2 đũa lại gần nhau thì thấy xuất hiện
khói màu trắng
khói màu tím
khói màu nâu
khói màu vàng
Tìm phát biểu đúng:
NH3 là chất oxi hóa mạnh
NH3 có tính khử mạnh, tính oxi hóa yếu
NH3 là chất khử mạnh
NH3 có tính oxi hóa mạnh, tính khử yếu