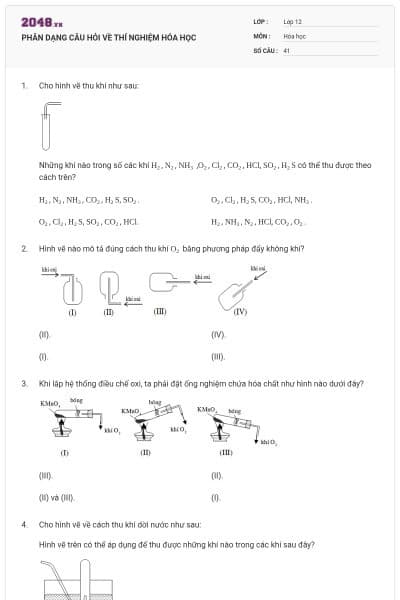
59 câu hỏi
Cho giá trị độ âm điện của các nguyên tố: F (3,98); O (3,44); C (2,55); H (2,20); Na (0,93). Hợp chất nào sau đây là hợp chất ion
H2O
NaF
CO2
CH4
Cấu hình electron của ion Cu2+ và Cr3+ lần lượt là
[Ar]3d74s2 và [Ar]3d14s2
[Ar]3d9 và [Ar]3d3
[Ar]3d9 và [Ar]3d14s2
[Ar]3d74s2 và [Ar]3d3
Cation R+ có cấu hình electron 1s22s22p63s23p6. Vị trí của nguyên tố R trong bảng tuần hoàn các nguyên tố hóa học là
chu kì 3, nhóm VIIIA
chu kì 4, nhóm IIA
chu kì 3, nhóm VIIA
chu kì 4, nhóm IA
Chất nào sau đây là hợp chất ion
K2O.
HCl
CO2
SO2
X, Y, Z là những nguyên tố có số điện tích hạt nhân là 9, 19, 8. Nếu các cặp X và Y; Y và Z; X và Z tạo thành liên kết hoá học thì các cặp nào sau đây có liên kết cộng hoá trị phân cực
Cặp X và Y, cặp Y và Z
Cặp X và Z
Cặp X và Y, cặp X và Z
Cả 3 cặp
Ở trạng thái cơ bản, nguyên tử của nguyên tố X có 4 electron ở lớp L (lớp thứ hai). Số proton có trong nguyên tử X là
8.
5
6
7
Có các nhận định
(1) S2- < Cl- < Ar < K+ là dãy được sắp xếp theo chiều tăng dần bán kính nguyên tử.
(2) Có 3 nguyên tố mà nguyên tử của nó ở trạng thái cơ bản có cấu hình electron ở lớp vỏ ngoài cùng là 4s1.
(3) Cacbon có hai đồng vị, Oxi có 3 đồng vị. Số phân tử CO2 được tạo ra từ các đồng vị trên là 12.
(4) Các nguyên tố: F, O, S, Cl đều là những nguyên tố p.
(5) Nguyên tố X tạo được hợp chất khí với hiđro có dạng HX. Vậy X tạo được oxit cao X2O7.
Số nhận định không chính xác là
5
4
2
3
Bán kính nguyên tử của các nguyên tố: 3Li, 8O, 9F, 11Na được xếp theo thứ tự tăng dần từ trái sang phải là
Li, Na, O, F
F, Na, O, Li
F, O, Li, Na
F, Li, O, Na
Phát biểu nào sau đây là sai
Trong một chu kì, bán kính nguyên tử kim loại nhỏ hơn bán kính nguyên tử phi kim.
Các kim loại thường có ánh kim do các electron tự do phản xạ ánh sáng nhìn thấy được
Nguyên tử kim loại thường có 1, 2 hoặc 3 electron ở lớp ngoài cùng
Các nhóm A bao gồm các nguyên tố s và nguyên tố p
Phát biểu nào sau đây là đúng
Trong tất cả các nguyên tử, số proton bằng số nơtron.
Những nguyên tử có cùng số khối thuộc cùng một nguyên tố hóa học
Hạt nhân của tất cả các nguyên tử đều có proton và nơtron
Nguyên tố M có Z = 11 thuộc chu kì 3 nhóm IA
Tổng số hạt electron, proton, nơtron trong nguyên tử nguyên tố kim loại X bằng 34. Tổng số electron trên các phân lớp p của nguyên tử nguyên tố Y là 11. Nhận xét nào sau đây không đúng
Hợp chất tạo bởi X và Y có trong khoáng vật xinvinit
Đơn chất Y tác dụng với O2 ở nhiệt độ thường
X được điều chế bằng phương pháp điện phân nóng chảy.
Hợp chất tạo bởi X và Y là hợp chất ion
Liên kết hóa học trong phân tử thuộc loại liên kết
hiđro
ion
cộng hóa trị có cực
cộng hóa trị không cực
Khi so sánh NH3 với NH4+, phát biểu không đúng là
Trong NH3 và NH4+, nitơ đều có số oxi hóa -3
Phân tử NH3 và ion NH4+ đều chứa liên kết cộng hóa trị
Trong NH3 và NH4+, nitơ đều có cộng hóa trị 3
NH3 có tính bazơ, NH4+ có tính axit
Liên kết hóa học giữa các nguyên tử trong phân tử H2O là liên kết
cộng hoá trị không phân cực
ion
cộng hoá trị phân cực.
hiđro
Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y cũng có electron ở mức năng lượng 3p và có một electron ở lớp ngoài cùng. Nguyên tử X và Y có số electron hơn kém nhau là 2. Nguyên tố X, Y lần lượt là
khí hiếm và kim loại
phi kim và kim loại
kim loại và khí hiếm.
kim loại và kim loại
Ion X2+ có cấu hình electron ở trạng thái cơ bản . Nguyên tố X là
Ne (Z = 10)
Mg (Z = 12).
Na (Z = 11).
O (Z = 8).
Cấu hình electron của nguyên tử Ca (Z= 20) ở trạng thái cơ bản là
1s22s22p63s23p63d2.
1s22s22p63s23p64s1
1s22s22p63s23p64s2
1s22s22p63s23p63d14s1
Oxit cao nhất của nguyên tố R ứng với công thức RO2. Trong hợp chất khí của nó với hiđro, R chiếm 75% về khối lượng. Khẳng định nào sau đây là sai
Lớp ngoài cùng của nguyên tử R (ở trạng thái cơ bản) có 4 electron
Phân tử RO2 là phân tử phân cực
Độ âm điện của nguyên tử nguyên tố R lớn hơn độ âm điện của nguyên tử nguyên tố hiđro.
Liên kết hóa học giữa các nguyên tử trong phân tử RO2 là liên kết cộng hóa trị có cực
Cho các nguyên tố: K (Z = 19), N (Z = 7), Si (Z = 14), Mg (Z = 12). Dãy gồm các nguyên tố được sắp xếp theo chiều giảm dần bán kính nguyên tử từ trái sang phải là
K, Mg, Si, N
Mg, K, Si, N
K, Mg, N, Si
N, Si, Mg, K
Mg có 3 đồng vị 24Mg, 25Mg và 26Mg. Clo có 2 đồng vị 35Cl và 37Cl. Có bao nhiêu loại phân tử MgCl2 khác tạo nên từ các đồng vị của 2 nguyên tố đó
6
9
12
10
Phát biểu nào dưới đây không đúng
Vỏ nguyên tử được cấu thành bởi các hạt electron
Với mọi nguyên tử, khối lượng nguyên tử bằng số khối
Hạt nhân nguyên tử được cấu thành từ các hạt proton và nơtron
Nguyên tử được cấu thành từ các hạt cơ bản là proton, nơtron và electron
Cấu hình electron của ion X2+ là 1s22s22p63s23p63d6. Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tố X thuộc
chu kì 4, nhóm VIIIB
chu kì 4, nhóm VIIIA
chu kì 3, nhóm VIB
chu kì 4, nhóm IIAD. chu kì 4, nhóm IIA
Dãy gồm các chất trong phân tử chỉ có liên kết cộng hoá trị phân cực là
O2, H2O, NH3
HCl, O3, H2S.
H2O, HF, H2S
HF, Cl2, H2O
Một ion M3+ có tổng số hạt proton, nơtron, electron là 79, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 19. Cấu hình electron của nguyên tử M là
[Ar]3d54s1
[Ar]3d64s2
[Ar]3d64s1
[Ar]3d34s2
Cho dãy các chất: N2, H2, NH3, NaCl, HCl, H2O. Số chất trong dãy mà phân tử chỉ chứa liên kết cộng hóa trị không cực là
2
4
5
3
Dãy các nguyên tố sắp xếp theo chiều tăng dần tính phi kim từ trái sang phải là
P, N, O, F
N, P, O, F
N, P, F, O
P, N, F, O
Nhận định nào sau đây đúng khi nói về 3 nguyên tử :
X, Y thuộc cùng một nguyên tố hoá học
X và Z có cùng số khối
X và Y có cùng số nơtron
X, Z là 2 đồng vị của cùng một nguyên tố hoá học
Liên kết hóa học giữa các nguyên tử trong phân tử HCl thuộc loại liên kết
hiđro.
ion
cộng hóa trị có cực
cộng hóa trị không cực
Nguyên tử R tạo được cation R+. Cấu hình electron ở phân lớp ngoài cùng của R+ (ở trạng thái cơ bản) là 2p6. Tổng số hạt mang điện trong nguyên tử R là
10
11
22
23
Nguyên tố Y là phi kim thuộc chu kì 3, có công thức oxit cao nhất là YO3. Nguyên tố Y tạo với kim loại M hợp chất có công thức MY, trong đó M chiếm 63,64% về khối lượng. Kim loại M là
Zn
Cu
Mg
Fe
Cho độ âm điện của các nguyên tố: O (3,5), Na (0,9), Mg (1,2), Cl (3,0). Trong các phân tử sau, phân tử nào có độ phân cực lớn nhất
NaCl
Cl2O
MgO
MgCl2
X và Y là hai nguyên tố thuộc cùng một chu kỳ, hai nhóm A liên tiếp. Số proton của nguyên tử Y nhiều hơn số proton của nguyên tử X. Tổng số hạt proton trong nguyên tử X và Y là 33. Nhận xét nào sau đây về X, Y là đúng
Độ âm điện của X lớn hơn độ âm điện của Y
Đơn chất X là chất khí ở điều kiện thường
Lớp ngoài cùng của nguyên tử Y (ở trạng thái cơ bản) có 5 electron
Phân lớp ngoài cùng của nguyên tử X (ở trạng thái cơ bản) có 4 electron
Ở trạng thái cơ bản:
- Phân lớp electron ngoài cùng của nguyên tử nguyên tố X là np2n+1.
- Tổng số electron trên các phân lớp p của nguyên tử nguyên tố Y là 7.
- Số hạt mang điện trong nguyên tử nguyên tố Z nhiều hơn số hạt mang điện trong nguyên tử nguyên tố X là 20 hạt. Nhận xét nào sau đây là sai
Độ âm điện giảm dần theo thứ tự X, Y, Z.
Nguyên tố X và Y thuộc 2 chu kì kế tiếp
Oxit và hiđroxit của Y có tính lưỡng tính
Số oxi hóa cao nhất của X trong hợp chất là +7.
Khi nói về số khối, điều khẳng định nào sau đây luôn đúng ? Trong nguyên tử, số khối
bằng tổng số các hạt proton và nơtron
bằng tổng khối lượng các hạt proton và nơtron.
bằng tổng các hạt proton, nơtron và electron
bằng nguyên tử khối
Dãy gồm các ion X+, Y- và nguyên tử Z đều có cấu hình electron 1s22s22p6 là
Ở trạng thái cơ bản, cấu hình electron của nguyên tử Na (Z = 11) là
1s22s22p53s2
1s22s22p43s1
1s22s22p63s2
1s22s22p63s1
Electron thuộc lớp nào sau đây liên kết kém chặt chẽ với hạt nhân nhất
lớp K
lớp L.
lớp N
lớp M
Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tố X ở nhóm IIA, nguyên tố Y ở nhóm VA. Công thức của hợp chất tạo thành 2 nguyên tố trên có dạng là
X3Y2.
X2Y3
X5Y2
X2Y5
Liên kết hóa học giữa các nguyên tử trong phân tử NH3 là liên kết
cộng hóa trị phân cực
cộng hóa trị không cực
ion
hiđro.
Những câu sau đây, câu nào sai
Có ba loại liên kết hóa học giữa các nguyên tử trong phân tử hoặc tinh thể là : Liên kết ion, liên kết cộng hoá trị và liên kết kim loại
Các nguyên tử liên kết với nhau thành phân tử để chuyển sang trạng thái có năng lượng thấp hơn
Trong chu kì, các nguyên tố được xếp theo chiều số hiệu nguyên tử tăng dần
Nguyên tử của các nguyên tố cùng chu kỳ có số electron bằng nhau
Cấu hình electron ở trạng thái cơ bản của nguyên tử nguyên tố X có tổng số electron trong các phân lớp p là 8. Nguyên tố X là
O (Z=8).
Cl (Z=17).
Al (Z=13).
Si (Z=14).
Một nguyên tử của nguyên tố X có tổng số hạt proton, nơtron, electron là 52 và có số khối là 35. Số hiệu nguyên tử của nguyên tố X là
23
15
17
18
Các nguyên tố từ Li đến F, theo chiều tăng của điện tích hạt nhân thì
Bán kính nguyên tử tăng, độ âm điện giảm
Bán kính nguyên tử và độ âm điện đều giảm.
Bán kính nguyên tử giảm, độ âm điện tăng
Bán kính nguyên tử và độ âm điện đều tăng
Nguyên tử X và Y có cấu hình electron ngoài cùng lần lượt là 3sx và 3py. Biết phân lớp 3s của hai nguyên tử hơn kém nhau 1 electron. Hợp chất của X và Y có dạng X2Y. Cấu hình electron lớp ngoài cùng của X và Y lần lượt là
3s1 và 3s23p2.
3s2 và 3s23p1
3s2 và 3s23p2
3s1 và 3s23p4
Hai nguyên tố X và Y cùng một chu kì trong bảng tuần hoàn các nguyên tố hóa học, X thuộc nhóm IIA, Y thuộc nhóm IIIA (). Phát biểu nào sau đây đúng
Kim loại X không khử được ion Cu2+ trong dung dịch
Hợp chất với oxi của X có dạng X2O7A. Kim loại X không khử được ion Cu2+ trong dung dịch
Trong nguyên tử nguyên tố X có 25 proton.
Ở nhiệt độ thường X không khử được H2O
Số proton và số nơtron có trong một nguyên tử nhôm () lần lượt là
13 và 13
13 và 15
12 và 14
13 và 14
Có 2 nguyên tố X (Z = 19); Y (X = 17) hợp chất tạo bởi X và Y có công thức và kiểu liên kết là
XY, liên kết ion
X2Y, liên kết ion
XY, liên kết cộng hóa trị có cực
XY2, liên kết cộng hóa trị có cực
Ion Xn+ có cấu hình electron là 1s22s22p6, X là nguyên tố thuộc nhóm. Số nguyên tố hóa học X thỏa mãn với điều kiện trên là
2
3
4
5
Các kim loại X, Y, Z có cấu hình electron nguyên tử lần lượt là : 1s22s22p63s1; 1s22s22p63s2; 1s22s22p63s23p1. Dãy gồm các kim loại xếp theo chiều tăng dần tính khử từ trái sang phải là
Z, Y, X
X, Y, Z
Z, X, Y
Y, Z, X
Hạt nhân nguyên tử R có điện tích bằng 20+. Nguyên tố R ở vị trí nào trong bảng tuần hoàn
Chu kì 3, nhóm IIB
Chu kì 3, nhóm IIA
Chu kì 4, nhóm IIA
Chu kì 4, nhóm IIIA
Hợp chất trong phân tử có liên kết ion là
H2O.
HCl
NH4Cl
NH3
Những câu sau đây, câu nào sai
Trong chu kì, các nguyên tố được xếp theo chiều số hiệu nguyên tử tăng dần
Có ba loại liên kết hóa học giữa các nguyên tử trong phân tử hoặc tinh thể là : Liên kết ion, liên kết cộng hoá trị và liên kết kim loại
Các nguyên tử liên kết với nhau thành phân tử để chuyển sang trạng thái có năng lượng thấp hơn
Nguyên tử của các nguyên tố cùng chu kỳ có số electron bằng nhau
Oxi có 3 đồng vị . Cacbon có hai đồng vị là:. Hỏi có thể có bao nhiêu loại phân tử khí cacbonic được tạo thành giữa cacbon và oxi
11
12
13
14
Trong một nhóm A (phân nhóm chính), trừ nhóm VIIIA (phân nhóm chính nhóm VIII), theo chiều tăng của điện tích hạt nhân nguyên tử thì
tính kim loại tăng dần, bán kính nguyên tử giảm dần
độ âm điện giảm dần, tính phi kim tăng dần
tính kim loại tăng dần, độ âm điện tăng dần
tính phi kim giảm dần, bán kính nguyên tử tăng dần
Trong một nhóm A (phân nhóm chính), trừ nhóm VIIIA (phân nhóm chính nhóm VIII), theo chiều tăng của điện tích hạt nhân nguyên tử thì
tính kim loại tăng dần, bán kính nguyên tử giảm dần
độ âm điện giảm dần, tính phi kim tăng dần
tính kim loại tăng dần, độ âm điện tăng dần
tính phi kim giảm dần, bán kính nguyên tử tăng dần
Các chất mà phân tử không phân cực là
HBr, CO2, CH4
Cl2, CO2, C2H2
NH3, Br2, C2H4
HCl, C2H2, Br2
Hãy cho biết lớp N có thể chứa tối đa bao nhiêu electron
2
8
18
32
Tính chất axit của dãy các hiđroxit : H2SiO3, H2SO4, HClO4 biến đổi như thế nào
Tăng
Giảm
Không thay đổi
không tuân theo quy luật
Mức độ phân cực của liên kết hoá học trong các phân tử được sắp xếp theo thứ tự giảm dần từ trái sang phải là
HCl, HBr, HI
HI, HBr, HCl
HI, HCl, HBr
HBr, HI, HCl