Đề thi thử Tốt nghiệp THPT 2025 - Cấu trúc mới - Môn Hóa Học - Đề 17
40 câu hỏi
Kim loại nào sau đây dẫn điện tốt hơn Fe nhưng lại kém hơn Cu?
Au.
Cr.
Al.
Ag.
Người ta thường bảo quản kim loại kiềm bằng cách nào sau đây?
Ngâm trong giấm.
Ngâm trong ethanol.
Ngâm trong nước.
Ngâm trong dầu hỏa.
Cryolite (còn gọi là băng thạch) có công thức phân tử Na3AlF6, được thêm vào Al2O3 trong quá trình điện phân Al2O3 nóng chảy để sản xuất aluminium. Cryolite không có tác dụng nào sau đây?
Làm tăng độ dẫn điện của Al2O3 nóng chảy.
Làm giảm nhiệt độ nóng chảy của Al2O3.
Tạo lớp ngăn cách để bảo vệ Al nóng chảy.
Bảo vệ điện cực khỏi bị ăn mòn.
Chất tác dụng với H2 tạo thành sorbitol là
Saccharose.
Tinh bột.
Glucose.
Cellulose.
Dung dịch amino acid nào sau đây làm quỳ tím chuyển sang màu xanh?
Glycine.
Alanine.
Lysine.
Glutamic acid.
Khi hydrogen hóa hoàn toàn 1 mol chất béo có CTPT là C55H102O6 (được tạo từ 2 gốc acid béo thường gặp khác nhau) thì số mol H2 cần dùng là
3 mol.
1 mol.
2 mol.
1,5 mol.
Cho sơ đồ tách chất như sau:
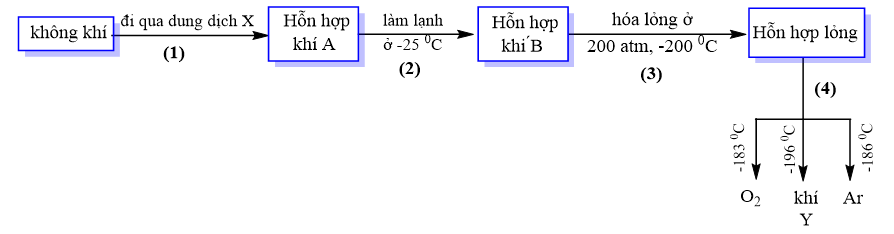
Phát biểu nào sau đây là sai?
Dung dịch X trong quá trình (1) có thể là nước vôi trong hoặc barium hydroxide để loại bỏ khí carbonic.
Quá trình (2) là quá trình loại bỏ hơi nước.
Quá trình (4) dùng phương pháp chưng cất phân đoạn hỗn hợp lỏng để tách các khí.
Phần lớn khí Y điều chế theo sơ đồ trên được dùng để sản xuất phân NPK.
Dãy các chất nào dưới đây đều phản ứng được với Cu(OH)2 ở điều kiện thường?
Ethylene glycol, glycerol và ethyl alcohol.
Glucose, glycerol và saccharose.
Glucose, glycerol và methyl acetate.
Glycerol, glucose và ethyl acetate.
Cho dung dịch AgNO3 vào dung dịch chất X, thu được kết tủa tan một phần trong nitric acid dư. Chất X là
FeCl3.
Cu(NO3)2.
NaNO3.
FeCl2.
X là isopropyl formate, X có trong cà phê Arabica. Chất Y có công thức phân tử C4H6O4. Khi thủy phân Y trong môi trường acid thu được 1 alcohol và 1 carboxylic acid.
Trong các phát biểu sau đây:
(a) Công thức cấu tạo của X là HCOOCH(CH3)2.
(b) Có 3 đồng phân ester khác cùng công thức phân tử với X.
(c) Chất Y có hai công thức cấu tạo phù hợp.
(d) X và Y đều là ester no, mạch hở.
(e) Cả hai chất X, Y đều làm tác dụng hydrogen có xúc tác ở điều kiện thích hợp.
Số phát biểu đúng là
2.
3.
4.
5.
Cho các phản ứng hóa học sau:
(a) Poly(vinyl acetate) bị thủy phân trong môi trường kiềm.
(b) Polyisoprene tham gia phản ứng cộng với hydrogen.
(c) Nhiệt phân polystyrene.
(d) Thủy phân cellulose trong môi trường acid.
(e) Quá trình lưu hóa cao su xảy ra khi đun nóng cao su với sulfur.
Số phản ứng giữ nguyên mạch polymer là bao nhiêu?
2.
3.
4.
5.
Cho các phát biểu sau:
(a) Phức chất có thể mang điện tích hoặc không mang điện tích.
(b) Các phức chất mà nguyên tử trung tâm tạo được 4 liên kết sigma () với các phối tử luôn có dạng hình học tứ diện.
(c) Giống như phân tử ammonia (NH3), phân tử methylamine (CH3NH2) cũng có thể đóng vai trò phối tử do có cặp electron hoá trị riêng.
(d) Các anion , , đều có thể trở thành phối từ trong phức chất vì đều có cặp electron hoá trị riêng.
Số phát biểu đúng là
1.
2.
3.
4.
Cho các nhận xét sau:
(1). “Nước đá khô” được dùng làm chất bảo quản hoa, quả, thực phẩm có thành phần chính là H2O.
(2). Phenol là chất rắn không màu, tan nhiều trong nước lạnh.
(3). Dung dịch formon được dùng để ngâm mẫu động vật (làm tiêu bản) chứa HCHO có nồng độ 37 - 40%.
(4). Thuỷ phân ethyl acetate trong môi trường acid, để nguội hỗn hợp sau phản ứng tách thành hai lớp.
(5). Khi bị suy nhược cơ thể, bệnh nhân thường được truyền dung dịch glucose 5% để nhanh phục hồi.
(6). Các amino acid Gly, Ala, Lys là chất rắn, tan tốt trong nước tạo thành dung dịch làm đổi màu quỳ tím.
Số nhận xét đúng là
4.
5.
3.
6.
Bốn chất sau đây có cùng khối lượng mol nhưng có nhiệt độ sôi khác nhau:
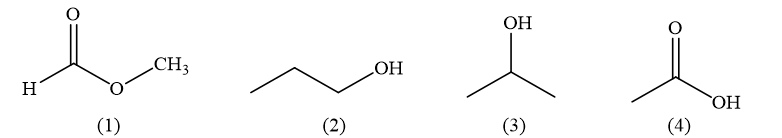
Sự sắp xếp nhiệt độ sôi theo thứ tự tăng dần của các chất là
(1); (3); (2); (4).
(3); (1); (2); (4).
(2); (1); (3); (4).
(4); (3); (2); (1).
Tùy vào bậc alcohol mà cơ chế phản ứng ester sẽ khác nhau ở giai đoạn tạo carbocation (giai đoạn quyết định tốc độ phản ứng).
Cho 2 quá trình hình thành carbocation trong phản ứng ester hóa như sau:
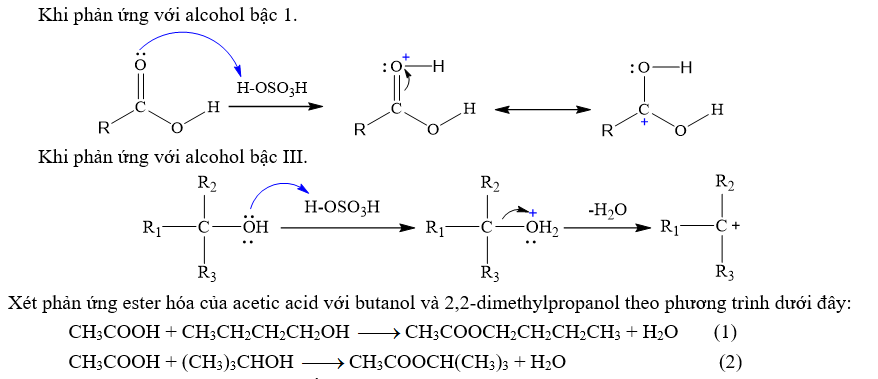
Các phản ứng thực hiện trong cùng điều kiện thí nghiệm.
Phát biểu nào sau đây là đúng?
Phương trình (1) hình thành carbocation bậc III.
Phương trình (2) hình thành carbocation kém bền và có bậc thấp hơn phương trình (1).
Tốc độ phản ứng (2) nhanh hơn phản ứng (1) (xét trong cùng điều kiện thí nghiệm).
Carbocation có bậc càng cao thì càng kém bền.
Trong phản ứng của aldehyde với LiAlH4 thì aldehyde thể hiện tính chất nào sau đây?
Tính acid
Tính oxi hóa.
Tính base.
Tính khử.
Trường hợp nào sau đây có xảy ra phản ứng hoá học?
Nhúng thanh Cu vào dung dịch NaCl 0,1 M.
Nhúng thanh Al vào dung dịch MgCl2 0,1 M.
Nhúng thanh Ag vào dung dịch FeSO4 0,1 M.
Nhúng thanh Cu vào dung dịch AgNO3 0,1 M.
Kim loại nào sau đây không tan trong dung dịch H2SO4 đặc, nguội?
Zn.
Cu.
Al.
Mg.
a. Trong 2 mẫu polymer thì mẫu polyethylene B được tổng họp dưới tác dụng của các chất xúc tác Ziegler- Nattan.
b. Mẫu polythene A có độ phân nhánh ít hơn mẫu polythene B.
c. Độ polymer hóa của hai mẫu polyethylene A và B đều gần bằng 7143.
d. Số mắt xích trong 1 cm3 mẫu B sẽ nhỏ hơn 2.1022 mắt xích.
a. Nhiệt độ sôi tăng dần từ F2 đến I2 là do kích thước và khối lượng phân tử tăng dần làm tương tác Van der Waals tăng dần.
b. Độ dài liên kết tăng dần từ F2 đến I2 là do bán kính các nguyên tử giảm dần từ F đến I.
c. Liên kết cộng hóa trị trong các phân tử F2 đến I2 đều là liên kết σ được hình thành bởi sự lai hóa của 2 orbital p trong cùng phân lớp.
d. Cho biết Eb (H-Cl) = 431 kJ/mol và Eb (H-F) = 565 kJ/mol. Trong 2 phương trình phản ứng:
H2 (g) + Cl2 (g)2HCl(g) (1) và H2 (g) + F2 (g) 2HF(g) (2) thì phản ứng số (2) diễn ra thuận lợi hơn.
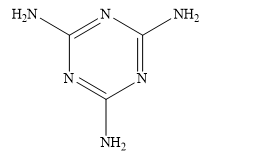
a. Hợp chất (B) là calcium carbide.
b. Tổng số nguyên tử trong muối (M) là 5.
c. Khi cho khí (Y) tác dụng với dung dịch HBr theo tỷ lệ 1 : 1 thì chỉ thu được một sản phẩm duy nhất.
d. Công thức cấu tạo của Q có dạng như sau:
a. Phân tử aldehyde formic có cấu tạo phẳng là do phân tử carbon ở trạng thái lai hóa sp2
b. Dung dịch bão hòa của aldehyde formic trong alcohol (có nồng độ 37 - 40%) được gọi là formalin.
c. Aldehyde formic tan rất tốt trong nước.
d. Tương tác Van der Waals trong phân tử aldehyde formic bền hơn trong phân tử methane.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Để tính tốc độ ăn mòn của kim loại, người ta sử dụng đại lượng CPR (tốc độ thâm nhập ăn mòn theo TCVN 2223-77) được tính theo CT sau: \[CPR = \frac{{K.A.i}}{{n.p}}\] (đơn vị là mpy : milimeter past year)
Trong đó: K là hằng số A là khối lượng nguyên tử của kim loại bị ăn mòn
n là số electron trao đổi p là khối lượng riêng của kim loại (g/cm3)
i là mật độ dòng điện ăn mòn (µA/cm2).
Hãy tính tốc độ ăn mòn theo mpy của kim loại iron trong citric acid để tạo thành ion Fe2+ với mật độ dòng điện ăn mòn là 1,15.10-5 A/cm2. Cho biết K = 0,13 và pFe = 7,9 g/cm3. (làm tròn đến hàng phần trăm)
Một peptide có công thức cấu tạo như sau:
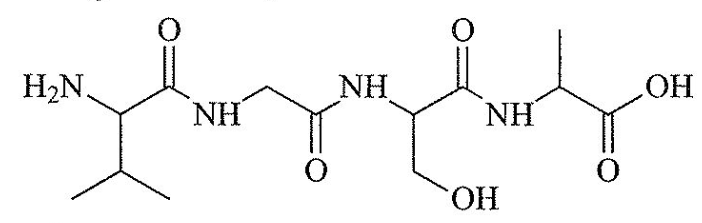
Có bao nhiêu liên kết peptide có trong phân tử peptide trên?
Cho các chất: CuO, Na, NaOH, K2CO3, CH3OH. Có bao nhiêu chất tác dụng được với dung dịch HCOOH ở điều kiện thích hợp?
Cho các phát biểu:
(1) Do ở trạng thái lỏng nên thuỷ ngân (Hg) được sử dụng làm nhiệt kế.
(2) Phương pháp điện phân được dùng để tinh luyện kim loại đồng.
(3) Tất cả các kim loại đều bị oxi hoá bởi oxygen trong không khí.
(4) Việc tái chế thép làm giảm lượng CO2 thải ra môi trường so với sản xuất từ quặng.
(5) Khi nhiệt độ tăng, độ dẫn điện của kim loại sẽ tăng là do tốc độ di chuyển của electron tăng.
Có nhiêu phát biểu là đúng?
Khi cho KOH rắn (M=56g/mol) hòa tan vào nước sẽ giải phóng một nhiệt lượng làkJ/mol. Người ta thêm từ từ KOH rắn vào bình cầu cách nhiệt được khuấy liên tục ở 25 0C. Tính pH của dung dịch khi nhiệt độ trong dung dịch đạt đến 26 0C, chấp nhận rằng nhiệt dung riêng và khối lượng riêng của dung dịch sau phản ứng giống như nước cất (Cho nhiệt dung riêng của nước là = 4,184 J/g/ 0C và khối lượng riêng của nước là 1g/cm³, làm tròn đáp án đến hàng phần mười)
Các khoáng chất Y1, Y2 và Y3 là các tinh thể trong suốt, không hút ẩm, đều là muối ngậm nước của cùng một kim loại hóa trị II và một gốc acid. Khi nung đến trên 200 0C, tất cả chúng đều chuyển thành chất Z, cũng tồn tại ở dạng khoáng tự nhiên. Khi hòa tan 10 gam Y1 và 10 gam Y3 vào 100 gam nước, thu được dung dịch Z có nồng độ 10%. Hòa tan từ từ 26,75 gam Y2 theo từng lượng nhỏ vào 100 gam nước tạo thành dung dịch bão hòa Z ở 25 0C, khi trộn lẫn dung dịch này với dung dịch BaCl2 dư thu được 29,125 gam kết tủa trắng muối sulfate. Bằng cách đun cẩn thận Y1 đến 63 0C có thể thu được Y2, khối lượng bã rắn sau khi nung chỉ còn lại 85,60% so với ban đầu. Tổng số phân tử H2O trong công thức tinh thể của 3 loại tinh trên là bao nhiêu?








