Đề thi giữa kì 2 Hóa 10 Cánh diều có đáp án ( Đề 1)
26 câu hỏi
A. Phần trắc nghiệm (7 điểm)
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 12. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Số oxi hóa của aluminium trong Al, Al2O3 lần lượt là
0, +2.
0, +3.
+3, 0.
0, -3.
Dấu hiệu để nhận biết một phản ứng oxi hóa – khử là dựa trên sự thay đổi đại lượng nào sau đây của nguyên tử?
Khối lượng nguyên tử.
Số oxi hóa.
Số hiệu nguyên tử.
Số khối.
Phản ứng thu nhiệt là
phản ứng hấp thụ năng lượng dưới dạng nhiệt.
phản ứng giải phóng năng lượng dưới dạng nhiệt.
phản ứng cung cấp nhiệt cho môi trường.
phản ứng làm nhiệt độ môi trường tăng lên.
Biến thiên enthalpy chuẩn của phản ứng là
nhiệt lượng toả ra của phản ứng ở điều kiện áp suất không đổi.
nhiệt lượng thu vào của phản ứng ở điều kiện áp suất không đổi.
nhiệt lượng toả ra hoặc thu vào của phản ứng ở điều kiện áp suất không đổi.
nhiệt lượng toả ra hoặc thu vào của phản ứng ở điều kiện chuẩn.
Trong phản ứng hoá học: 2Al + 6HCl → 2AlCl3 + H2, mỗi nguyên tử Al đã
nhận 3 electron.
nhường 3 electron.
nhận 2 electron.
nhường 2 electron.
Một số loại xe ô tô được trang bị một thiết bị an toàn là túi chứa một lượng nhất định hợp chất ion sodium azide (NaN3), được gọi là "túi khí". Khi có va chạm mạnh xảy ra, sodium azide bị phân huỷ rất nhanh, giải phóng khí N2 và nguyên tố Na, làm túi phồng lên, bảo vệ được người trong xe tránh khỏi thương tích. Phương trình hoá học của phản ứng phân huỷ sodium azide là
2NaN3 → 2Na + 3N2.
2NaN3 → 2Na + N2.
NaN3 → Na + 3N2.
2NaN3 → Na + 3N2
Quy tắc xác định số oxi hoá nào sau đây không đúng?
Trong đơn chất, số oxi hoá của nguyên tử bằng 0.
Trong phân tử hợp chất, số oxi hoá của oxygen luôn là -2.
Trong hợp chất, tổng số oxi hoá của các nguyên tử trong phân tử bằng 0.
Trong ion đơn nguyên tử, số oxi hoá của nguyên tử bằng điện tích ion.
Cho phản ứng: Mg + H2SO4 → MgSO4 + H2S + H2O. Khi hệ số cân bằng phản ứng là nguyên và tối giản thì số phân tử H2O tạo thành là
3.
10.
5.
4.
Cho hai phương trình nhiệt hóa học sau:
(1)
(2)
Nhận xét đúng là
Phản ứng (1) xảy ra thuận lợi hơn.
Phản ứng (2) xảy ra thuận lợi hơn.
Cả hai phản ứng đều thu nhiệt.
Phản ứng (1) toả ra nhiều nhiệt hơn.
Công thức tính biến thiên enthalpy của phản ứng theo năng lượng liên kết là
Các quá trình sau:
a) Nước hóa rắn.
b) Sự tiêu hóa thức ăn.
c) Quá trình chạy của con người.
d) Khí CH4 đốt ở trong lò.
e) Hòa tan KBr vào nước làm cho nước trở nên lạnh.
g) Sulfuric acid đặc khi thêm vào nước làm cho nước nóng lên.
Số quá trình thu nhiệt là
2.
3.
4.
5.
Cho phản ứng sau:
Biết nhiệt tạo thành chuẩn của SO2 là -296,8 kJ/mol. Nhiệt tạo thành chuẩn của SO3 là
+ 441 kJ/mol.
-441 kJ/mol.
+ 414 kJ/mol.
-414 kJ/mol.
a). Trong phản ứng trên thì CrO3 đóng vai trò là chất khử.
b). Số oxi hóa của carbon trước và sau phản ứng lần lượt là +2 và +4.
c). Tỉ lệ cân bằng của phản ứng trên là 4 : 1 : 2 : 2 : 3.
d). Tỉ lệ chất khử: chất oxi hóa ở phương trình hóa học trên là 1: 4.
a). Phản ứng trên là phản ứng thu nhiệt.
b). Nhiệt tạo thành chuẩn của O2 (g) bằng 0.
c). Nhiệt tạo thành của C2H2 là 454 kJ/mol.
d). Đốt 1 mol C2H2 nhiệt tỏa ra là 1299,8 kJ/mol.
PHẦN III. Câu hỏi trắc nghiệm yêu cầu trả lời ngắn.Thí sinh trả lời từ câu 1 đến câu 4. (2 điểm)
Trong giai đoạn đầu sản xuất nitric acid từ ammonia. Ammonia bị oxi hóa bởi oxygen ở nhiệt độ cao khi có chất xúc tác.
Tổng hệ số cân bằng (là các số nguyên, tối giản) của phản ứng là ?
Cho 2,34 gam kim loại M (có hóa trị không đổi là n) tác dụng với dung dịch H2SO4 (đặc nóng, dư) thu được 3,2227 L SO2 (điều kiện chuẩn). Xác định nguyên tử khối của kim loại M.
Cho giản đồ năng lượng của các phản ứng 1 – 5 như sau:
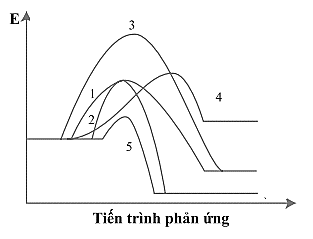
Số phản ứng toả nhiệt là bao nhiêu ?
Quá trình đốt cháy ethanol diễn ra theo phản ứng:
C2H5OH (l) + 3O2 (g) → 2CO2 (g) + 3H2O (l)
Tính (đơn vị kJ) của phản ứng trên từ các giá trị năng lượng liên kết sau:
EC–C = 347 kJ mol-1;EO=O = 496 kJ mol-1; EC–O = 336 kJ mol-1; EC–H = 410 kJ mol-1; EC=O = 805 kJ mol-1; EO–H = 465 kJ mol-1.
B. Phần tự luận (3 điểm)
Câu 1 (1,5 điểm):
a. Lập phương trình hoá học của phản ứng sau bằng phương pháp thăng bằng electron, nêu rõ chất oxi hóa, chất khử.
Al + HNO3 → Al(NO3)3 + NH4NO3 + H2O
b. Cho potassium iodide (KI) tác dụng với potassium permanganate (KMnO4) trong dung dịch sulfuric acid (H2SO4) thu được 3,02 gam manganese (II) sulfate (MnSO4), I2 và K2SO4. Khối lượng iodine (I2) tạo thành là?
Câu 2 (1,5 điểm): Cho phản ứng đốt cháy ethane:
C2H6(g) + O2(g) 2CO2(g) + 3H2O (l)
Biết:
Chất | C2H6 (g) | O2 (g) | CO2 (g) | H2O (l) |
(kJmol-1) | -84,7 | 0 | -393,5 | -285,8 |
a. Tính biến thiên enthalpy chuẩn của phản ứng đốt cháy ethane.
b. Cho biết phản ứng là toả nhiệt hay thu nhiệt, giải thích.








