Đề kiểm tra Hóa 12 Cánh diều Chủ đề 5 có đáp án - Đề 2
28 câu hỏi
Sức điện động chuẩn của pin Galvani được tính như thế nào?
Bằng hiệu của thế điện cực chuẩn tương ứng của điện cực dương và điện cực âm.
Bằng tổng của thế điện cực chuẩn tương ứng của điện cực dương và điện cực âm.
Bằng tích của thế điện cực chuẩn tương ứng của điện cực dương và điện cực âm.
Bằng thương của thế điện cực chuẩn tương ứng của điện cực dương và điện cực âm.
Nhận xét nào sau đây đúng về quá trình điện phân ở hai điện cực?
Cation nhường electron ở cathode.
Anion nhận electron ở anode.
Sự oxi hóa xảy ra ở anode.
Sự oxi hóa xảy ra ở cathode.
Giá trị thế điện cực chuẩn của cặp oxihoá - khử nào được quy ước bằng 0?
Na+/Na.
2H+/H2.
Al3+/Al.
Br2/2Br−.
Ở điều kiện chuẩn, Fe khử được ion kim loại nào sau đây trong dung dịch?
Be2+.
Al3+.
Na+.
Ag+.
Trong các ion: Ag+,Al3+, Mg2+,Cu2+,ion nào có tính oxi hoá mạnh nhất ở điều kiện chuẩn?
Ag+.
Al3+.
Cu2+.
Mg2+.
Ở điều kiện chuẩn, kim loại nào sau đây khử được ion H+ thành H2?
Fe.
Ag.
Hg.
Au.
Hiện tượng nào sau đây sẽ xảy ra khi dùng một chiếc thìa bằng đồng khuấy vào cốc chứa dung dịch aluminium nitrate?
Chiếc thìa bị phủ một lớp nhôm.
Một hỗn hợp đồng và nhôm được tạo thành.
Dung dịch trở nên xanh.
Không biến đổi hóa học nào xảy ra.
Cho thứ tự sắp xếp một số cặp oxi hoá – khử trong dãy điện hoá: Al3+/Al, Fe2+/Fe, Sn2+/Sn, Cu2+/Cu.Kim loại nào sau đây có phản ứng với dung dịch muối tương ứng?
Fe vàAl2(SO4)3.
Sn và FeCl2.
Fe và CuCl2.
Cu và SnSO4.
Cho một pin điện hóa được tạo bởi các cặp oxi hóa – khử Fe2+/Fe và Ag+/Ag ở điều kiện chuẩn. Quá trình xảy ra ở cực âm khi pin hoạt động là
Fe → Fe2+ + 2e.
Fe2+ + 2e → Fe.
Ag+ + 1e → Ag.
Ag → Ag+ + 1e.
Ion kim loại nào sau đây bị điện phân trong dung dịch (với điện cực graphite)?
Na+.
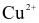 .
.
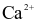 .
.
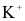 .
.
Cho phản ứng hoá học: Cu+2Ag+→Cu2++2Ag.Phát biểu nào sau đây về phản ứng trên là đúng?
Cu có tính khử yếu hơnAg.
Cu là chất khử,Ag+ là chất oxihoá.
Ag+ khử Cu thành Cu2+.
Cu2+ có tính oxihoá mạnh hơn Ag+.
Thứ tự một số cặp oxi hoá - khử trong dãy điện hoá như sau: Mg2+/Mg; Fe2+/Fe; Cu2+/Cu; Fe3+/Fe2+; Ag+/Ag. Dãy chỉ gồm các chất, ion tác dụng được với ion Fe3+ trong dung dịch là
Fe, Cu, Ag+.
Mg, Fe2+, Ag.
Mg, Cu, Cu2+.
Mg, Fe, Cu.
Cho từ từ đến dư kim loại X vào dung dịch FeCl3, sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Y chứa hai muối. X là kim loại nào sau đây?
Cu.
Na.
Mg.
Zn.
Khi điện phân dung dịch CuSO4, ion nào sẽ điện phân đầu tiên ở cathode?
Cu2+.
+ (của nước).
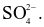
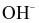 (của nước).
(của nước).
Một học sinh thực hiện ba thí nghiệm và quan sát được các hiện tượng như sau:
(1) Đồng kim loại không phản ứng được với dung dịch Pb(NO3)2 1M.
(2) Chì kim loại tan trong dung dịch AgNO3 1M và xuất hiện tinh thể Ag.
(3) Bạc kim loại không phản ứng với dung dịch Cu(NO3)2 1M.
Trật tự nào sau đây thể hiện đúng mức độ hoạt động của 3 kim loại?
Cu > Pb > Ag.
Pb > Cu > Ag.
Cu > Ag > Pb.
Pb > Ag > Cu.
Thứ tự một số cặp oxi hoá - khử trong dãy điện hoá như sau: Fe2+/Fe; Cu2+/Cu; Fe3+/Fe2+. Cặp chất không phản ứng với nhau là
dung dịch FeCl2 và dung dịch CuCl2.
Cu và dung dịch FeCl3.
Fe và dung dịch CuCl2.
Fe và dung dịch FeCl3.
Thế điện cực chuẩn của các cặp oxihoá-khử của kim loại M+/M và R2+/R lần lượt là +0,799 V và +0,34 V. Nhận xét nào sau đây là đúng ở điều kiện chuẩn?
M khử được ion H+ thành H2.
R khử được ion M+ thành M.
M có tính khử mạnh hơn R.
M+có tính oxi hoá yếu hơn R2+.
Trong công nghiệp, việc tinh chế đồng từ đồng thô được thực hiện bằng phương pháp điện phân dung dịch với anode làm bằng
graphite.
đồng thô.
platinum.
thép.
Cho sơ đồ pin Galvani Zn-Cu ở điều kiện chuẩn như hình vẽ sau:
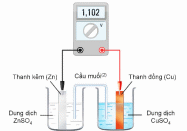
(a) Tại cathode của pin xảy ra quá trình 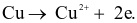
(b) Thế điện cực chuẩn của cặp 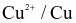 có giá trị bằng 1,102 V.
có giá trị bằng 1,102 V.
(c) Dòng điện trong pin có chiều từ điện cực Cu sang điện cực Zn.
(d) Phản ứng xảy ra trong pin là 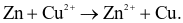
Nhúng thanh kẽm và thanh đồng (không tiếp xúc với nhau) vào cốc đựng dung dịch H2SO4 loãng. Nối thanh kẽm và thanh đồng bằng dây dẫn (có một khóa X) như hình bên dưới.
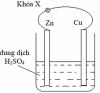
(a) Khi thay thanh Cu bằng thanh Mg, thanh Zn vẫn bị ăn mòn điện hóa.
(b) Khi chưa đóng khóa X xảy ra ăn mòn hóa học.
(c) Tốc độ bọt khí thoát ra khi mở khóa X và khi đóng khóa X là như nhau.
(d) Khi đóng khóa X, xảy ra ăn mòn điện hóa và thanh Zn bị ăn mòn.
Tiến hành điện phân dung dịch NaCl bão hoà với điện cực trơ, không sử dụng màng ngăn xốp. Bố trí thí nghiệm như hình vẽ sau:
(a) Dung dịch thu được sau điện phân có khả năng tẩy màu.
(b) Thí nghiệm trên được sử dụng để điều chế kim loại Na trong công nghiệp.
(c) Quá trình xảy ra tại cathode là: 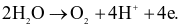
(d) Quá trình xảy ra tại anode là: 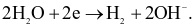
Sử dụng thiết bị sau với dòng điện một chiều, thực hiện mạ một chiếc thìa bằng kim loại như hình bên dưới:
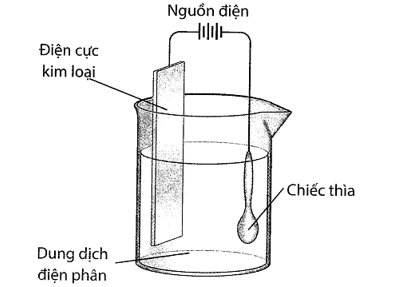
(a) Bạc sẽ bám lên chiếc thìa bởi vì bạc là kim loại rất hoạt động.
(b) Dung dịch điện phân là muối bạc tan tốt trong nước.
(c) Điện cực kim loại được làm bằng bạc.
(d) Chiếc thìa được nối với cực âm của nguồn điện.
Thế điện cực chuẩn của cặp 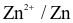 được xác định bằng cách lắp đặt pin điện hóa, trong đó cực dương sử dụng điện cực hydrogen tiêu chuẩn (SHE). Các điện cực được chuẩn bị như sau:
được xác định bằng cách lắp đặt pin điện hóa, trong đó cực dương sử dụng điện cực hydrogen tiêu chuẩn (SHE). Các điện cực được chuẩn bị như sau:

- Điện cực SHE: Tấm platinum nhúng trong dung dịch 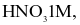 khí
khí 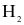 được bơm qua ống dẫn nhỏ ở phần sát bề mặt điện cực liên tục với áp suất 1 bar.
được bơm qua ống dẫn nhỏ ở phần sát bề mặt điện cực liên tục với áp suất 1 bar.
- Điện cực 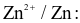 Tấm kẽm nhúng trong dung dịch
Tấm kẽm nhúng trong dung dịch 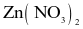 có nồng độ 1M.
có nồng độ 1M.
Sức điện động của pin điện hóa ở trên có giá trị là 0,76V. Tính thế điện cực chuẩn (theo V) của cặp 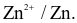 (Làm tròn kết quả đến hàng phần mười)
(Làm tròn kết quả đến hàng phần mười)
Các kim loại X, Y, Z, T được đánh số thứ tự lần lượt từ 1 đến 4. Cho các pin điện hoá và sức điện động chuẩn tương ứng:
| Pin điện hóa | X – Y | T – X | Z – X |
| Sức điện động chuẩn (V) | 0,32 | 0,46 | 1,24 |
Sắp xếp các kim loại theo chiều giảm dần tính khử từ trái sang phải thành một bộ 4 số (Ví dụ 1324, 4321,…).
Kim loại calcium (Ca) được điều chế bằng cách điện phân nóng chảy 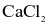 với dòng điện có cường độ 3000 A và điện áp
với dòng điện có cường độ 3000 A và điện áp 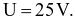 Hiệu suất điện phân là 80%. Tính điện năng (theo kWh) đã sử dụng điều chế 1 kg Ca. (Làm tròn kết quả đến hàng phần mười)
Hiệu suất điện phân là 80%. Tính điện năng (theo kWh) đã sử dụng điều chế 1 kg Ca. (Làm tròn kết quả đến hàng phần mười)
Cho biết:
Điện năng A được xác định bởi công thức: 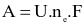 (với
(với 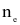 là số mol electron trao đổi giữa điện cực với các chất điện phân;
là số mol electron trao đổi giữa điện cực với các chất điện phân; 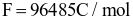 ).
).
Người ta mạ nickel lên mặt vật kim loại bằng phương pháp mạ điện, dung dịch điện phân chứa 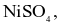 cực dương là Ni kim loại, cực âm là vật kim loại cần mạ. Nếu dòng điện có cường độ 1,5 A chạy qua dung dịch trong 2 giờ thì khối lượng nickel được mạ lên vật là bao nhiêu? (Cho biết khối lượng mol của Ni = 58,7 g/mol, hằng số Faraday F = 96500 C/mol, hiệu suất quá trình điện phân là 100%). (Làm tròn kết quả đến hàng phần mười)
cực dương là Ni kim loại, cực âm là vật kim loại cần mạ. Nếu dòng điện có cường độ 1,5 A chạy qua dung dịch trong 2 giờ thì khối lượng nickel được mạ lên vật là bao nhiêu? (Cho biết khối lượng mol của Ni = 58,7 g/mol, hằng số Faraday F = 96500 C/mol, hiệu suất quá trình điện phân là 100%). (Làm tròn kết quả đến hàng phần mười)
Nhôm (aluminium) được sản xuất bằng phương pháp điện phân Al2O3 tinh khiết. Quặng nhôm thường chứa thạch anh, silicate (chứa Si) và một số tạp chất khác cần được loại bỏ. Một loại quặng bauxite gồm 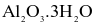 và
và 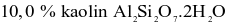 được dùng để sản xuất nhôm theo quy trình Bayer. Tính tỉ lệ hao hụt của nhôm trong quá trình tinh chế, biết silic thường được loại bỏ ở dạng bùn aluminosilicate
được dùng để sản xuất nhôm theo quy trình Bayer. Tính tỉ lệ hao hụt của nhôm trong quá trình tinh chế, biết silic thường được loại bỏ ở dạng bùn aluminosilicate 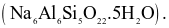 (Làm tròn kết quả đến hàng phần trăm)
(Làm tròn kết quả đến hàng phần trăm)
Hiện nay mạ điện được sử dụng rộng rãi trong thực tế, mạ điện là quá trình phủ một lớp kim loại lên bề mặt kim loại khác bằng phương pháp điện phân. Giả sử người tacần mạ Ag lên một mặt của một chiếc đĩa kim loại hình tròn có bán kính 20cm, độ dày lớp mạ là 0,01 mm.Nếu được cung cấp nguồn điện một chiều có cường độ dòng điện I = 2A thì thời gian cần dùng làt giờ. Biết rằng khối lượng riêng của 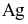 là
là 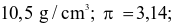 hằng số Faraday (F = 96 500 C/mol); hiệu suất điện phân là 100%. Giá trị của t là bao nhiêu? (Làm tròn kết quả đến hàng phần trăm)
hằng số Faraday (F = 96 500 C/mol); hiệu suất điện phân là 100%. Giá trị của t là bao nhiêu? (Làm tròn kết quả đến hàng phần trăm)


