Đề kiểm tra Hóa 12 Cánh diều Chủ đề 5 có đáp án - Đề 1
28 câu hỏi
Cặp oxi hóa – khử của kim loại là
dạng oxi hóa và dạng khử của cùng một nguyên tố kim loại.
dạng oxi hóa và dạng khử của cùng một hợp chất của kim loại.
dạng oxi hóa và dạng khử của các dạng thù hình của một nguyên tố kim loại.
dạng oxi hóa và dạng khử của một cation kim loại và kim loại đó.
Trong nước,thế điện cực chuẩn của kim loại Mn+/M càng nhỏ thì dạng khử có tính khử …(I)… và dạng oxi hoá có tính oxi hoá …(II)….
Các cụm từ cần điền vào (I) và (II) lần lượt là
càng mạnh và càng yếu.
càng mạnh và càng mạnh.
càng yếu và càng yếu.
càng yếu và càng mạnh.
Trong quá trình hoạt động của pin điện hoá Zn-Cu, nhận định nào sau đây không đúngvề vai trò của cầu muối?
Cho phép các ion di chuyển qua.
Cho dòng electron chạy qua.
Trung hoà điện ở mỗi dung dịch điện li.
Đóng kín mạch điện.
Cặp oxi hoá- khử nào sau đây có giá trị thế điện cực chuẩn lớn hơn 0?
K+/K.
Li+/Li.
Ba2+/Ba.
Cu2+/Cu.
Cho thế điện cực chuẩn của các cặp oxihoá– khử: Fe2+/Fe,Na+/Na,Ag+/Ag, Mg2+/Mg,Cu2+/Cu lần lượt là -0,44V,-2,713V,+0,799V,-2,353V,+0,340V.Ở điều kiện chuẩn, kim loại Cu khử được ion kim loại nào sau đây?
Na+.
Mg2+.
Ag+.
Fe2+.
Mối liên hệ giữa dạng oxi hoá và dạng khử của kim loại M được biểu diễn ở dạng quá trình khử là
M→Mn++ne.
Mn++ne→M.
Mn+ →M+ne.
M+ne→Mn+.
Cho các cặp oxi hoá-khử của các kim loại và thế điện cực chuẩn tương ứng:
| Cặp oxi hoá-khử | Li+/Li | Mg2+/Mg | Zn2+/Zn | Ag+/Ag |
| Thế điện cực chuẩn,V | -3,040 | -2,356 | -0,762 | +0,799 |
Trong số các kim loại trên,kim loại có tính khử mạnh nhất là
Mg.
Zn.
Ag.
Li.
Trong pin điện hoá Zn-Cu, phản ứng hoá học xảy ra giữa hai dạng nào của các cặp oxi hoá-khử tương ứng?
Zn và Cu2+.
Zn và Cu.
Zn2+vàCu2+.
Zn và Cu2+.
Trong quá trình hoạt động của pin điện Zn-Cu,dòng electron di chuyển từ
cực kẽm sang cực đồng.
cực bên phải sang cực bên trái.
cathode sang anode.
cực dương sang cực âm.
Trong quá trình hoạt động của pin điện Ni-Cu, quá trình xảy ra ở anode là
Ni→Ni2++2e.
Cu→Cu2++2e.
Cu2++2e→Cu.
Ni2++2e→Ni.
Trong quá trình hoạt động của pin điện Cu-Ag, điện cực đồng
là điện cực dương.
là cathode.
là điện cực bị giảm dần khối lượng.
là nơi xảyra quá trình khử.
Trong quá trình điện phân KCl nóng chảy với các điện cực trơ, ở cathode xảy ra quá trình
oxi hóa ion K+.
khử ion K+.
oxi hóa ion Cl–.
khử ion Cl–.
Dung dịch X chứa hỗn hợp các muối: MgCl2, CuCl2,FeCl2và KCl. Kim loại tách ra đầu tiên ở cathode khi điện phân dung dịch là
Cu..
Mg.
K.
Fe.
Sodium được sản xuất trong công nghiệp bằng phương pháp nào?
Phương pháp thủy luyện.
Phương pháp nhiệt luyện.
Phương pháp điện phân.
Phương pháp điện phân nóng chảy.
Điện phân dung dịch chất nào sau đây (dùng điện cực trơ), thu được dung dịch có khả năng làm quỳ tím chuyển sang màu đỏ?
NaBr.
NaCl.
CuSO4.
CuCl2.
Trong quá trình mạ bạc cho một chiếc vòng bằng thép thì ở anode xảy ra quá trình
Ag → 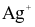 + 1e.
+ 1e.
Fe → 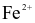 + 2e.
+ 2e.
2H2O → 4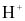 + O2 + 4e.
+ O2 + 4e.
C →  + 4e.
+ 4e.
Một pin điện hoá có điện cực Zn nhúng trong dung dịch ZnSO4 và điện cực Cu nhúng trong dung dịch CuSO4. Sau một thời gian pin đó phóng điện thì
khối lượng điện cực Zn giảm còn khối lượng điện cực Cu tăng.
khối lượng điện cực Zn tăng còn khối lượng điện cực Cu giảm.
khối lượng cả hai điện cực Zn và Cu đều tăng.
khối lượng cả hai điện cực Zn và Cu đều giảm.
Trong công nghiệp, quá trình điện phân dung dịch NaCl bão hòa (điện cực trơ, có màng ngăn xốp) tạo ra khí nào sau đây ở cathode?
Hydrogen.
Chlorine.
Oxygen.
Hydrogen chloride.
Cho phản ứng: Ce4+ + 2I-→ I2 + Ce3+.
(a) Phản ứng trên đã cân bằng
(b) Chất oxi hóa là Ce4+, chất khử là I-.
(c) Cặp oxi hóa – khử của kim loại cerium là Ce4+/Ce, của iodine là I2/2I-
(d) Phương trình hóa học của phản ứng là 2Ce4+ + 2I-→ I2 + 2Ce3+.
Xét pin Galvani tạo bởi hai điện cực kim loại:
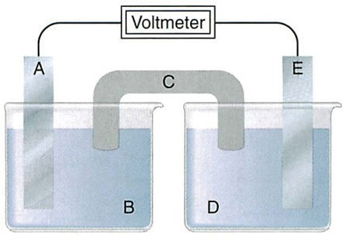
(a) A là anode, E là cathode, C là cầu muối.
(b) Nếu Alà Zn thì B phải là ZnSO4.
(c) Nếu C chứa KNO3 thì ion K+ được chuyển từ C vào D.
(d) Chiều dòng điện ở mạch ngoài từ A sang E.
Trong công nghiệp, từ nguồn kim loại thô có thể tinh chế kim loại bằng phương pháp điện phân.
(a) Nguyên tắc chung để điều chế kim loại là oxi hóa ion kim loại thành kim loại.
(b) Trong sự điện phân ở anode xảy ra sự oxi hóa, ở cathode xảy ra sự khử.
(c) Các kim loại mạnh như Na, K, Mg, Ca, K… được sản xuất bằng phương pháp điện phân nóng chảy hợp chất ion của chúng.
(d) Trong công nghiệp nhôm được sản xuất bằng cách điện phân aluminium oxide nóng chảy.
Cho pin Galvani Zn-Cu hoạt động với phương trình hóa học sau:

(a) Điện cực đồng là cực dương.
(b) Khi pin hoạt động thì khối lượng điện cực đồng giảm.
(c) Sức điện động chuẩn của pin được tính bằng công thức 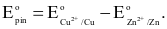
(d) Sức điện động chuẩn của pin là 1,34V. Sử dụng pin này để thắp sáng một bóng đèn nhỏ với cường độ dòng điện chạy qua là I = 0,02A. Cho biết 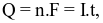 trong đó: Q là điện lượng, n là số mol electron đi qua dây dẫn,
trong đó: Q là điện lượng, n là số mol electron đi qua dây dẫn,  là cường độ dòng điện (A), t là thời gian (giây), F là hằng số Faraday (F = 96500 C.mol-1). Nếu điện cực kẽm hao mòn 0,1 mol do pin phóng điện thì thời gian tối đa mà pin thắp sáng được bóng đèn là 268 giờ. (Kết quả làm tròn đến hàng đơn vị)
là cường độ dòng điện (A), t là thời gian (giây), F là hằng số Faraday (F = 96500 C.mol-1). Nếu điện cực kẽm hao mòn 0,1 mol do pin phóng điện thì thời gian tối đa mà pin thắp sáng được bóng đèn là 268 giờ. (Kết quả làm tròn đến hàng đơn vị)
Cho các phát biểu sau:
(a) Cu2+ có tính oxi hóa mạnh hơn Fe3+ và Cu có tính khử mạnh hơn Fe2+.
(b) Zn có tính khử mạnh hơn Pb và Zn2+ có tính oxi hóa yếu hơn Pb2+.
(c) Những kim loại có thế điện cực chuẩn âm đều khử được H+ thành H2 và phản ứng được trong dung dịch HCl.
(d) Trong dãy hoạt động hóa học, những kim loại đứng trước có thế điện cực chuẩn lớn hơn thế điện cực chuẩn của những kim loại đứng sau.
(e) Kẽm có thể khử các ion Fe2+ và Ni2+ về kim loại Fe và Ni nhưng không thể khử ion Al3+ về kim loại Al.
Số phát biểu đúng là?
Thiết lập pin điện hóa ở điều kiện chuẩn gồm hai điện cực tạo bởi các cặp oxi hóa – khử Ni2+/Ni (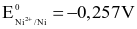 ) và Cd2+/Cd (
) và Cd2+/Cd (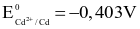 ). Sức điện động chuẩn của pin điện hoá trên là bao nhiêu volt?
). Sức điện động chuẩn của pin điện hoá trên là bao nhiêu volt?
Hai cặp oxi hoá - khử Ni2+/Ni và Cd2+/Cd tạo thành pin có sức điện độngchuẩn là 0,146 V. Phản ứng xảy ra trong pin:
Cd + Ni2+⟶Cd2+ + Ni
Thế điện cực chuẩn của cặp Cd2+/Cd có giá trị là bao nhiêu vôn? (Làm tròn kết quả đến phần trăm)
Cho biết: ở trạng thái chuẩn, pin Ni - Pb có sức điện động 0,131 V; 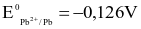
Cho các kim loại sau: Na, Ca, Fe, Al, Zn, Cu, Ag.Có bao nhiêu kim loại được điều chế trong công nghiệp bằng phương pháp điện phân hợp chất nóng chảy của chúng?
Điện phân dung dịch CuCl2 trong 1 giờ với dòng điện 5A. Sau điện phân, dung dịch còn CuCl2 dư. Khối lượng Cu đã sinh ra tại cathode của bình điện phân là bao nhiêu gam? (Cho Cu = 64).
Để mạ 5,0 g bạc lên một đĩa sắt khi điện phân dung dịch chứa  với dòng điện có cường độ 1,5 A không đổi cần thời gian t phút.
với dòng điện có cường độ 1,5 A không đổi cần thời gian t phút.
Cho biết:
- Quá trình khử tại cathode:  + 1e → Ag + 2NH3.
+ 1e → Ag + 2NH3.
- Điện lượng q = It = ne. F, F = 96 500 C/mol.
Giá trị của t là bao nhiêu? (Làm tròn kết quả đến phần mười).


