Đề kiểm tra Hóa 10 Kết nối tri thức Chương 7 có đáp án - Đề 2
28 câu hỏi
Nguyên tố nào sau đây không thuộc nhóm halogen?
Iodine.
Potassium.
Chlorine.
Bromine.
Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố halogen là
ns2np3.
ns2np4.
ns2np5.
ns2np6.
Đặc điểm chung của các nguyên tố nhóm halogen là
chất khí ở điều kiện thường.
có tính oxi hóa mạnh.
vừa có tính oxi hóa vừa có tính khử
phản ứng mãnh liệt với nước.
Hóa chất dùng để phân biệt các dung dịch: NaF, NaCl, NaBr, NaI là
dung dịch HCl.
quỳ tím.
dung dịch AgNO3.
dung dịch BaCl2.
Liên kết giữa các nguyên tử trong phân tử halogen là
liên kết hydrogen.
liên kết cộng hóa trị.
liên kết ion.
liên kết cho - nhận.
Chất nào sau đây được dùng để khử trùng nước sinh hoạt?
O2.
2.
Cl2.
I2.
Hai chất nào sau đây được cho vào muối ăn để bổ sung nguyên tố iodine, phòng ngừa bệnh bướu cổ ở người?
I2, HI.
HI, HIO3.
KI, KIO3.
I2, AlI3.
Acid nào sau đây có tính acid mạnh nhất?
HF.
HI.
HCl.
HBr.
Phản ứng giữa chất nào sau đây với dung dịch H2SO4 đặc, nóng không phải là phản ứng oxi hóa – khử?
KBr.
KI.
NaCl.
NaBr.
Đơn chất halogen nào sau đây thăng hoa khi đun nóng?
2.
Cl2.
Br2.
I2.
Kim loại nào sau đây không tác dụng với acid HCl?
Fe.
Zn.
Cu.
Mg.
Hydrogen halide nào sau đây được sử dụng trong quá trình sản xuất teflon?
HF.
HCl.
HBr.
HI.
Muối halide nào sau đây không tan trong nước?
NaF.
KCl.
AgCl.
NaI.
Phản ứng hóa học nào sau đây là sai?
2HCl + Fe → FeCl2 + H2
SiO2 + 4HF → SiF4 + 2H2O
Cl2 + 2NaBr → 2NaCl + Br2
AgNO3 + HF → HNO3 + AgF
Vai trò nào sau đây không phải là của muối ăn?
Cân bằng điện giải trong cơ thể sống.
Sử dụng trong quá trình sản xuất cryolite.
Dùng sản xuất nước muối sinh lí, dịch tiêm, truyền tĩnh mạch.
Nguyên liệu để sản xuất nước Javel.
Phương trình hóa học nào sau đây là đúng?
Fe + Cl2 → FeCl2.
2 + H2O ⇄ HF + HFO.
2Ag + 2HCl → 2AgCl + H2.
FeO + 2HCl → FeCl2 + 2H2O.
Nước Javel là hỗn hợp của các chất tan nào sau đây?
NaCl, NaClO.
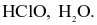
HCl, HClO.
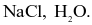
Phản ứng được dùng để điều chế khí hydrogen chloride trong phòng thí nghiệm là
2 + Cl2 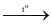 2HCl.
2HCl.
Cl2 + H2O  HCl + HClO .
HCl + HClO .
Cl2 + SO2 + 2H2O  2HCl + H2SO4.
2HCl + H2SO4.
NaClrắn + H2SO4 đặc 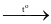 NaHSO4 + HCl.
NaHSO4 + HCl.
Cho các nhận định về các nguyên tố halogen như sau:
(a) Màu các đơn chất đậm dần theo thứ tự 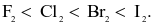
(b) Nếu chẳng may làm đổ bromine lỏng xuống bàn làm thí nghiệm, có thể dùng nước vôi để loại bỏ hoàn toàn lượng bromine này.
(c) Trong phản ứng với hydrogen, khả năng phản ứng của halogen tăng dần từ 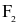 đến
đến 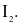
(d) Liên kết trong phân tử halogen là liên kết cộng hóa trị không phân cực.
Phản ứng giữa chlorine và hydrogencần điều kiện ánh sáng hoặc nhiệt độ xảy theo phương trình:

(a) Chlorine là chất khí có màu nâu đỏ.
(b) Chlorine đóng vai trò là chất oxi hóa.
(c) Dung dịch HCl khi tác dụng với 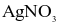 sản phẩm xuất hiện kết tủa màu trắng.
sản phẩm xuất hiện kết tủa màu trắng.
(d) Liên kết giữa H với Cl trong HCl là liên kết cộng hóa trị phân cực.
Thuỷ tinh vốn cứng, trơn và khá trơ về mặt hoá học nênviệc chạm khắc là điều không đơn giản. Muốn khắc cáchoa văn, cần phủ lên bề mặt thuỷ tinh một lớp paraffin, thực hiện chạm khắc các hoa văn lên lớp paraffin, để phầnthuỷ tinh cần khắc lộ ra. Nhỏ dung dịch hydrofluoric acid hoặc hỗn hợp 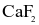 và
và 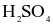 đặc lên lớp paraffin đó, phầnthuỷtinh cần chạm khắc sẽ bị ăn mòn, tạo nên những hoavăn trên vật dụng cần trang trí.
đặc lên lớp paraffin đó, phầnthuỷtinh cần chạm khắc sẽ bị ăn mòn, tạo nên những hoavăn trên vật dụng cần trang trí.
(a) HF là là acid mạnh và có tính chất đặc biệt là ăn mòn thuỷ tinh.
(b) Phương trình hoá học của phản ứng ăn mòn thủy tinh là: 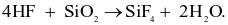
(c) Để bảo quản hydrofluoric acid, người ta chứa trong bình bằng nhựa.
(d) Tất cả các hydrohalic acid đều có khả năng ăn mòn thủy tinh.
“Natri clorid 0,9%” là nước muối sinh lí chứa sodium chloride (NaCl), nồng độ 0,9% tương đương các dịch trong cơ thể người như máu, nước mắt, … thường được sử dụng để súc miệng, sát khuẩn, …
(a) Rót nước sạch vào cốc đến vạch thể tích mong muốn, cho muối vào, khuấy đều đến khi nếm thấy độ mặn vừa phải thì dừng lại, thu được nước muối sinh lí 0,9%.
(b) Natri chlorid 0,9% được lấy từ nước biển ngoài khơi xa ở độ sâu 500 m để đảm bảo độ tinh khiết.
(c) NaCl là hợp chất ion, dễ tan trong nước.
(d) Cách pha chế 500 mL nước muối sinh lí trên: cân 0,9 g tinh thể NaCl sạch, cho vào cốc có vạch chia thể tích 500 mL, thêm nước vào cốc đến đủ thể tích 500 mL, khuấy đều (biết 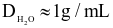 ).
).
Hydrochloric acid (HCl) là một acid mạnh được sử dụng trong các ngành công nghiệp sản xuất phân bón, thuốc nhuộm, ... Nó cũng được sử dụng trong các ngành công nghiệp mạ điện, chiết xuất ảnh, cao su và dệt may. Cho dung dịch acid HCl tác dụng với các chất sau: Zn, Cu, 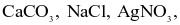 FeO. Số chất phản ứng được với dung dịch HCl là bao nhiêu?
FeO. Số chất phản ứng được với dung dịch HCl là bao nhiêu?
Cho 13,05 gam 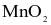 tác dụng với acid HCl đặc, dư. Khí chlorine sinh ra tác dụng vừa đủ với bao nhiêu gam sắt?
tác dụng với acid HCl đặc, dư. Khí chlorine sinh ra tác dụng vừa đủ với bao nhiêu gam sắt?
Cho một lượng dư khí Cl2 vào 200 ml dung dịch NaBr. Sau khi phản ứng xảy ra hoàn toàn thu được 1,755 gam muối. Nồng độ mol/l của dung dịch NaBr là bao nhiêu M?
Sục một lượng dư khí chlorine vào dung dịch chứa muối NaBr và KBr thu được muối NaCl và KCl, đồng thời thấy khối lượng muối giảm 4,45 gam. Số mol chlorine đã tham gia phản ứng với 2 muối trên là bao nhiêu mol?
Cho từ từ đến hết 10g dung dịch X gồm KF 1,84% và NaCl 1,17%, vào dung dịch AgNO3 dư, thu được m gam kết tủa. Giá trị của m là bao nhiêu?
Để trung hòa 200 ml dung dịch NaOH 1M thì thể tích dung dịch HCl 0,5M cần dùng là bao nhiêu lít?


