Đề kiểm tra Hóa 10 Kết nối tri thức Chương 7 có đáp án - Đề 1
28 câu hỏi
Nhóm halogen ở vị trí nào trong bảng tuần hoàn?
Nhóm IA.
Nhóm VIIA.
Nhóm IIA.
Nhóm VIA.
Nguyên tố halogen nào sau đây là nguyên tố phóng xạ?
Fluorine.
Chlorine.
Bromine.
Astatine.
Quặng/ khoáng vật nào sau đây có chứa nguyên tố chlorine?
Quặng fluorite.
Quặng cryolite.
Quặng fluorapatite.
Khoáng vật carnallite.
Halogen nào sau đây là chất lỏng ở điều kiện thường?
Fluorine.
Chlorine.
Bromine.
Iodine.
Trong các đơn chất: F2, Cl2, Br2, I2, chất có nhiệt độ nóng chảy và nhiệt độ sôi cao nhất là
2.
Cl2.
Br2.
I2.
Trong nhóm halogen, khả năng oxi hóa của các đơn chất biến đổi theo chiều
tăng dần từ fluorine đến iodine.
giảm dần từ fluorine đến iodine.
không thay đổi khi đi từ fluorine đến iodine.
tăng dần từ chlorine đến iodine.
Số oxi hóa đặc trưng của các halogen trong hợp chất là
-1.
+3.
+5.
+7.
Cho phản ứng hóa học sau:
Cl2 + H2O ⇌ HCl + HClO
Phát biểu nào sau đây là đúng?
Chlorine chỉ đóng vai trò là chất oxi hóa.
Chlorine chỉ đóng vai trò là chất khử.
Chlorine vừa đóng vai trò là chất oxi hóa vừa đóng vai trò là chất khử.
Nước đóng vai trò là chất khử.
Phát biểu nào dưới đây không đúng?
Phân tử halogen tồn tại ở dạng phân tử X2.
Trong hợp chất, các halogen luôn có số oxi hóa là -1.
Các nguyên tố halogen có độ âm điện tương đối lớn.
Tính chất hóa học cơ bản của các halogen là tính oxi hóa mạnh.
Trong các phát biểu sau, phát biểu đúng là
Iodine có bán kính nguyên tử lớn hơn bromine.
Dung dịch NaF phản ứng với dung dịch AgNO3 sinh ra AgF kết tủa.
Fluorine có tính oxi hoá yếu hơn chlorine.
Acid HBr có tính acid yếu hơn acid HCl.
Cho phản ứng: X2 + 2NaBr(aq) → 2NaX(aq) + Br2. X có thể là chất nào sau đây?
Cl2.
I2.
2.
O2.
Cho phương trình hóa học sau:
Cl2 + 2NaBr → 2NaCl + Br2
Nhận xét nào sau đây đúng?
Chlorine là chất oxi hóa.
Chlorine có tính oxi hóa yếu hơn bromine.
Chlorine khử được anion bromide trong muối.
Bromine sinh ra ở dạng rắn, màu nâu đỏ.
Phản ứng giữa cặp chất nào sau đây không xảy ra?
KI và Br2.
AgNO3 và HCl.
AgNO3 và NaF.
KI và Cl2.
Phản ứng giữa đơn chất halogen nào sau đây với hydrogen diễn ra mãnh liệt, nổ ngay cả trong bóng tối hoặc ở nhiệt độ thấp?
I2.
Br2.
Cl2.
2.
Liên kết trong hợp chất hydrogen halide là
liên kết cộng hóa trị có cực.
liên kết cho – nhận.
liên kết ion.
liên kết cộng hóa trị không cực.
Hydrohalic acid nào sau đây không được bảo quản trong lọ thủy tinh?
HCl.
HF.
HBr.
HI.
Halogen không có tính khử là
iodine.
bromine.
fluorine.
chlorine.
Ion nào sau đây có tính khử mạnh nhất?
-.
Cl-.
Br-.
I-.
Cho hình vẽ mô tả thí nghiệm điều chế chlorine từ MnO2 và dung dịch HCl:
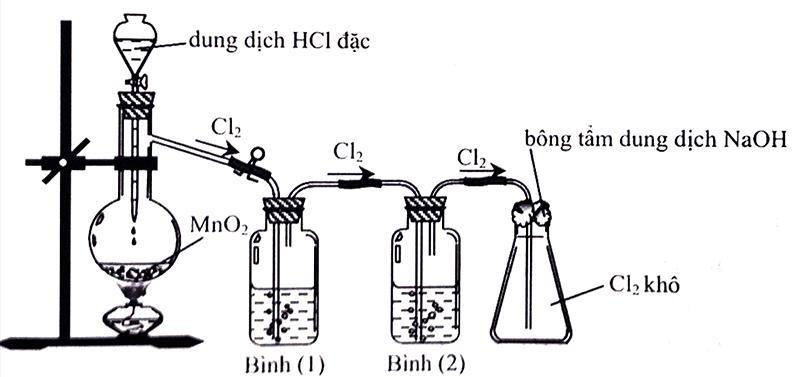
(a) Để thu được khí chlorine khô thì bình (1) và bình (2) lần lượt đựng dung dịch NaCl bão hòa và dung dịch H2SO4 đặc.
(b) Bông tẩm dung dịch NaOH dùng để ngăn không cho khí chlorine thoát ra ngoài.
(c) Có thể thay acid HCl đặc bằng acid H2SO4 đặc.
(d) Có thể thu khí chlorine bằng phương pháp đẩy nước.
Trong dịch vị dạ dày của người có hydrohalic acid X với nồng độ khoảng 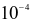 đến
đến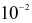 mol/L, đóng vai trò quan trọng trong quá trình tiêu hoá, cùng với enzyme và sự co bóp của cơ dạ dày nhằm chuyển hoá thức ăn thành chất dinh dưỡng cho cơ thể dễ hấp thụ.
mol/L, đóng vai trò quan trọng trong quá trình tiêu hoá, cùng với enzyme và sự co bóp của cơ dạ dày nhằm chuyển hoá thức ăn thành chất dinh dưỡng cho cơ thể dễ hấp thụ.
(a) X là hydrochloric acid.
(b) Dung dịch hydrohalic acid X làm quỳ tím chuyển màu đỏ.
(c) Hydrohalic acid X được dùng để tẩy rửa gỉ sét trên bề mặt gang, thép.
(d) Hydrohalic acid X là một acid yếu.
Nhiệt độ sôi của các hydrogen halide được biểu diễn qua đồ thị sau:
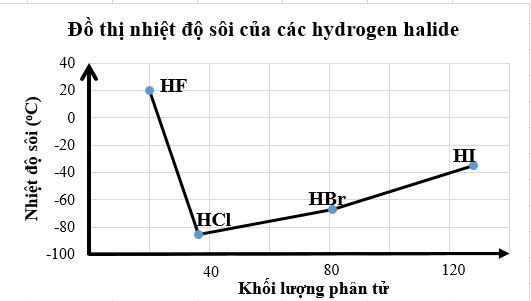
(a) Các phân tử hydrogen fluoride hình thành liên kết hydrogen liên phân tử nên nhiệt độ sôi của hydrogen fluoride cao bất thường so với các hydrogen halide còn lại.
(b) Nhiệt độ sôi của hydrogen fluoride cao bất thường so với các hydrogen halide còn lại là do lực tương tác van der Waals của HF lớn hơn.
(c) Nhiệt độ sôi tăng dần từ HF đến HI do khối lượng phân tử tăng dẫn đến tương tác van der Waals tăng.
(d) Nhiệt độ sôi của các hydrogen halide tăng dần từ HCl đến HI là do khối lượng phân tử tăng dẫn đến liên kết hydrogen liên phân tử tăng dần.
Các nguyên tố phổ biến thuộc nhóm halogen (VIIA) trong bảng tuần hoàn các nguyên tố hóa học gồm: F (Z = 9), Cl (Z = 17), Br (Z = 35) và I (Z = 53). Đơn chất halogen tồn tạo dạng phân tử 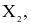 giữa các phân tử
giữa các phân tử 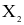 thường có tương tác với nhau. Cho giá trị năng lượng liên kết
thường có tương tác với nhau. Cho giá trị năng lượng liên kết 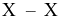 ở bảng sau:
ở bảng sau:
| Liên kết | F - F | Cl - Cl | Br - Br | I - I |
Năng lượng liên kết (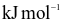 ) )ở | 159 | 243 | 193 | 151 |
Năng lượng liên kết X – X càng lớn thì liên kết càng bền.
(a) Cấu hình electron lớp ngoài cùng của nguyên tử X có dạng 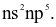
(b) Liên kết giữa các nguyên tử trong 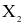 là liên kết cộng hóa trị không phân cực.
là liên kết cộng hóa trị không phân cực.
(c) Tương tác giữa các phân tử 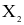 là tương tác van der Waals.
là tương tác van der Waals.
(d) Năng lượng liên kết Cl – Cl lớn nhất trong dãy trên vì Cl có bán kính nguyên tử nhỏ nhất.
Thực hiện các thí nghiệm sau:
(a) 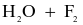
(b) Dung dịch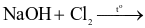
(c) Dung dịch 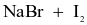
(d) Dung dịch 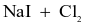
Ở điều kiện thích hợp, có bao nhiêu phản ứng tạo ra đơn chất?
“Muối i-ốt” có thành phần chính là sodium chloride (NaCl) có bổ sung một lượng nhỏ potassium iodide (KI) nhằm bổ sung nguyên tố vi lượng iodine cho cơ thể, nhằm ngăn bệnh bướu cổ, phòng ngừa khuyết tật trí tuệ và phát triển, … Trong 100 g “muối i-ốt” có chứa hàm lượng ion iodide 2 200 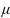 g; lượng iodide cần thiết cho một người trưởng thành khoảng 88
g; lượng iodide cần thiết cho một người trưởng thành khoảng 88 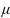 g/ngày. Trung bình, một người trưởng thành cần bao nhiêu gam “muối i-ốt” trong một ngày?
g/ngày. Trung bình, một người trưởng thành cần bao nhiêu gam “muối i-ốt” trong một ngày?
Đốt 2,88 gam kim loại R (hóa trị II) trong khí Cl2 (dư). Sau khi phản ứng xảy ra hoàn toàn, thu được 11,4 gam muối chloride của kim loại R. Khối lượng mol của R có giá trị bằng bao nhiêu? (Biết nguyên tử khối của Cl = 35,5)
Cho phản ứng sau:
H2 (g) + Cl2 (g) → 2HCl (g)
Biến thiên enthalpy chuẩn của phản ứng là bao nhiêu kJ?
Biết 0,02 mol Br2 phản ứng vừa đủ với V mL dung dịch chứa NaI 0,1M. Giá trị của V là bao nhiêu?
Cho dung dịch A chứa 1,17g NaCl tác dụng với dung dịch B chứa 5,1g AgNO3 thu được m gam kết tủa. Giá trị của m là bao nhiêu?

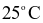 và 1 bar
và 1 bar
