Đề kiểm tra Hóa 10 Kết nối tri thức Chương 4 có đáp án - Đề 1
28 câu hỏi
Dấu hiệu để nhận biết một phản ứng oxi hóa – khử là dựa trên sự thay đổi đại lượng nào sau đây của nguyên tử?
Số khối.
Số oxi hóa.
Số hiệu nguyên tử.
Số mol.
Trong phản ứng oxi hóa – khử:
chất bị oxi hóa nhận electron và chất bị khử cho electron.
quá trình oxi hóa và quá trình khử xảy ra đồng thời.
chất chứa nguyên tố số oxi hóa cực đại luôn là chất khử.
quá trình nhận electron gọi là quá trình oxi hóa.
Chất khử là chất
nhường electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
cho electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
nhận electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
nhận electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
Trong phản ứng hoá học: Fe + 2HCl → FeCl2 + H2, mỗi nguyên tử Fe đã
nhường 2 electron.
nhận 2 electron.
nhường 1 electron.
nhận 1 electron.
Cho quá trình Al → Al3+ + 3e, đây là quá trình
khử.
oxi hóa.
tự oxi hóa – khử.
nhận proton.
Cho phản ứng: SO2 + Br2 + H2O → HBr + H2SO4. Trong phản ứng trên, vai trò của Br2
là chất oxi hóa
là chất khử.
vừa là chất oxi hóa, vừa là chất tạo môi trường.
vừa là chất khử, vừa là chất tạo môi trường.
Cho phản ứng: 2NH3 + 3Cl2 → N2 + 6HCl. Trong đó, NH3 đóng vai trò
là chất khử.
vừa là chất oxi hoá vừa là chất khử.
là chất oxi hoá.
không phải là chất khử, không là chất oxi hoá.
Chlorine vừa đóng vai trò chất oxi hóa, vừa đóng vai trò chất khử trong phản ứng nào sau đây?
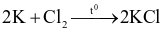
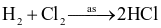
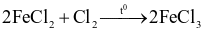
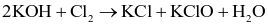 .
.
Cho các hợp chất sau: NH3, NH4Cl, HNO3, NO2. Số hợp chất chứa nguyên tử nitrogen có số oxi hoá -3 là
1.
3.
2.
4.
Phát biểu nào sau đây không đúng ?
Số oxi hóa của một nguyên tử một nguyên tố trong hợp chất là điện tích của nguyên tử nguyên tố đó với giả thiết hợp chất là ion.
Trong hợp chất, oxygen có số oxi hóa bằng -2, trừ một số trường hợp ngoại lệ.
Số oxi hóa của hydrogen trong mọi hợp chất đều là +1.
Các nguyên tố phi kim có số oxi hóa thay đổi tùy thuộc vào hợp chất chứa chúng.
Chất oxi hoá là chất
nhường electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
cho electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
nhận electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
nhận electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
Cho phản ứng:
Mg + H2SO4 → MgSO4 + H2S + H2O.
Khi hệ số cân bằng phản ứng là nguyên và tối giản thì số phân tử H2O tạo thành là
3.
10.
5.
4.
Trong phản ứng:
3Cu + 8HNO3→ 3Cu(NO3)2 + 2NO + 4H2O
Số phân tử nitric acid (HNO3) đóng vai trò chất oxi hóa là
8.
6.
4.
2.
Nhóm nào sau đây gồm các chất vừa có tính oxi hoá, vừa có tính khử?
Cl2, Fe.
Na, FeO.
2SO4, F2.
SO2, FeO.
Thực hiện các phản ứng hóa học sau:
(a) 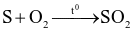
(b) 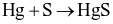
(c) 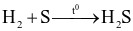
(d) 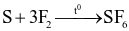
Số phản ứng sulfur đóng vai trò chất oxi hóa là
4.
2.
3.
1.
Cho các phản ứng:
(1) Ca(OH)2 + Cl2 → CaOCl2 + H2O
(2) 2H2S + SO2 → 3S + 2H2O
(3) AgNO3 + HCl → AgCl↓ + HNO3
(4) 4KClO3 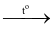 KCl + 3KClO4
KCl + 3KClO4
Số phản ứng oxi hoá - khử là
1.
2.
3.
4.
Cho các phản ứng sau:
(a) 4HCl + PbO2 → PbCl2 + Cl2 + 2H2O.
(b) HCl + NH4HCO3 → NH4Cl + CO2 + H2O.
(c) 2HCl + 2HNO3 → 2NO2 + Cl2 + 2H2O.
(d) 2HCl + Zn → ZnCl2 + H2.
Số phản ứng trong đó HCl thể hiện tính khử là
2.
3.
1.
4.
Cho phản ứng hóa học:
Cl2 + KOH 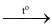 KCl + KClO3 + H2O
KCl + KClO3 + H2O
Tỉ lệ giữa số nguyên tử chlorine đóng vai trò chất oxi hóa và số nguyên tử chlorine đóng vai trò chất khử trong phương trình hóa học của phản ứng đã cho tương ứng là
1 : 5.
5 : 1.
3 : 1.
1 : 3.
Cho kim loại Mg vào dung dịch acid sulfuric đặc, nóng xảy ra phản ứng:
Mg + H2SO4 → MgSO4 + SO2 + H2O
(a) Hệ số cân bằng là số nguyên, tối giản của Mg là 2.
(b) Tỉ lệ số phân tử H2SO4 đóng vai trò chất khử : môi trường là 1 : 1.
(c) Một nguyên tử magnesium nhận 2 electron.
(d) Phản ứng được dùng để chứng minh Mg đứng trước H trong dãy hoạt động hóa học.
Cảnh sát giao thông sử dụng các dụng cụ phân tích rượu ethyl alcohol có chứa CrO3. Khi tài xế hà hơi thở vào dụng cụ phân tích trên, nếu trong hơi thở có chứa hơi rượu thì hơi rượu sẽ tác dụng với CrO3 có màu da cam và biến thành Cr2O3 có màu xanh đen theo phản ứng hóa học sau:
CrO3 + C2H5OH  CO2↑ + Cr2O3 + H2O
CO2↑ + Cr2O3 + H2O
(a) Tỉ lệ cân bằng của phản ứng trên là 4 : 1 : 2 : 2 : 3.
(b) Tỉ lệ chất khử : chất oxi hóa ở phương trình hóa học trên là 1: 4.
(c) Số oxi hóa của carbon trước và sau phản ứng lần lượt là +2 và +4.
(d) Trong phản ứng trên thì CrO3 đóng vai trò là chất khử.
Trong công nghiệp, sulfuric acid được sản xuất từ quặng pirite sắt có thành phần chính là 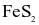 theo sơ đồ sau:
theo sơ đồ sau:
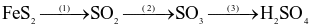
(a) Cả 3 quá trình trên đều xảy ra phản ứng oxi hóa – khử.
(b) Số oxi hóa của Fe trong 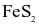 là +2.
là +2.
(c) Trong quá trình (2), 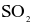 đóng vai trò là chất oxi hóa.
đóng vai trò là chất oxi hóa.
(d) Từ 1 tấn quặng chứa 60% 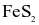 thu được 0,8 tấn
thu được 0,8 tấn 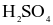 98%. (Cho hiệu suất cả quá trình là 80%).
98%. (Cho hiệu suất cả quá trình là 80%).
“Calcium chloride dùng trong điện phân để sản xuất calcium kim loại và điều chế các hợp kim của calcium. Với tính chất hút ẩm lớn, calcium chloride được dùng làm tác nhân sấy khí và chất lỏng. Do nhiệt độ đông đặc thấp nên dung dịch calcium chloride được dùng làm chất tải lạnh trong các hệ thống lạnh…. Ngoài ra, calcium chloride còn được làm chất keo tụ trong hóa dược và dược phẩm hay trong các công việc khoan dầu khí.Trong phản ứng tạo thành calcium chloride từ đơn chất: Ca + Cl2 → CaCl2. (Cho nguyên tử khối của Ca = 40)
(a) Trong phản ứng trên thì mỗi nguyên tử chlorine nhường 2e.
(b) Số oxi hóa của Ca và Cl trước phản ứng lần lượt là +2 và -1.
(c) Nếu dùng 4 gam calcium thì số mol electron calcium nhường là 0,8 mol.
(d) Liên kết trong phân tử CaCl2 là liên kết ion.
Trong phản ứng đốt cháy CuFeS2 tạo ra sản phẩm CuO, Fe2O3 và SO2 thì một phân tử CuFeS2 sẽ nhận vào bao nhiêu electron?
Tổng hệ số cân bằng (hệ số nguyên, tối giản) của phản ứng: FeS2 + O2 → SO2 + Fe2O3 là bao nhiêu?
Hòa tan hoàn toàn 6,5 gam Zn bằng dung dịch H2SO4 loãng, thu được V lít H2 (đkc). Giá trị của V là?
Cho 8,4 gam Fe phản ứng hoàn toàn với lượng dư dung dịch HNO3, thể tích khí NO (đkc) bay ra là bao nhiêu lít (coi NO là sản phẩm khử duy nhất)? (Làm tròn kết quả đến hàng phần trăm).
Để xác định hàm lượng ethanol trong máu của người lái xe cần chuẩn độ ethanol bằng K2Cr2O7 trong môi trường acid. Khi đó 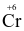 bị khử thành
bị khử thành 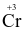 , ethanol (C2H5OH) bị oxi hóa thành acetaldehyde (CH3CHO).
, ethanol (C2H5OH) bị oxi hóa thành acetaldehyde (CH3CHO).
Khi chuẩn độ 25 gam huyết tương máu của một lái xe cần dùng 20 ml dung dịch K2Cr2O7 0,01M. Xác định nồng độ C2H5OH có trong máu của người lái xe này.
Giả sử rằng trong thí nghiệm trên chỉ có ethanol tác dụng với K2Cr2O7. (Làm tròn kết quả đến hàng phần trăm).
Xét phản ứng trong giai đoạn đầu của quá trình Ostwald:
NH3 + O2 NO + H2O
Biết trong không khí chứa 21% thể tích oxygen và các thể tích khí đo ở cùng điều kiện nhiệt độ và áp suất. Trong công nghiệp, lượng thể tích không khí cần trộn với 1 thể tích khí ammonia với để thực hiện phản ứng trên là?


