Đề kiểm tra Hóa 10 Kết nối tri thức Chương 3 có đáp án - Đề 2
28 câu hỏi
Trong các hợp chất sau đây, hợp chất nào có liên kết ion?
HCl.
2O.
NH3.
NaCl.
Để đánh giá loại liên kết trong phân tử hợp chất, người ta có thể dựa vào hiệu độ âm điện. Khi hiệu độ âm điện của hai nguyên tử tham gia liên kết ³ 1,7 thì đó là liên kết
ion.
cộng hoá trị không cực.
cộng hoá trị có cực.
kim loại.
Cho 2 nguyên tử có cấu hình electron ở trạng thái cơ bản như sau: 1s22s1 và 1s22s22p5. Hai nguyên tử này kết hợp nhau bằng loại liên kết gì để tạo thành hợp chất?
Liên kết cộng họa trị có cực.
Liên kết ion.
Liên kết cộng hóa trị không cực.
Liên kết kim loại.
Ion X- có cấu hình electron là 1s22s22p6, nguyên tử Y có số electron ở các phân lớp s là 5. Liên kết giữa X và Y thuộc loại liên kết nào sau đây?
cộng hóa trị phân cực.
cho nhận.
ion.
cộng hóa trị.
Liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung, gọi là
Liên kết ion.
Liên kết cộng hoá trị.
Liên kết kim loại.
Liên kết hydrogen.
Trong phân tử sẽ có liên kết cộng hoá trị phân cực nếu cặp electron chung có đặc điểm nào sau đây?
Ở giữa hai nguyên tử.
Lệch về một phía của một nguyên tử.
Chuyển hẳn về một nguyên tử.
Nhường hẳn về một nguyên tử.
Cho dãy các chất: N2, H2, NH3, NaCl, HCl, H2O. Số chất trong dãy mà phân tử chỉ chứa liên kết cộng hóa trị phân cực là
3.
6.
5.
4.
Hợp chất có liên kết ion trong phân tử là
CO2.
NH4Cl.
HCl.
2O2.
Cho biết các giá trị độ âm điện của nguyên tử các nguyên tố sau: K (0,82); Al (1,61); H (2,20); O (3,44); S (2,58); Br (2,96) và Cl (3,16). Hợp chất nào sau đây có liên kết ion trong phân tử?
SO2.
AlCl3.
2O.
KBr.
Phát biểu nào sau đây là sai khi nói về liên kết trong phân tử HCl?
Phân tử HCl là phân tử phân cực.
Các electron liên kết bị hút lệch về một phía nguyên tử chlorine.
Cặp electron dùng chung nằm chính giữa hai nguyên tử hydrogen và chlorine.
Nguyên tử hydrogen và chlorine liên kết với nhau bằng một liên kết đơn.
Nhận xét nào sau đây đúng khi nói về phân tử khí cacbonic (CO2), biết CO2 có cấu trúc thẳng:
Liên kết giữa C và O là cộng hóa trị không cực, CO2 là phân tử có cực.
Liên kết giữa C và O là cộng hóa trị có cực, CO2 là phân tử có cực.
Liên kết giữa C và O là cộng hóa trị không cực, CO2 là phân tử không cực.
Liên kết giữa C và O là cộng hóa trị có cực, CO2 là phân tử không cực.
Với phân tử NH3 phát biểu nào sau đây là đúng?
Liên kết trong phân tử là liên kết ion.
Liên kết trong phân tử là liên kết cộng hóa trị không phân cực.
Liên kết trong phân tử là liên kết cộng hóa trị phân cực.
Liên kết trong phân tử là liên kết cho – nhận.
Trong phân tử nitrogen, các nguyên tử liên kết với nhau bằng liên kết:
ion yếu.
ion mạnh.
cộng hóa trị không có cực.
cộng hóa trị phân cực.
Công thức electron nào sau đây là của phân tử H2O?
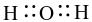
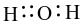
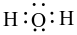
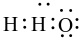
Hợp chất nào sau đây không tạo được liên kết hydrogen liên phân tử?
2O.
HF.
2H5OH.
2S.
Liên kết hydrogen xuất hiện giữa những phân tử cùng loại nào sau đây?
2H6.
CH3OH.
CO2.
2S.
Công thức electron nào sau đây là của phân tử khí nitrogen?
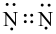
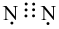
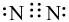
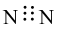
Công thức Lewis của CS2 là

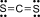
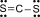
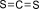
Cho các hợp chất sau: 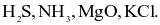
(a) Có 3 hợp chất ion.
(b) 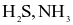 là các hợp chất cộng hóa trị.
là các hợp chất cộng hóa trị.
(c) Chỉ có KCl là hợp chất ion.
(d) Có 2 hợp chất ion là: MgO và KCl.
Phân tử 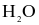 có cấu tạo như sau:
có cấu tạo như sau:
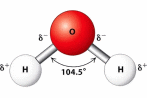
(a) Liên kết H–O là liên kết cộng hoá trị không phân cực.
(b) Cặp electron dùng chung trong liên kết H – O lệch về phía nguyên tử O.
(c) Nguyên tử O còn một cặp electron hoá trị riêng.
(d) Các phân tử H2O có khả năng tạo liên kết hydrogen với nhau.
Nguyên tố X tích luỹ trong tế bào thực vật nên rau và trái cây tươi là nguồn cung cấp tốt nguyên tố X cho cơ thể. Các nghiên cứu chỉ ra khẩu phần ăn chứa nhiều X có thể giảm nguy cơ cao huyết áp và đột quỵ. Nguyên tố Z được dùng để chế tạo dược phẩm, phẩm nhuộm và chất nhạy với ánh sáng. X thuộc loại nguyên tố s, nguyên tử X chỉ có 7 electron ở phân lớp s, nguyên tử Z chỉ có 17 electron ở phân lớp p.
(a) X là sodium (Na), Z là bromine (Br).
(b) Hợp chất tạo bởi X và Z là hợp chất ion.
(c) Khi hình thành liên kết, nguyên tử X có xu hướng nhường 1 electron và nguyên tử Z có xu hướng nhận 1 electron.
(d) Hợp chất tạo bởi X và Z tan tốt trong nước do tạo được liên kết hydrogen.
Trong các phát biểu sau, phát biểu nào đúng, phát biểu nào sai?
(a) Độ âm điện của chlorine nhỏ hơn của nitrogen.
(b) Liên kết N – H phân cực hơn liên kết H – Cl.
(c) Bất kì phân tử nào có chứa nguyên tử hydrogen cũng có thể tạo liên kết hydrogen với phân tử cùng loại.
(d) Ảnh hưởng của liên kết hydrogen tới nhiệt độ sôi và nhiệt độ nóng chảy của chất là mạnh hơn ảnh hưởng của tương tác van der Waals.
Số cặp electron không tham gia liên kết của nguyên tử N trong phân tử NCl3 là bao nhiêu?
Trong dung dịch ethanol (C2H5OH) có bao nhiêu loại liên kết hydrogen được tạo thành?
Không cần sử dụng hiệu độ âm điện, có bao nhiêu phân tử trong số các phân tử sau có liên kết cộng hóa trị: 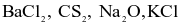 và HI?
và HI?
Tổng số các phân tử không có cực trong số các phân tử sau: 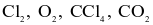 và
và 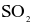 là bao nhiêu?
là bao nhiêu?
Cho các chất sau: CO, O3, CO2, HNO3, NH4Cl, NaNO3, H2O2. Số chất có chứa liên kết cho – nhận là?
Cho các phân tửH2O, NH3, HF, H2S, CO2, HCl. Số phân tử có thể tạo liên kết hydrogen với phân tử cùng loại là?


