Đề kiểm tra Hóa 10 Kết nối tri thức Chương 3 có đáp án - Đề 1
28 câu hỏi
Để lớp vỏ thỏa mãn quy tắc octet, nguyên tử oxygen (Z = 8) có xu hướng
nhường 6 electron.
nhận 2 electron.
nhường 8 electron.
nhận 6 electron.
Chất nào sau đây không thể tạo được liên kết hydrogen?
H2O.
CH4.
CH3OH.
NH3.
Tương tác van der Waals tồn tại giữa những
ion.
hạt proton.
hạt neutron.
phân tử.
Quá trình tạo thành ion Al3+ nào sau đây là đúng?
Al → Al3+ + 2e.
Al → Al3+ + 3e.
Al + 3e → Al3+.
Al + 2e → Al3+.
Liên kết hóa học giữa các nguyên tử trong phân tử HCl thuộc loại liên kết
cộng hóa trị có cực.
hydrogen.
cộng hóa trị không cực.
ion.
Sodium hydride (NaH) là một hợp chất được sử dụng như một chất lưu trữ hydrogen trong các phương tiện chạy bằng pin nhiên liệu do khả năng giải phóng hydrogen của nó. Trong sodium hydride, nguyên tử sodium có cấu hình electron bền của khí hiếm
helium.
argon.
krypton
neon.
Mô hình mô tả quá trình tạo liên kết hóa học sau đây phù hợp với xu hướng tạo liên kết hóa học của nguyên tử nào?
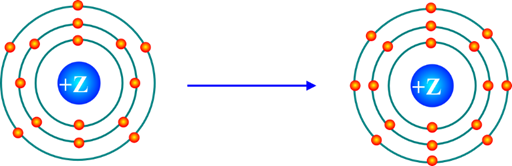
Aluminium
Nitrogen
Phosphorus
Oxygen
Các liên kết biểu diễn bằng dấu “•••” có vai trò quan trọng trong việc làm bền chuỗi xoắn đôi DNA. Đó là loại liên kết gì?
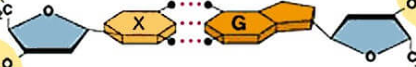
Liên kết ion.
Liên kết cộng hoá trị có cực.
Liên kết cộng hoá trị không cực.
Liên kết hydrogen.
Phân tử nào sau đây có các nguyên tử đều đạt cấu hình electron bão hòa theo quy tắc octet?
BeH2.
AlCl3.
PCl5.
SiH4.
Chọn phương án đúng để hoàn thành các câu sau:
“Khi tạo thành các hợp chất ion, … (1) … mất các electron hóa trị của chúng để tạo thành … (2) … mang điện tích dương và … (3) … nhận các electron hóa trị để tạo thành … (4) … mang điện tích âm”.
(1) kim loại, (2) anion, (3) phi kim, (4) cation.
(1) phi kim, (2) cation, (3) kim loại, (4) anion.
(1) kim loại, (2) ion đa nguyên tử, (3) phi kim, (4) anion
(1) kim loại, (2) cation, (3) phi kim, (4) anion.
Tính chất nào sau đây không phải tính chất của hợp chất ion?
Có tính bền, nhiệt độ nóng chảy cao.
Nhiệt độ nóng chảy, nhiệt độ sôi cao.
Có tính dẫn nhiệt và nhiệt độ nóng chảy thấp.
Chứa các liên kết ion.
Dãy được sắp xếp theo chiều tăng dần sự phân cực liên kết trong phân tử là
HCl, Cl2, NaCl.
Cl2, HCl, NaCl.
NaCl, Cl2, HCl.
Cl2, NaCl, HCl.
Số lượng cặp electron dùng chung trong các phân tử H2, O2, N2, F2 lần lượt là
1, 2, 3, 4.
1, 2, 3, 1.
2, 2, 2, 2.
1, 2, 2, 1.
Phát biểu nào sau đây không đúng?
Chỉ có các AO có hình dạng giống nhau mới xen phủ với nhau để tạo liên kết.
Khi hình thành liên kết cộng hoá trị giữa hai nguyên tử, luôn có một liên kết δ.
Liên kết δ bền vững hơn liên kết π.
Có hai kiểu xen phủ chính hình thành liên kết là xen phủ trục và xen phủ bên.
Số liên kết σ và π có trong phân tử C2H2 lần lượt là
2 và 3.
3 và 1.
2 và 2.
3 và 2.
Cho các chất sau: H2O, Cl2, K2O, NaF, N2, HCl, MgO. Số chất chứa liên kết ion trong phân tử là
2.
3.
4.
5.
Cho các chất sau: CO, O3, CO2, HNO3, NH4Cl, NaNO3, H2O2. Số chất có chứa liên kết cho – nhận là
4.
3.
6.
5.
Cho các phát biểu về các loại liên kết?
(a) Liên kết hydrogen yếu hơn liên kết ion và liên kết cộng hoá trị.
(b) Liên kết hydrogen mạnh hơn liên kết ion và liên kết cộng hoá trị.
(c) Tương tác van der Waals yếu hơn liên kết hydrogen.
(d) Tương tác van der Waals mạnh hơn liên kết hydrogen.
Số phát biểu đúng là
1.
2.
3.
4.
Độ âm điện của N và H tương ứng là 3,04 và 2,2.
(a) Liên kết H−N là liên kết cộng hoá trị không phân cực.
(b) Hợp chất có nhiệt độ nóng chảy, nhiệt độ sôi cao.
(c) Cặp electron dùng chung trong liên kết H−N lệch về phía nguyên tử N.
(d) là hợp chất ion.
Cho các nhận định sau về liên kết hóa học:
(a) Các orbital p vừa có khả năng xen phủ tạo liên kết s vừa có khả năng xen phủ tạo liên kết p tuỳ thuộc vào kiểu xen phủ.
(b) Liên kết cộng hoá trị không phân cực chỉ có thể tạo thành từ các nguyên tử của cùng một nguyên tố hoá học.
(c) Tất cả các nguyên tử khi tham gia tạo thành liên kết cộng hoá trị đều thoả mãn quy tắc octet.
(d) Hiệu độ âm điện giữa hai nguyên tử càng cao thì liên kết càng phân cực.
Khi đun nóng dung dịch sodium chloride bão hòa, thu được tinh thể sodium chloride khan. Sau đó, nung nóng đến khoảng 800 °C thì tinh thể sodium chloride chảy lỏng.
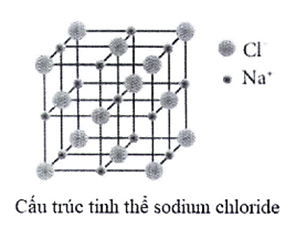
(a) Quá trình hình thành tinh thể sodium chloride ở trên được gọi là sự kết tinh.
(b) Quá trình hình thành tinh thể sodium chloride ở trên là quá trình sắp xếp lại các ion từ chuyển động tự do thành cấu trúc có trật tự trong tinh thể.
(c) Trong tinh thể sodium chloride, xung quanh 1 ion có 6 ion gần nhất.
(d) Tinh thể sodium chloride nóng chảy ở khoảng 800 °C, chứng tỏ lực liên kết giữa các ion trong tinh thể là yếu.
Liên kết được tạo nên từ sự xen phủ trục của hai AO gọi là liên kết sigma. Liên kết được tạo nên từ sự xen phủ bên của hai AO gọi là liên kết pi.
(a) Các AO s chỉ có khả năng xen phủ tạo liên kết .
(b) Các AO p không có khả năng xen phủ tạo liên kết .
(c) Liên kết bền vững hơn liên kết
.
(d) Liên kết có thể tạo thành từ sự xen phủ trục của hai AO khác loại.
Nguyên tử X có điện tích hạt nhân là +20. Khi hình thành liên kết hóa học X có xu hướng nhường đi bao nhiêu electron để đạt octet?
Cho các ion: Li+, Ca2+, O2-, Cl-. Số hợp chất ion (tạo nên từ một loại cation và một loại anion) từ các ion đã cho là bao nhiêu?
Cho các phân tử sau: NaCl, HCl, O2, N2, NH3, CO2, MgO. Có bao nhiêu phân tử có liên kết cộng hóa trị?
Trong công thức tổng số cặp electron lớp ngoài cùng của C và S chưa tham gia liên kết là?
Cho các phân tử sau: và Có bao nhiêu nguyên tử trong các phân tử trên đạt cấu hình electron bền của khí hiếm neon?
Nhiệt độ sôi của từng chất methane (CH4), ethane (C2H6), propane (C3H8) và butane (C4H10) là một trong bốn nhiệt độ sau: 0 oC; – 164 oC; – 42 oC và – 88 oC. Dựa trên kiến thức về liên kết hóa học, dự đoán nhiệt độ sôi của ethane là bao nhiêu oC?


