18 câu hỏi
Phần I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chọn một phương án.
Ở điều kiện thường, kim loại nào sau đây tồn tại ở thể lỏng?
Ag.
Hg.
Al.
Cu.
Trong phức chất, số liên kết σ (sigma) tạo thành giữa một phối tử với nguyên tử trung tâm được gọi là dung lượng phối trí của phối tử đó. Cấu tạo của phức chất [Cu(OH2)6]²⁺ hay [Cu(H2O)6]2+ được cho ở hình bên. Dung lượng phối trí của mỗi phối tử H2O trong phức chất đã cho là
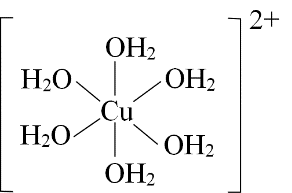
2.
6.
3.
1.
Trong phòng thí nghiệm, dung dịch chất nào sau đây phù hợp để kiểm tra sự có mặt của ion Ca²⁺(aq)?
HCl.
NaNO3.
NaCl.
Na2CO3.
Phản ứng điều chế ethanol từ ethene theo phương trình hóa học C2H4 + H2O ![]() C2H5OH là phản ứng
C2H5OH là phản ứng
hydrogen hoá.
trùng ngưng.
ester hoá.
hydrate hoá.
Từ phổ khối lượng, phân tử khối của ester X được xác định là 88. Công thức phù hợp với X là
CH3CH2OH.
CH3COOC2H5.
C3H7COOH.
HCOOC2H5.
Tên gọi theo danh pháp thay thế của chất có công thức cấu tạo CH3 – NH2 là
methanamine.
ethylamine.
methylamine.
ethanamine.
Trong phản ứng tách kim loại Cu từ CuSO₄ theo phương trình hoá học Zn(s) + CuSO₄(aq) → ZnSO₄(aq) + Cu(s), phương pháp tách kim loại nào sau đây đã được áp dụng?
Nhiệt luyện.
Thủy luyện.
Điện phân nóng chảy.
Điện phân dung dịch.
Cho các phát biểu sau về tính chất của methylamine:
(a) Methylamine làm giấy quỳ tím ẩm hóa đỏ.
(b) Methylamine phản ứng được với HCl trong dung dịch.
(c) Methylamine không phản ứng được với dung dịch FeCl3 ở điều kiện thường.
(d) Dung dịch methylamine phản ứng được với Cu(OH)2.
Số phát biểu đúng là
4.
3.
2.
1.
Cho thế điện cực chuẩn của Ag⁺/Ag và Zn2⁺/Zn lần lượt là ![]() = +0,799 V và
= +0,799 V và ![]() = –0,763 V. Sức điện động chuẩn của pin Galvani (
= –0,763 V. Sức điện động chuẩn của pin Galvani (![]() ) tạo bởi hai cặp oxi hóa – khử Ag⁺/Ag và Zn2⁺/Zn được tính theo công thức nào sau đây?
) tạo bởi hai cặp oxi hóa – khử Ag⁺/Ag và Zn2⁺/Zn được tính theo công thức nào sau đây?
![]() =
= ![]() –
– ![]() .
.
![]() =
= ![]() +
+ ![]()
![]() = –
= –![]() –
– ![]() .
.
![]() =
= ![]() –
– ![]() .
.
Phát biểu nào sau đây về fructose không đúng?
Fructose có công thức phân tử C6H12O6.
Fructose phản ứng được với Cu(OH)2 trong môi trường kiềm ở điều kiện thường.
Fructose thuộc loại monosaccharide.
Fructose làm mất màu nước bromine ở điều kiện thường.
Cho phản ứng thuận nghịch sau: H2(g) + I2 (g) ![]() 2HI(g). Ở trạng thái cân bằng, nồng độ (mol·L⁻¹) của H₂(g), I₂(g) và HI(g) được kí hiệu lần lượt là [H₂], [I₂] và [HI]. Biểu thức hằng số cân bằng Kc của phản ứng là
2HI(g). Ở trạng thái cân bằng, nồng độ (mol·L⁻¹) của H₂(g), I₂(g) và HI(g) được kí hiệu lần lượt là [H₂], [I₂] và [HI]. Biểu thức hằng số cân bằng Kc của phản ứng là
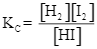
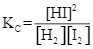
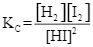
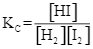
Số lượng phối tử trong phức chất [Co(NH3) 6]3⁺ là
6.
7.
3.
1.
Trong các phản ứng hữu cơ thường có sự tạo thành các tiểu phân trung gian hoạt động như gốc tự do, carbanion, carbocation. Carbocation là ion mang điện tích dương trên nguyên tử carbon. Có bao nhiêu carbocation trong số các tiểu phân ![]() ,
, ![]() ,
, ![]() và
và ![]() ?
?
3.
2.
1.
4.
“…(1)… là những hợp chất hữu cơ trong phân tử có nhóm hydroxy liên kết với nguyên tử carbon no”. Nội dung phù hợp trong chỗ trống (1) là
Ketone.
Phenol.
Aldehyde.
Alcohol.
Nhiệt tạo thành chuẩn (![]() ) của MgCO3(s), MgO(s) và CO2(g) lần lượt là –1096,0 kJ·mol⁻¹; –602,0 kJ·mol⁻¹ và –393,5 kJ·mol⁻¹.
) của MgCO3(s), MgO(s) và CO2(g) lần lượt là –1096,0 kJ·mol⁻¹; –602,0 kJ·mol⁻¹ và –393,5 kJ·mol⁻¹.
Biến thiên enthalpy chuẩn (![]() ) của phản ứng
) của phản ứng ![]() là bao nhiêu?
là bao nhiêu?
–100,5 kJ.
–494,0 kJ.
+494,0 kJ.
+100,5 kJ.
Silicon (Si) là chất bán dẫn quan trọng, được sử dụng rộng rãi trong chế tạo các vi mạch và thiết bị điện tử. Ở trạng thái cơ bản, cấu hình electron của nguyên tử Si (số hiệu nguyên tử bằng 14) là
1s²2s²2p⁶3s²3p¹.
1s²2s²2p⁶3s33p1.
1s²2s²2p⁶3p²3s².
1s²2s²2p⁶3s²3p².
Các công trình bằng thép (hợp kim của Fe và C) dễ bị ăn mòn điện hóa khi tiếp xúc với nước biển. Một trong số các phương pháp bảo vệ các công trình bằng thép khỏi sự ăn mòn điện hóa là gắn các khối nhôm (aluminium, Al), kẽm (zinc, Zn) hoặc hợp kim của chúng vào phần chìm dưới nước biển của công trình đó.
Cho các phát biểu sau về ăn mòn điện hóa và phương pháp bảo vệ đối với các công trình bằng thép nêu trên:
(a) Các khối nhôm hoặc khối kẽm bảo vệ thép theo phương pháp điện hóa.
(b) Khi thép bị ăn mòn điện hóa, sắt trong thép bị oxi hoá.
(c) Thép bị ăn mòn điện hóa mà không cần tiếp xúc với dung dịch chất điện li.
(d) Khi bảo vệ thép theo phương pháp điện hóa, nhôm hoặc kẽm đóng vai trò là cathode nên bị ăn mòn trước.
Số phát biểu đúng là
3.
2.
1.
4.
Các công trình bằng thép (hợp kim của Fe và C) dễ bị ăn mòn điện hóa khi tiếp xúc với nước biển. Một trong số các phương pháp bảo vệ các công trình bằng thép khỏi sự ăn mòn điện hóa là gắn các khối nhôm (aluminium, Al), kẽm (zinc, Zn) hoặc hợp kim của chúng vào phần chìm dưới nước biển của công trình đó.
Cho biết thế điện cực chuẩn của Na⁺/Na và Fe²⁺/Fe lần lượt là –2,713 V và –0,440 V. Khi thảo luận về phương pháp bảo vệ các công trình bằng thép nêu trên khỏi sự ăn mòn điện hóa, một học sinh đề xuất: “Có thể sử dụng khối kim loại natri (sodium, Na) thay thế cho các khối nhôm hoặc kẽm để bảo vệ các công trình bằng thép đó”. Một số nhận định đồng tình và không đồng tình về đề xuất này được đưa ra như sau:
(1) Sử dụng khối kim loại natri do kim loại này có tính khử mạnh hơn sắt.
(2) Có thể sử dụng khối kim loại natri do kim loại này và nhôm đều có khối lượng riêng nhỏ.
(3) Không thể sử dụng khối kim loại natri do kim loại này dễ phản ứng với nước biển.
(4) Không thể sử dụng khối kim loại natri do kim loại này có tính khử yếu hơn sắt.
Nhận định đúng là
nhận định (4).
nhận định (3).
nhận định (2).
nhận định (1).
