Bài tập ôn tập Hóa 12 Cánh diều Chủ đề 8 có đáp án
50 câu hỏi
Các electron hoá trị của nguyên tử nguyên tố kim loại chuyển tiếp dãy thứ nhất phân bố ở
phân lớp 3d và phân lớp 4s.
phân lớp 3d.
lớp 4s.
phân lớp 3p và phân lớp 3d.
Đặc điểm chung cấu hình electron của nguyên tử kim loại chuyển tiếp dãy thứ nhất là
[Ne]3d1÷104s1÷2.
[Ar]3d1÷104s1÷2.
[Ar]3d1÷104s2.
[Ar]3d104s1÷2.
Trong dãy kim loại chuyển tiếp thứ nhất, hai kim loại nào sau đây đều là kim loại nhẹ (D < 5g/cm3)?
Cr, Mn.
Fe, Co.
Sc, Ti.
Ni, Cu.
Trong dãy nguyên tử Sc, Ti, V, Cr bán kính nguyên tử thay đổi như thế nào?
Tăng dần.
Không đổi.
Giảm dần.
Không có quy luật.
Ion nào sau đây không có electron trên phân lớp 3d và không có màu trong dung dịch nước?
Fe3+.
Cr3+.
Ti3+.
Sc3+.
Muối nào sau đây vừa có khả năng thể hiện tính oxi hóa (trong môi trường acid), vừa có khả năng thể hiện tính khử (trong môi trường kiềm)?
K2Cr2O7.
Cr2(SO4)3.
K2CrO4.
Na2CrO4.
Trong dãy kim loại chuyển tiếp thứ nhất, kim loại có tính dẫn điện tốt nhất là
Fe.
Ti.
Cu.
Mn.
Nguyên tử Cr có cấu hình electron ở trạng thái cơ bản là [Ar]3d54s1. Trong phản ứng hóa học, khi nguyên tử Cr nhường đi 3 electron để tạo thành ion Cr3+, số electron còn lại trên phân lớp 3d là
5.
4.
3.
2.
Kim loại nào sau đây thuộc dãy kim loại chuyển tiếp thứ nhất?
Ti.
Al.
Ba.
Na.
Ở trạng thái cơ bản, cấu hình electron của nguyên tử nào sau đây có phân lớp 3d bão hòa?
Sc (Z = 21).
Cu (Z = 29).
Ni (Z = 28).
Mn (Z = 25).
Trong dãy kim loại chuyển tiếp thứ nhất, kim loại có độ cứng cao nhất là
Ti.
Fe.
Cr.
Cu.
Nguyên tố kim loại có trong hemoglobin làm nhiệm vụ vận chuyển oxygen, duy trì sự sống là
sodium.
magnesium.
nhôm.
sắt.
Theo thuyết Liên kết hoá trị, để trở thành phối tử trong phức chất thì phân tử hoặc anion cần có
các orbital trống.
cặp electron hoá trị riêng.
ít nhất 4 orbital trống.
ít nhất hai cặp electron hoá trị riêng.
Cho phát biểu sau: “Phức chất đơn giản thường có một ...(1)... liên kết với các phối tử bao quanh. Liên kết giữa nguyên tử trung tâm và phối tử trong phức chất là liên kết ...(2)....”. Cụm từ cần điền vào (1) và (2) lần lượt là
cation kim loại, ion.
nguyên tử kim loại, cho − nhận.
nguyên tử trung tâm, cho − nhận.
phối tử, ion.
Số lượng phối tử có trong mỗi phức chất[PtCl4]2− và [Fe(CO)5] là
4 và 5.
5 và 6.
5 và 2.
1 và 2.
Dạng hình học có thể có của phức chất [FeF6]3− là
Tứ diện.
Bát diện.
Vuông phẳng.
Tứ diện hoặc vuông phẳng.
Cho biết số lượng phối tử có trong phức chất [Cu(H2O)6]2+ là
2.
6.
4.
5.
Phát biểu nào dưới đây là sai?
Nguyên tử trung tâm là cation kim loại hoặc nguyên tử kim loại có orbital trống đã nhận cặp electron chưa liên kết của phối tử.
Phối tử cho cặp electron chưa liên kết vào orbital trống của nguyên tử trung tâm.
Phức lập phương chỉ biết đối với các ion có kích thước rất lớn so với kích thước phối tử.
Phức chất luôn mang điện tích dương hoặc âm.
Phân tử ethylamine (C2H5NH2) có số cặp electron chưa liên kết là
1.
2.
3.
4.
Nguyên tử trung tâm của phức [Co(NH3)6]3+ là ?
N.
Co.
Co3+.
NH3.
Công thức tổng quát của phức chất (với nguyên tử trung tâm M và phối tử L) có dạng tứ diện và bát diện lần lượt là
[ML2] và [ML4].
[ML4] và [ML6].
[ML6] và [ML2].
[ML6] và [ML4].
Nguyên tử trung tâm của các phức chất [PtCl4]2- và [Fe(CO)5] lần lượt là
Pt4+ và Fe2+.
Pt2+ và Fe2+.
Cl và CO.
Pt2+ và Fe.
Phức chất [Cu(H2O)6]2+ có dạng hình học là
vuông phẳng.
tứ diện.
bát diện.
đường thẳng.
Điện tích của nguyên tử trung tâm trong phức chất [Co(NH3)6]3+ và [FeF6]3- lần lượt là
+3 và +3.
+3 và +2.
+6 và -6.
+3 và -3.
Phức chất [Cu(H2O)6]2+có màu xanh; phức chất [Cu(NH3)4(H2O)2] có màu xanh lam và phức chất [CuCl4]2− có màu vàng. Màu sắc của ba phức chất khác nhau là do chúng khác nhau về
nguyên tử trung tâm.
phối tử.
cả nguyên tử trung tâm và phối tử.
số lượng phối tử.
Phối tử H2O trong phức chất aqua [Cu(H2O)6]2+ có thể bị thế bởi 1 phối tửNH3 tạo thành phức chất là
[Cu(NH3)6]2+.
[Cu(NH3)2(H2O)5].
[Cu(NH3)(H2O)5]2+.
[Cu(NH3)(H2O)5].
Cho lượng dư dung dịch NH3 tác dụng với AgCl. Phát biểu nào sau đây đúng?
Kết tủa trắng tan dần, phức chất [Ag(NH3)2]+ không màu được tạo thành.
Không có hiện tượng gì xảy ra.
Kết tủa trắng tan dần, phức chất [Ag(NH3)2]+ màu xanh được tạo thành.
Kết tủa trắng tan dần, phức chất [Ag(NH3)2]+ không màu được tạo thành.
Cho phát biểu sau: “Khi tan trong nước, muối của các kim loại chuyển tiếp …(1)… thành các ion. Sau đó, cation kim loại chuyển tiếp (Mn+) thường nhận các cặp electron hoá trị riêng từ các phân tử H2O để hình thành các liên kết cho − nhận, tạo ra phức chất aqua có dạng tổng quát là ...(2)....”
Cụm từ cần điền vào (1) và (2) lần lượt là
điện li, [M(H2O)n]+.
điện li, [M(H2O)m]n+.
phân li,[M(H2O)m]n+.
phân li, [M(H2O)n]+.
Khi cho dung dịch ammonia dư vào dung dịch chứa phức [Ni(H2O)6]2+ và ion Cl− thì có phản ứng sau:
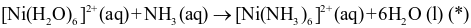 .
.
Phát biểu nào dưới đây là sai?
Phản ứng (*) là phản ứng thế phối tử.
Dung dịch sau phản ứng có pH > 7.
Trong phản ứng không có sự thay đổi số oxi hóa của các nguyên tố.
Trong điều kiện của phản ứng (*) phức chất [Ni(NH3)6]2+ kém bền hơn phức chất [Ni(H2O)6]2+.
Dung dịch phức chất aqua không thể có màu xanh là
[Cr(H₂O)6]3+.
[Zn(H₂O)6]2+.
[Ni(H₂O)6]2+.
[Cu(H₂O)6]2+.
Tiến hành thí nghiệm sau:
Bước 1: Cho vào ống nghiệm thứ nhất 10 ml dung dịch CuSO4 0,1 M, ống nghiệm thứ hai 10 ml FeCl3 0,1 M.
Bước 2: Nhỏ khoảng 4−6 giọt dung dịch NaOH 0,1 M vào 2 ống nghiệm.
Phát biểu nào sau đây đúng?
(a) Ở cả 2 ống nghiệm dung dịch không màu.
(b) Ở cả 2 ống nghiệm đều xuất hiện kết tủa trắng.
(c) Ống nghiệm thứ xuất có kết tủa màu xanh lam, ống nghiệm thứ 2 có kết tủa màu nâu đỏ.
(d) Ống nghiệm thứ xuất có kết tủa màu nâu đỏ, ống nghiệm thứ 2 có kết tủa màu xanh lam.
Muối CuSO4 khan là chất bột màu trắng.
(a) Dung dịch CuSO4 tạo kết tủa màu xanh khi cho tác dụng với dung dịch NaOH.
(b) Khi hòa tan vào nước, dung dịch CuSO4 có màu xanh lam.
(c) Muối CuSO4 khan hấp thụ nước chuyển thành dạng hydrate có công thức là CuSO4.2H2O.
(d) Nhỏ từ từ đến dư dung dịch NH3 vào dung dịch CuSO4 thu được kết tủa màu xanh lam.
Ở trạng thái cơ bản, nguyên tử Cr có cấu hình electron là [Ar]3d54s1
(a) Nguyên tố chromium thuộc chu kì 4, nhóm VIB trong bảng tuần hoàn
(b) Chromium là kim loại nhẹ, có nhiệt độ nóng chảy thấp
(c) Chromium là kim loại chuyển tiếp dãy thứ nhất
(d) Nguyên tử chromium có số oxi hóa cao nhất là +3 trong các hợp chất
Ở điều kiện thường, tinh thể K và tinh thể Cr đều có cấu trúc lập phương tâm khối. Biết một số thông số của kim loại K và Cr được cho ở bảng sau:
| Tính chất | K | Cr |
| Bán kính nguyên tử (pm) | 227 | 128 |
| Nhiệt độ nóng chảy (oC) | 63,3 | 1900 |
| Khối lượng riêng (g/cm3) | 0,862 | 7,19 |
| Độ cứng (kim cương – 10) | 0,5 | 8,5 |
(a) Tinh thể Cr có liên kết kim loại mạnh hơn tinh thể K
(b) Trong cùng một đơn vị thể tích thì khối lượng kim loại trong tinh thể Cr và K bằng nhau
(c) Nguyên tử Cr có bán kính nhỏ hơn nguyên tử K vì nguyên tử Cr có số lớp electron ít hơn.
(d) K là kim loại nhẹ và Cr là kim loại nặng.
Một phức chất có công thức [Fe(H2O)6](NO3)3
(a) Nguyên tử trung tâm là cation Fe2+.
(b) Phối tử là 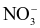 .
.
(c) Trong phức chất trên nguyên tử Fe chiếm 16% về khối lượng.
(d) Tỉ lệ khối lượng của phối tử và nguyên tử trung tâm là 14 : 27.
Khi cho copper(II) hydroxide vào dung dịch NH3 dư thì hình thành phức vuông phẳng với các phối tử là NH3.
(a) Công thức của phức trên là [Cu(NH3)4](OH)2.
(b) Trong phức trên NH3 là phối tử còn Cu2+ là nguyên tử trung tâm.
(c) Khi hình thành liên kết các phân tử NH3 đã nhận cặp electron tự do của Cu2+.
(d) [Cu(NH3)4](OH)2 là chất kết tủa màu xanh thẫm.
Xét phức chất [CoCl2(NH3)4]+
(a) Nguyên tử trung tâm trong phức chất là CO2+.
(b) Các phối tử có trong phức chất là Cl– và NH3 .
(c) Số lượng phối tử trong phức chất là 6.
(d) Điện tích của phức chất là +3.
Xét phức chất [Ni(NH3)6]2+
(a) Phức chất có thể có dạng hình học tứ diện hoặc vuông phẳng.
(b) Liên kết trong phức chất được hình thành là do phối tử NH3 cho cặp eletron chưa liên kết vào nguyên tử trung tâm Ni+.
(c) Nguyên tử trung tâm trong phức là Ni2+.
(d) Điện tích của phức chất là +2.
Xét phản ứng: [PtCl4]2− + 2NH3 → [PtCl2(NH3)2] + 2Cl−.
(a) Trong phản ứng trên có 1 phối tử Cl− trong phức chất [PtCl4]2− đã bị thay thế bởi phối tử NH3.
(b) Phức chất [PtCl2(NH3)2] kém bền hơn phức chất [PtCl4]2−.
(c) Phức chất [PtCl2(NH3)2] có dạng bát diện.
(d) Phức chất [PtCl4]2− có nguyên tử trung tâm là Pt và số liên kết phối trí là 4.
Cho các phát biểu sau về phức chất:
(a) Trong dung dịch, các ion kim loại chuyển tiếp đều tạo phức chất aqua.
(b) Các phối tử H2O trong phức chất aqua không thể bị thế bởi các phối tử khác.
(c) Phức chất aqua của các ion kim loại chuyển tiếp hầu hết có dạng hình học bát diện.
(d) Các phối tử trong phức chất có thể bị thay thế một phần hoặc thay thế hết bởi các phối tử khác.
Cho phức chất [PtCl4]2−, nguyên tử trung tâm Pt tạo bao nhiêu liên kết với phối tử Cl−?
Nguyên tử trung tâm trong phức chất [Cu(H2O)]2+ mang bao nhiêu điện tích dương?
Cu có số hiệu nguyên tử là 29. Nguyên tử Cu có bao nhiêu electron trên phân lớp 3d?
Xác định độ tinh khiết của 1 mẫu quặng hematite (Fe2O3) biết rằng trong 5 kg quặng chứa 2,78 kg sắt. (Làm tròn kết quả đến hàng phần mười).
Ở 20oC, độ tan của CuSO4.5H2O trong nước là 32g trong 100g nước. Ở nhiệt độ này, dung dịch CuSO4 bão hòa có nồng độ là a%. Giá trị của a là bao nhiêu?
Dung dịch FeCl3 có môi trường acid do sự thủy phân của ion Fe3+ theo phản ứng đơn giản hóa:
Fe3+ (aq) + H2O (l) ⇌ [Fe(OH)]2+ (aq) + H+(aq) Ka = 10-2,19
Gía trị pH của dung dịch FeCl3 0,1M là
Một mẫu chất có thành phần chính là muối Mohr. Muối Mohr có công thức hoá học là (NH4)2SO4.FeSO4.6H2O. Hoà tan 0,2151 g mẫu chất trong dung dịch sulfuric acid loãng dư, thu được dung dịch có chứa cation Fe2+. Lượng Fe2+ trong dung dịch này phản ứng vừa đủ với 5,40 mL dung dịch thuốc tím nồng độ 0,020 M (Các chất và ion khác trong dung dịch không phản ứng với thuốc tím). Xác định số mg sắt có trong mẫu chất?
Phức chất [MAxBy] có dạng hình học vuông phẳng. Ở đó M là nguyên tử trung tâm, x và y là số phối tử của A và B. Giá trị của x + y là bao nhiêu?
Phức chất [Pt(NH3)4]2+ có thể bị thế bởi 1 phối tử Cl-. Phức chất tạo thành có điện tích là bao nhiêu?
Muối Mohr có công thức (NH4)2Fe(SO4)2.6H2O. Để xác định độ tinh khiết của một loại muối Mohr (Cho rằng trong muối Mohr chỉ có muối kép ngậm nước nêu trên và tạp chất trơ), một học sinh tiến hành các thí nghiệm sau: Cân chính xác 7,237 gam muối Mohr, pha thành 100 mL dung dịch X. Lấy chính xác 10 mL dung dịch X, thêm 10 mL dung dịch H2SO4 10%, được dung dịch Y. Chuẩn độ dung dịch Y bằng dung dịch chuẩn KMnO4 0,023M. Thực hiện chuẩn độ 3 lần. Kết quả đạt được như sau:
| Lần chuẩn độ | 1 | 2 | 3 |
| V dung dịch KMnO4 (ml) | 16,0 | 16,1 | 16,0 |
Theo kết quả chuẩn độ ở trên, hãy tính độ tinh khiết (% khối lượng (NH4)2Fe(SO4)2.6H2O) của muối Mohr? (Làm tròn kết quả đến hàng phần mười)


