30 câu hỏi
Chọn những câu đúng: Về phương diện nhiệt động hóa học:
1) Đa số phản ứng có thể xảy ra tự phát hoàn toàn khi ΔG0puΔGpu0 < -40 kJ.
2) Phản ứng không xảy ra tự phát trong thực tế khi ΔG0puΔGpu0 > 40 kJ.
3) Phản ứng không xảy ra tự phát trong thực tế khi ΔG0puΔGpu0 > 0.
4) Đa số các phản ứng có thế đẳng áp tiêu chuẩn nằm trong khoảng -40 kJ < ΔG0puΔGpu0 < 40 kJ xảy ra tự phát thuận nghịch trong thực tế.
1, 3
3, 4
1, 2, 4
1, 2, 3, 4
Chọn phát biểu đúng: Đối với phản ứng một chiều, tốc độ phản ứng sẽ:
Giảm dần theo thời gian cho đến khi bằng không.
Không đổi theo thời gian.
Giảm dần theo thời gian cho đến khi bằng một hằng số khác không.
Tăng dần theo thời gian.
Chọn phát biểu đúng. Phản ứng thuận nghịch là:
(1) Phản ứng có thể xảy ra theo chiều thuận hay theo chiều nghịch tùy điều kiện phản ứng.
(2) Phản ứng xảy ra đồng thời theo hai chiều ngược nhau trong cùng một điều kiện.
(3) Phản ứng tự xảy ra cho đến khi hết các chất phản ứng.
1
2
3
1 và 2
Chọn phát biểu đúng về hệ cân bằng:
Hệ cân bằng là hệ trong đó có tỉ lệ thành phần các chất không thay đổi khi ta thay đổi các điều kiện khác.
Hệ đang ở trạng thái cân bằng là hệ có các giá trị thông số trạng thái (nhiệt độ, áp suất, nồng độ,…) không thay đổi theo thời gian.
Hệ cân bằng là hệ có nhiệt độ và áp suất xác định.
Hệ cân bằng là hệ có nồng độ tất cả các chất đều bằng nhau.
Kết luận nào dưới đây là đúng khi một phản ứng thuận nghịch có DG° < 0:
Hằng số cân bằng của phản ứng lớn hơn 0.
Hằng số cân bằng của phản ứng nhỏ hơn 1.
Hằng số cân bằng của phản ứng lớn hơn 1.
Hằng số cân bằng của phản ứng nhỏ hơn 0.
Cho phản ứng aA (l) + bB (k) ⇌ cC (k) + dD (l), có hằng số cân bằng Kc. Chọn phát biểu đúng:
(1) DG = DG° + RTlnKc , khi DG = 0 thì DG° = -RTlnKc.
(2) Hằng số cân bằng Kc tính bằng biểu thức: Kc=CCc.CdDCaA.CbBKc=CcC.CDdCAa.CBb, Với CA, CB , CC và CD là nồng độ các chất tại lúc đang xét.
(3) Phản ứng luôn có KP = KC(RT)Dn với Dn = Snsp-Sncđ của tất cả các chất không phụ thuộc vào trạng thái tồn tại của chúng.
1
2
3
Không có phát biểu nào chính xác
Giả sử hệ đang ở cân bằng, phản ứng nào sau đây được coi là đã xảy ra hoàn toàn:
FeO (r) + CO (k) = Fe (r) + CO2 (k) KCb = 0,403
2C (r) + O2 (k) = 2CO (k) KCb = 1 ×1016
2Cl2 (k) + 2 H2O (k) = 4 HCl (k) + O2 (k) KCb = 1,88 × 10-15
CH3CH2CH2CH3 (k) = CH3CH(CH3)2 (k) KCb = 2,5
Cho một phản ứng thuận nghịch trong dung dịch lỏng A + B ⇌ C + D. Hằng số cân bằng Kc ở điều kiện cho trước bằng 200. Một hỗn hợp có nồng độ CA = CB = 10-3M, CC = CD = 0,01M. Trạng thái của hệ ở điều kiện này:
Hệ đang dịch chuyển theo chiều nghịch.
Hệ nằm ở trạng thái cân bằng.
Hệ đang dịch chuyển theo chiều thuận.
Không thể dự đoán được trạng thái của phản ứng.
Phản ứng CaCO3 (r) ⇌ CaO (r) + CO2 (k) có hằng số cân bằng Kp = PCO2. Áp suất hơi của CaCO3, CaO không có mặt trong biểu thức Kp vì:
Có thể xem áp suất hơi của CaCO3 và CaO bằng 1 atm.
Áp suất hơi của chất rắn không đáng kể.
Áp suất hơi của CaCO3 và CaO là hằng số ở nhiệt độ xác định.
Áp suất hơi chất rắn không phụ thuộc vào nhiệt độ.
Chọn phương án đúng: Phản ứng C(gr) + CO2 (k) ⇌ 2CO(k) ở 815°C có hằng số cân bằng Kp = 10. Tại trạng thái cân bằng, áp suất chung của hệ là P = 1atm. Hãy tính áp suất riêng phần của CO tại cân bằng.
0,85 atm
0,72 atm
0,68atm
0,92 atm
Chọn phát biểu đúng: cho phản ứng A (dd) + B (dd) ⇌ C(dd) + D (dd). Nồng độ ban đầu của mỗi chất A, B, C, D là 1,5 mol/l. Sau khi cân bằng được thiết lập, nồng độ của C là 2 mol/l. Hằng số cân bằng Kc của hệ này là:
0,25
1,5
4
2,0
Chọn phương án đúng: Xác định công thức đúng để tính hằng số cân bằng KP của phản ứng: Fe3O4(r) + 4CO(k) ⇌ 3Fe(r) + 4CO2(k).
Kp=(P4CO2[Fe]3P4CO[Fe3O4])cbKp=(PCO24[Fe]3PCO4[Fe3O4])cb
Kp=([Fe]3[CO2]4[Fe3O4][CO]4)cbKp=([Fe]3[CO2]4[Fe3O4][CO]4)cb
Kp=(P4CO2P4CO)cbKp=(PCO24PCO4)cb
Kp=(PCO2PCO)cbKp=(PCO2PCO)cb
Xác định công thức đúng để tính hằng số cân bằng KC của phản ứng: SCl2(dd) + H2O(ℓ) ⇌ 2HCl(dd) + SO(dd)
K=([HCl]2[SO][SCl2])cbK=([HCl]2[SO][SCl2])cb
K=([SCl2][H2O][HCl][SO])cbK=([SCl2][H2O][HCl][SO])cb
K=([HCl][SO][SCl2][H2O])cbK=([HCl][SO][SCl2][H2O])cb
K=([HCl]2[SO][SCl2][H2O])cbK=([HCl]2[SO][SCl2][H2O])cb
Chọn phát biểu đúng: Phản ứng H2 (k) + ½ O2 (k) ⇌ H2O (k) có DG0298DG2980 = -54,64 kcal. Tính Kp ở điều kiện tiêu chuẩn. Cho R = 1,987 cal/mol.K.
Kp = 40,1
Kp = 1040,1
Kp = 1092,3
Kp = 92,3
Ở một nhiệt độ xác định, phản ứng: S (r) + O2 (k) ⇌ SO2 (k) có hằng số cân bằng KC = 4,2×1052. Tính hằng số cân bằng K’C của phản ứng SO2 (k) ⇌ S (r) + O2 (k) ở cùng nhiệt độ.
2,38 × 1053
4,2 × 10-52
4,2 × 10-54
2,38 × 10-53
Ở 46°C, cân bằng N2O4(k) ⇌ 2NO2(k) có hằng số cân bằng Kp = 0,66. Tính % phân ly của N2O4 ở 46°C và áp suất tổng bằng 0,5 atm.
80%
50%
75%
66,67%
Trong các phản ứng sau, trường hợp nào là hệ dị thể:
1) C6H5ONa(dd) + HCl(dd) = C6H5OH(ℓ) + NaCl(dd)
2) 2NaOH(dd) + H2SO4(dd) = Na2SO4(dd) + 2H2O(ℓ)
3) CH3COOCH3(dd) + H2O(ℓ) = CH3COOH(dd) + CH3OH(dd)
4) 2Al(r) + Fe2O3(r) = Al2O3(r) + 3Fe(r)
5) C (kim cương) = C (graphit)
1, 2, 3
2, 3, 5
1, 4, 5
1, 2, 3, 4, 5
Dung dịch của NaCl trong nước nằm cân bằng với NaCl rắn ở áp suất không đổi (P = const). Số cấu tử và bậc tự do của hệ lần lượt là:
2 và 1
2 và 0
3 và 2
2 và 2
Nước nguyên chất có thể tồn tại ở 9 pha khác nhau là: khí, lỏng và 7 dạng thù hình của nước đá (rắn). Tính số pha tối đa của nước có thể đồng thời nằm cân bằng với nhau.
2
4
5
3
Trong giản đồ trạng thái của một hợp chất được biểu diễn theo nhiệt độ và áp suất có xuất hiện điểm ba. Bậc tự do của hệ tại vị trí điểm ba này bằng:
0
1
2
Không thể xác định
Tính bậc tự do của hệ sau khi đang ở trạng thái cân bằng ở điều kiện áp suất không đổi: CaO(r) + SiO2(r) ⇌ CaSiO3(r)
1
0
2
3
Chọn phương án đúng: Xét cân bằng: H2O(lỏng) ⇌ H2O(hơi). Số bậc tự do của hệ hơi nước cân bằng với nước lỏng là:
1
2
3
0
Số cấu tử của hệ phản ứng: BaSO4(r) = BaO(r) + SO2(k) + O2(k) là:
1
2
3
4
Số bậc tự do của hệ phản ứng: Ca(OH)2(r) = CaO(r) + H2O(k) là:
2
3
4
1
Chọn phát biểu đúng về tính chất của điểm ơtecti (điểm E) trong giản đồ nóng chảy hệ hai kim loại A – B.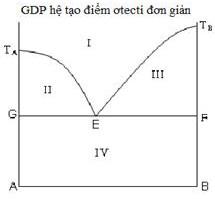
1) Hệ tại E, tùy theo cách điều chỉnh nhiệt độ ta có thể thu được A tinh khiết hoặc B tinh khiết.
2) Hệ tại E có bậc tự do bằng 0 (hệ vô biến).
3) Quá trình tại E xảy ra ở nhiệt độ không đổi vì lượng nhiệt phát ra khi kết tinh đã bù trừ cho lượng nhiệt của hệ mất đi khi làm lạnh.
4) Nhiệt độ tại E có giá trị cao nhất trong các nhiệt độ bắt đầu kết tinh của các hỗn hợp A – B khác nhau.
1, 2
2, 3
3, 4
1, 4
Chọn đáp án sai:
Hệ có số bậc tự do bằng 0, tập hợp các pha trong hệ có dạng hình học là một đường thẳng.
Hệ có số bậc tự do bằng 0, tập hợp các pha trong hệ có dạng hình học là một điểm.
Hệ có số bậc tự do bằng 1, tập hợp các pha trong hệ có dạng hình học là một đường thẳng.
Hệ có số bậc tự do bằng 2, tập hợp các pha trong hệ có dạng hình học là một mặt phẳng.
Trong giản đồ pha sau, có bao nhiêu điểm ơtecti: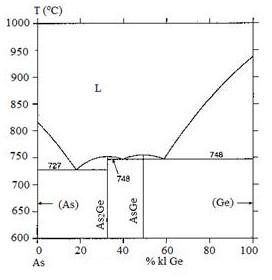
1
2
3
4
Trong giản đồ sau có các vùng I, II, III, IV, V. Hãy xác định vùng kết tinh của rắn A.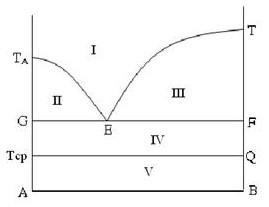
Vùng III
Vùng I
Vùng IV
Vùng II
Chọn phương án đúng: Số pha của hệ phản ứng: BaSO4(r) ⇌ BaO(r) + SO2(k) + O2(k) là:
3
2
1
4
Chọn phương án đúng: Xét hệ cân bằng gồm ba chất có mặt trong phản ứng sau: CaCO3(r) ⇌ CaO(r) + CO2(k):
Hệ có số cấu tử là 2, số pha là 2, số bậc tự do là 2
Hệ có số cấu tử là 2, số pha là 3, số bậc tự do là 1
Hệ có số cấu tử là 3, số pha là 3, số bậc tự do là 2
Hệ có số cấu tử là 3, số pha là 3, số bậc tự do là 1
