31 câu hỏi
Sự phân bố electron trên các phân lớp thuộc các lớp electron dựa vào nguyên lí hay quy tắc nào sau đây?
Nguyên lí vững bền và nguyên lí PauliB. Nguyên lí vững bền và quy tắc HundC. Nguyên lí Pauli và quy tắc HundD. Nguyên lí vững bền và quy tắc Pauli
Sự phân bố electron trên các phân lớp thuộc các lớp electron dựa vào nguyên lí hay quy tắc nào sau đây?
Nguyên lí vững bền và nguyên lí Pauli
Nguyên lí vững bền và quy tắc Hund
Nguyên lí Pauli và quy tắc Hund
Nguyên lí vững bền và quy tắc Pauli
Sự phân bố electron trên các phân lớp thuộc các lớp electron dựa vào nguyên lí hay quy tắc nào sau đây?
Nguyên lí vững bền và nguyên lí Pauli
Nguyên lí vững bền và quy tắc Hund
Nguyên lí Pauli và quy tắc Hund
Nguyên lí vững bền và quy tắc Pauli
Nguyên tử F có 9 electron. Theo mô hình Rutherford – Bohr, tỉ lệ số lượng electron trên lớp thứ hai so với số lượng electron trên lớp thứ nhất là
2: 12.
7: 2.
5: 2.
2: 7.
Nguyên tử O có 8 electron. Theo mô hình Rutherford – Bohr, nguyên tử O có số electron có cùng năng lượng ở lớp thứ nhất là
2.
4.
6.
8.
Sự phân bố electron theo orbital nào dưới đây là đúng?
A. ![]() .
.
B. ![]() .
.
C. ![]() .
.
D. ![]() .
.
Cho các cách biểu diễn electron vào các orbital của phân lớp 2p ở trạng thái cơ bản như hình dưới đây.
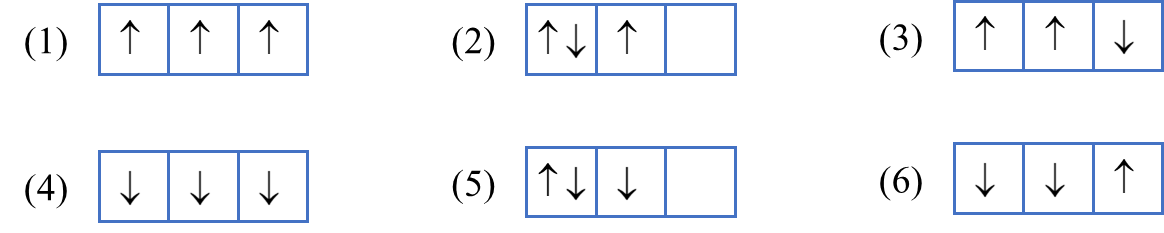
Cách phân bố đúng là
(1), (2).
(2), (3), (4).
(5), (6).
(1).
Cấu hình electron nào sau đây viết sai?
1s²2s²2p⁵.
1s²2s²2p⁶3s²3p⁶4s¹.
1s²2s²2p⁶3s²3p⁶4s²4p⁵.
1s²2s²2p⁶3s²3p⁶3d³4s².
Chọn cấu hình electron không đúng?
1s²2s²2p⁵.
1s²2s²2p⁶3s².
1s²2s²2p⁶3s²3p⁵.
1s²2s²2p⁶3s²3p³4s².
Ở trạng thái cơ bản, cấu hình electron của nguyên tử sodium (Z = 11) là
1s²2s²2p⁵3s².
1s²2s²2p⁶3s¹.
1s²2s²2p⁶3s².
1s²2s²2p⁴3s¹.
Các nguyên tử Ne, Na và F có Z lần lượt là 10, 11 và 9. Cấu hình electron của Ne, Na và F tương ứng là
1s²2s²2p⁶; 1s²2s²2p⁶3s¹ và 1s²2s²2p⁵.
đều có cấu hình 1s²2s²2p⁶.
1s²2s²2p⁶; 1s²2s²2p⁵ và 1s²2s²2p⁴.
1s²2s²2p⁶; 1s²2s²2p⁵ và 1s¹2s²2p³.
Cấu hình electron của nguyên từ Al (Z = 13) là
1s²2s²2p⁶3p³.
1s²2s²2p⁵3s²3p².
1s²2s²2p⁶2d³.
1s²2s²2p⁶3s²3p¹.
Nguyên tố nào sau đây mà nguyên tử có 3 electron ở lớp ngoài cùng?
Na.
Al.
Cl.
Ar.
Ion X⁻ của nguyên tố X có số hiệu nguyên tử là 17. Cấu hình electron của X⁻ là
1s²2s²2p⁶3s²3p⁵.
1s²2s²2p⁶3s²3p⁶.
1s²2s²2p⁶3s²3p⁴.
1s²2s²2p⁶3s²3p³.
Nguyên tử của nguyên tố M có số hiệu nguyên tử bằng 20. Cấu hình electron của ion M²⁺ là
1s²2s²2p⁶3s²3p⁶.
1s²2s²2p⁶3s²3p⁶4s¹.
1s²2s²2p⁶3s²3p⁶3d¹.
1s²2s²2p⁶3s²3p⁶4s².
Nguyên tử O có 8 electron. Biểu diễn sự sắp xếp electron trong nguyên tử O theo orbital nào sau đây là đúng?
A. ![]() .
.
B. ![]() .
.
C. ![]() .
.
D. ![]() .
.
Trong các nguyên tử N (Z = 7), O (Z = 8), F (Z = 9) và Ne (Z = 10), nguyên tử có nhiều electron độc thân nhất là
N.
F.
Ne.
O.
Số lượng electron độc thân của nguyên tử S (Z = 16) là
1.
2.
6.
0.
Nguyên tử của nguyên tố M có cấu hình electron là 1s²2s²2p⁴. Số electron độc thân của M là
3.
2.
1.
0.
Nguyên tử của nguyên tố phosphorus (Z = 15) có số electron độc thân là
1.
2.
3.
4.
Nguyên tử nguyên tố X có hai lớp electron, trong đó có một electron độc thân. Vậy nguyên tố X có thể là
Li.
F.
Na.
Li và F.
Nguyên tử nitrogen (N) có 2 lớp electron trong đó có 2 phân lớp s và 1 phân lớp p. Các phân lớp s đều chứa số electron tối đa, còn phân lớp p chỉ chứa một nửa số electron tối đa. Số electron có trong nguyên tử nitrogen là
7.
14.
4.
6.
Lithium (Z = 3) là một nguyên tố có nhiều công dụng, được sử dụng trong chế tạo máy bay và trong một số loại pin nhất định. Pin Lithium-Ion (Li-Ion) đang ngày càng phổ biến, nó cung cấp năng lượng cho cuộc sống của hàng triệu người mỗi ngày thông qua các thiết bị như máy tính xách tay, điện thoại di động, xe Hybrid, xe điện,… nhờ trọng lượng nhẹ, cung cấp năng lượng cao và khả năng sạc lại. Tính chất hóa học cơ bản của lithium là
kim loại.
phi kim.
khí hiếm.
vừa kim loại vừa phi kim.
Nguyên tử của nguyên tố nào sau đây có 3 electron thuộc lớp ngoài cùng?
\(_{11}^{23}Na\).
\(_7^{14}N\).
\(_{13}^{27}Al\).
\(_6^{12}C\).
Có bao nhiêu electron thuộc phân lớp p trong cấu hình electron của nguyên tử Al (Z = 13)?
1.
2.
6.
7.
Nguyên tố có Z = 11 thuộc loại nguyên tố
s.
p.
d.
f.
Cấu hình electron nào sau đây của nguyên tố kim loại?
1s²2s²2p⁶3s²3p⁶.
1s²2s²2p⁶3s²3p⁵.
1s²2s²2p⁶3s²3p³.
1s²2s²2p⁶3s²3p¹.
X được dùng làm chất bán dẫn trong kĩ thuật vô tuyến điện, chế tạo pin mặt trời. Nguyên tử của nguyên tố X có 3 lớp electron. Lớp ngoài cùng có 4 electron. Cấu hình electron của X là
1s²2s²2p⁶3s²3p³.
1s²2s²2p⁶3s²3p⁵.
1s²2s²2p⁶3s²3p².
1s²2s²2p⁵3s²3p⁴.
Các electron của nguyên tử nguyên tố X được phân bố trên 3 lớp, lớp thứ ba có 6 electron. Số đơn vị điện tích hạt nhân nguyên tử của nguyên tố X là
6.
8.
14.
16.
Ở trạng thái cơ bản, nguyên tử của nguyên tố X có 4 electron ở lớp L (lớp thứ hai). Số proton có trong nguyên tử X là
7.
6.
8.
5.
Cấu hình electron ở trạng thái cơ bản của nguyên tử nguyên tố X có tổng số electron trong các phân lớp p là 8. Nguyên tố X là
Si (Z = 14).
O (Z = 8).
Al (Z = 13).
Cl (Z = 17).
