40 câu hỏi
Phản ứng nào sau đây là phản ứng tỏa nhiệt?
Phản ứng nhiệt phân muối KNO3.
Phản ứng phân hủy khí NH3.
Phản ứng oxi hóa glucose trong cơ thể.
Phản ứng hòa tan NH4Cl trong nước.
Phản ứng nào sau đây có thể tự xảy ra ở điều kiện thường?
Phản ứng nhiệt phân Cu(OH)2.
Phản ứng giữa H2 và O2 trong hỗn hợp khí.
Phản ứng giữa Zn và dung dịch H2SO4.
Phản ứng đốt cháy ethanol.
Phương trình nhiệt hóa học là
phương trình phản ứng hóa học xảy ra trong điều kiện cung cấp nhiệt độ.
phương trình phản ứng hóa học có kèm theo nhiệt phản ứng.
phương trình phản ứng hóa học có kèm theo nhiệt phản ứng và trạng thái của các chất đầu và sản phẩm.
phương trình phản ứng hóa học tỏa nhiệt ra môi trường.
Phản ứng nào sau đây là phản ứng tỏa nhiệt?
Phản ứng nhiệt phân thuốc tím (KMnO4).
Phản ứng nhiệt phân Fe(OH)3.
Phản ứng đốt cháy cồn (ethanol).
Phản ứng nung NH4Cl(s)tạo ra NH3(g)và HCl(g).
Những ngày nóng nực, pha viên sủi vitamin C vào nước để giải khát, khi viên sủi tan, thấy nước trong cốc mát hơn đó là do
xảy ra phản ứng thu nhiệt.
cảy ra phản ứng tỏa nhiệt.
xảy ra phản ứng trao đổi chất với môi trường.
vó sự giải phóng nhiệt lượng ra ngoài môi trường.
Biến thiên enthalpy của phản ứng nào sau đây có giá trị âm?
Phản ứng tỏa nhiệt.
Phản ứng thu nhiệt.
Phản ứng oxi hóa – khử.
Phản ứng phân hủy.
Phát biểu nào sau đây là không đúng?
Biến thiên enthalpy càng âm, phản ứng tỏa ra càng nhiều nhiệt.
Biến thiên enthalpy càng dương, phản ứng thu vào càng nhiều nhiệt.
Với phản ứng tỏa nhiệt, năng lượng của hệ chất phản ứng cao hơn năng lượng của hệ sản phẩm.
Với phản ứng thu nhiệt, năng lượng của hệ chất phản ứng cao hơn năng lượng của hệ sản phẩm.
Vì sao khi nung vôi, người ta phải xếp đá vôi lẫn với than trong lò?
Vì phản ứng nung vôi là phản ứng tỏa nhiệt.
Vì phải ứng nung vôi là phản ứng thu nhiệt, cần nhiệt từ quá trình đốt cháy than.
Để rút ngắn thời gian nung vôi.
Vì than hấp thu bớt lượng nhiệt tỏa ra của phản ứng nung vôi.
Các phản ứng tỏa nhiệt thường diễn ra
thuận lợi hơn các phản ứng thu nhiệt.
khó khăn hơn các phản ứng thu nhiệt.
thuận lợi hơn khi càng tỏa nhiều nhiệt.
thuận lợi hơn khi càng tỏa ít nhiệt.
Phản ứng nào trong các phản ứng dưới đây là phản ứng thu nhiệt?
Vôi sống tác dụng với nước: CaO + H2O ![]() Ca(OH)2.
Ca(OH)2.
Đốt cháy than: C + O2 ![]() CO2.
CO2.
Đốt cháy cồn: C2H5OH + 3O2 ![]() 2CO2 + 3H2O.
2CO2 + 3H2O.
Nung đá vôi: CaCO3 ![]() CaO + CO2.
CaO + CO2.
Cho 2 phương trình nhiệt hóa học sau:
(1) C(s) + H2O(g) ![]() CO(g) + H2(g);
CO(g) + H2(g); ![]()
(2) CuSO4(aq) + Zn(s) ![]() ZnSO4(aq) + Cu(s);
ZnSO4(aq) + Cu(s); ![]()
Phát biểu nào sau đây là đúng?
Phản ứng (1) là phản ứng tỏa nhiệt, phản ứng (2) là phản ứng thu nhiệt.
Phản ứng (1) là phản ứng thu nhiệt, phản ứng (2) là phản ứng tỏa nhiệt.
Phản ứng (1) và phản ứng (2) là phản ứng thu nhiệt.
Phản ứng (1) và phản ứng (2) là phản ứng tỏa nhiệt.
Cho phản ứng hóa học xảy ra ở điều kiện chuẩn sau:
2NO2(g) (đỏ nâu) ![]() N2O4(g) (không màu)
N2O4(g) (không màu)
Biết NO2 và N2O4 có ![]() tương ứng là 33,18 kJ/mol và 9,16 kJ/mol. Điều này chứng tỏ phản ứng
tương ứng là 33,18 kJ/mol và 9,16 kJ/mol. Điều này chứng tỏ phản ứng
tỏa nhiệt, NO2 bền vững hơn N2O4.
thu nhiệt, NO2 bền vững hơn N2O4.
tỏa nhiệt, N2O4 bền vững hơn NO2.
thu nhiệt, N2O4 bền vững hơn NO2.
Nung KNO3 lên 550 oC xảy ra phản ứng:
2KNO3(s) ![]() 2KNO2(s) + O2(g) ∆H
2KNO2(s) + O2(g) ∆H
Phản ứng nhiệt phân KNO3 là
tỏa nhiệt, có ∆H < 0.
thu nhiệt, ∆H > 0.
tỏa nhiệt, ∆H > 0.
thu nhiệt, có ∆H < 0.
Cho phương trình nhiệt hóa học của phản ứng:
2H2(g) + O2(g) ![]() 2H2O(l)
2H2O(l) ![]() = –571,68 kJ
= –571,68 kJ
Phản ứng trên là phản ứng
thu nhiệt.
tỏa nhiệt.
không có sự thay đổi năng lượng.
có sự hấp thụ nhiệt lượng từ môi trường xung quanh.
Cho phương trình nhiệt hóa học của phản ứng:
N2(g) + O2(g) ![]() 2NO(g)
2NO(g) ![]() = +179,20 kJ
= +179,20 kJ
Phản ứng trên là phản ứng
thu nhiệt.
tỏa nhiệt.
không có sự thay đổi năng lượng.
có sự giải phóng nhiệt lượng ra môi trường.
Điều kiện nào sau đây không phải là điều kiện chuẩn?
Áp suất 1 bar và nhiệt độ 25 0C hay 298 K.
Áp suất 1 bar và nhiệt độ 298 K.
Áp suất 1 bar và nhiệt độ 25 0C.
Áp suất 1 bar và nhiệt độ 25K.
Dựa vào phương trình nhiệt hóa học của các phản ứng sau:
(1) CS2(l) + 3O2(g) ![]() CO2(g) + 2SO2(g)
CO2(g) + 2SO2(g) ![]() = –1110,21 kJ
= –1110,21 kJ
(2) CO2(g) ![]() CO(g) + 1/2O2(g)
CO(g) + 1/2O2(g) ![]() = +280,00 kJ
= +280,00 kJ
(3) Na(s) + 2H2O(l) ![]() NaOH(aq) + H2(g)
NaOH(aq) + H2(g) ![]() = –367,50 k
= –367,50 k
(4) ZnSO4(s) ![]() ZnO(s) + SO3(g)
ZnO(s) + SO3(g) ![]() = +235,21 kJ
= +235,21 kJ
Cặp phản ứng thu nhiệt là
(1) và (2).
(3) và (4).
(1) và (3).
(2) và (4).
Phát biểu nào sau đây đúng?
Điều kiện chuẩn là điều kiện ứng với áp suất 1 bar (với chất khí), nồng độ 1 mol/L (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298 K.
Điều kiện chuẩn là điều kiện ứng với nhiệt độ 298 K.
Áp suất 760 mmHg là áp suất ở điều kiện chuẩn.
Điều kiện chuẩn là điều kiện ứng với áp suất 1 atm, nhiệt độ 0 0C.
Enthalpy tạo thành chuẩn của một đơn chất bền
là biến thiên enthalpy chuẩn của phản ứng giữa nguyên tố đó với hydrogen.
là biến thiên enthalpy chuẩn của phản ứng giữa nguyên tố đó với oxygen.
được xác định từ nhiệt độ nóng chảy của nguyên tố đó.
bằng 0.
Nung nóng hai ống nghiệm chứa NaHCO3 và P, xảy ra các phản ứng sau:
2NaHCO3(s) ![]() Na2CO3(s) + CO2(g) + H2O(g) (1)
Na2CO3(s) + CO2(g) + H2O(g) (1)
4P(s) + 5O2(g) ![]() 2P2O5(s) (2)
2P2O5(s) (2)
Khi ngừng đun nóng, phản ứng (1) dừng lại còn phản ứng (2) tiếp tục xảy ra, chứng tỏ
phản ứng (1) tỏa nhiệt, phản ứng (2) thu nhiệt.
phản ứng (1) thu nhiệt, phản ứng (2) tỏa nhiệt.
cả hai phản ứng đều tỏa nhiệt.
cả hai phản ứng đều thu nhiệt.
Phát biểu nào sau đây không đúng?
Các phản ứng phân hủy thường là phản ứng thu nhiệt.
Phản ứng càng tỏa ra nhiều nhiệt càng dễ tự xảy ra.
Phản ứng oxi hóa chất béo cung cấp nhiệt cho cơ thể.
Các phản ứng khi đun nóng đều dễ xảy ra hơn.
Cho phương trình nhiệt hóa học của phản ứng trung hòa sau:
HCl(aq) + NaOH(aq) ![]() NaCl(aq) + H2O(l) ∆H = –57,3 kJ
NaCl(aq) + H2O(l) ∆H = –57,3 kJ
Phát biểu nào sau đây không đúng?
Cho 1 mol HCl tác dụng với NaOH dư tỏa nhiệt lượng là 57,3 kJ.
Cho HCl dư tác dụng với 1 mol NaOH tỏa nhiệt lượng là 57,3 kJ.
Cho 1 mol HCl tác dụng với 1 mol NaOH tỏa nhiệt lượng là 57,3 kJ.
Cho 2 mol HCl tác dụng với NaOH dư tỏa nhiệt lượng là 57,3 kJ.
Cho phương trình nhiệt hóa học sau:
H2(g) + I2(g) ![]() 2HI(g) ∆H = +11,3 kJ
2HI(g) ∆H = +11,3 kJ
Phát biểu nào sau đây về sự trao đổi năng lượng của phản ứng trên là đúng?
Phản ứng giải phóng nhiệt lượng 11,3 kJ khi 2 mol HI được tạo thành.
Tổng nhiệt phá vỡ liên kết của chất phản ứng lớn hơn nhiệt tỏa ra khi tạo thành sản phẩm.
Năng lượng chứa trong H2 và I2 cao hơn HI.
Phản ứng xảy ra với tốc độ chậm.
Làm các thí nghiệm tương tự nhau: Cho 0,05 mol mỗi kim loại Mg, Zn, Fe vào ba bình đựng 100 mL dung dịch CuSO4 0,5M. Nhiệt độ tăng lên cao nhất ở mỗi bình lần lượt là ∆T1, ∆T2, ∆T3. Sự sắp xếp nào sau đây là đúng?
∆T1 < ∆T2 < ∆T3.
∆T3 < ∆T1 < ∆T2.
∆T2 < ∆T3 < ∆T1.
∆T3 < ∆T2 < ∆T1.
Dựa vào phương trình nhiệt hóa học của phản ứng sau:
CO2(g) ![]() CO(g) + 1/2O2(g)
CO(g) + 1/2O2(g) ![]() = + 280 kJ
= + 280 kJ
Giá trị ![]() của phản ứng: 2CO2(g)
của phản ứng: 2CO2(g) ![]() 2CO(g) + O2(g) là
2CO(g) + O2(g) là
+140 kJ.
–1120 kJ.
+560 kJ.
–420 kJ.
Phản ứng chuyển hóa giữa hai dạng đơn chất của phosphorus (P):
P(s, đỏ) ![]() P(s, trắng)
P(s, trắng) ![]() = 17,6 kJ
= 17,6 kJ
Điều này chứng tỏ phản ứng
thu nhiệt, P đỏ bền hơn P trắng.
thu nhiệt, P trắng bền hơn P đỏ.
tỏa nhiệt, P đỏ bền hơn P trắng.
tỏa nhiệt, P trắng bền hơn P đỏ.
Phương trình hóa học nào dưới đây biểu thị enthalpy tạo thành chuẩn của CO(g)?
2C(graphite) + O2(g) ![]() 2CO(g).
2CO(g).
C(graphite) + O(g) ![]() CO(g).
CO(g).
C(graphite) + 1/2O2(g) ![]() CO(g).
CO(g).
C(graphite) + CO2(g) ![]() 2CO(g).
2CO(g).
Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau:
N2(g) + O2(g) ![]() 2NO(g)
2NO(g) ![]() = +180 kJ
= +180 kJ
Kết luận nào sau đây đúng?
Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp.
Phản ứng tỏa nhiệt.
Phản ứng xảy ra thuận lợi ở điều kiện thường.
Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường.
Biến thiên enthalpy của một phản ứng được ghi ở sơ đồ dưới:

Kết luận nào sau đây đúng?
Phản ứng tỏa nhiệt.
Năng lượng chất tham gia phản ứng nhỏ hơn năng lượng sản phẩm.
Biến thiên enthalpy của phản ứng là a kJ/mol.
Phản ứng thu nhiệt.
Cho đồ thị thể hiện sự thay đổi nhiệt độ khi cho dung dịch hydrochloric acid được cho vào dung dịch sodium hydroxide tới dư ở hình dưới:
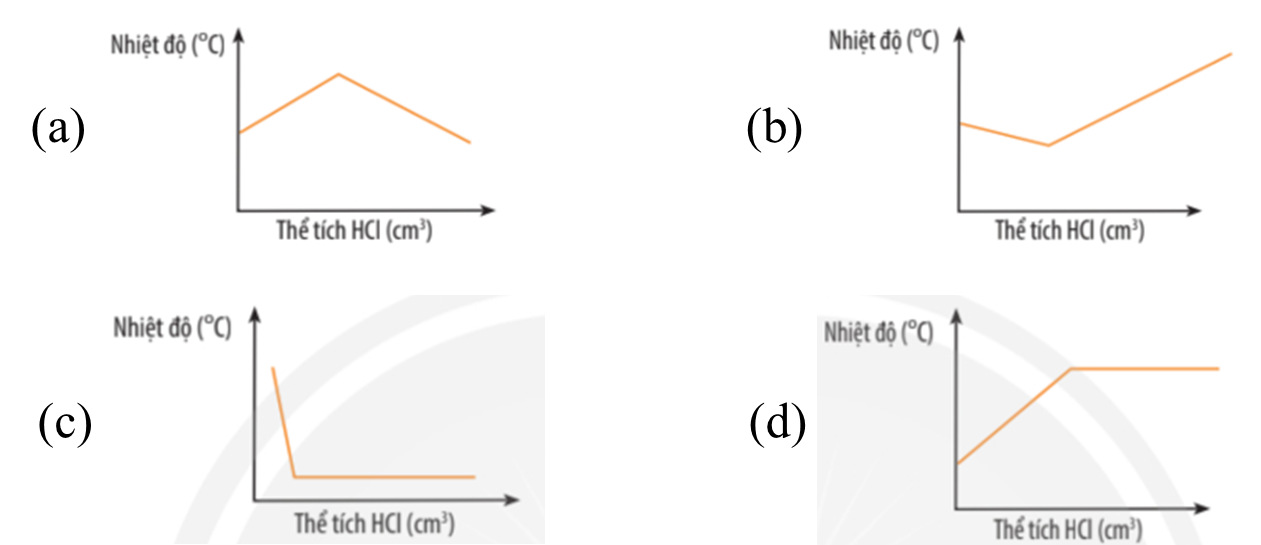
Đồ thị thể hiện đúng là
(a).
(b).
(c).
(d).
Cho phản ứng tổng quát: aA + bB ![]() mM + nN. Cho các phương án tính
mM + nN. Cho các phương án tính ![]() của phản ứng:
của phản ứng:
(a) ![]() = m.
= m.![]() (M) + n.
(M) + n.![]() (n) – a.
(n) – a.![]() (A) – b.
(A) – b.![]() (B)
(B)
(b) ![]() = a.
= a.![]() (A) + b.
(A) + b.![]() (B) – m.
(B) – m.![]() (M) – n.
(M) – n.![]() (N)
(N)
(c) ![]() = a. Eb(A) + b.Eb(B) – m.Eb(M) – n.Eb(N)
= a. Eb(A) + b.Eb(B) – m.Eb(M) – n.Eb(N)
(d) ![]() = m.Eb(M) + n.Eb(N) – a. Eb(A) – b.Eb(B)
= m.Eb(M) + n.Eb(N) – a. Eb(A) – b.Eb(B)
Số phương án tính ![]() của phản ứng đúng là
của phản ứng đúng là
1.
2.
3.
4.
Biến thiên enthalpy chuẩn của phản ứng nào dưới đây chính là enthalpy tạo thành chuẩn của AlCl3(s)?
Al(s) + 3Cl2(g) ![]() AlCl3(s).
AlCl3(s).
Al(s) + 3Cl(g) ![]() AlCl3(s).
AlCl3(s).
3HCl(aq) + Al(OH)3(s) ![]() AlCl3(s) + 3H2O(l).
AlCl3(s) + 3H2O(l).
Al(s) + 3/2Cl2(g) ![]() AlCl3(s).
AlCl3(s).
Ở một nhiệt độ xác định, enthalpy tạo thành chuẩn của barium oxide (BaO(s)) và barium peroxide (BaO2(s)) lần lượt là –553,5 kJ.mol–1 và –634,3 kJ.mol–1. Phản ứng phân huỷ barium peroxide (ở cùng điều kiện nhiệt độ) 2BaO2(s) ![]() 2BaO(s) + O2(g) có biến thiên enthalpy chuẩn là
2BaO(s) + O2(g) có biến thiên enthalpy chuẩn là
130 kJ.
161,6 kJ.
–161,6 kJ.
156,7 kJ.
Enthalpy tạo thành chuẩn của các khí O3, CO2, NH3 và HI lần lượt là 142,2 kJ.mol–1; –393,3 kJ.mol–1; –45,9 kJ.mol–1 và 26,5 kJ.mol–1. Thứ tự độ bền tăng dần của các hợp chất trên là
O3, CO2, NH3, HI.
O3, HI, NH3, CO2.
CO2, NH3, HI, O3.
NH3, HI, CO2, O3.
Năng lượng liên kết Cl–Cl là 243 kJ.mol–1, của H–H là 436 kJ.mol–1. Cho biết enthalpy tạo thành chuẩn của HCl là –91 kJ.mol–1. Năng lượng liên kết của H–Cl là
430,5 kJ.mol–1.
490,0 kJ.mol–1.
245,0 kJ.mol–1.
290,0 kJ.mol–1.
Một phản ứng có biến thiên enthalpy bằng 65 kJ. Phát biểu nào sau đây là đúng?
Cả phản ứng và môi trường xung quanh đều mất một năng lượng là 65 kJ.
Cả phản ứng và môi trường xung quanh đều thu được một năng lượng 65 kJ.
Phản ứng mất 65 kJ năng lượng và môi trường xung quanh nhận được một năng lượng 65 kJ.
Phản ứng nhận được 65 kJ năng lượng và môi trường xung quanh mất 65 kJ năng lượng.
Quy ước về dấu của nhiệt phản ứng (![]() ) nào sau đây là đúng?
) nào sau đây là đúng?
Phản ứng tỏa nhiệt có ![]() .
.
Phản ứng thu nhiệt có ![]() .
.
Phản ứng tỏa nhiệt có ![]() .
.
Phản ứng thu nhiệt có ![]() .
.
Các phản ứng tỏa nhiệt thường diễn ra
thuận lợi hơn các phản ứng thu nhiệt.
khó khăn hơn khi càng tỏa ra nhiệt.
khó khăn hơn các phản ứng thu nhiệt.
thuận lợi hơn khi càng tỏa ít nhiệt.
Nhiệt kèm theo phản ứng trong điều kiện chuẩn là
enthalpy chuẩn (hay nhiệt phản ứng chuẩn) của phản ứng đó, kí hiệu là ![]() .
.
biến thiên enthalpy chuẩn (hay nhiệt phản ứng chuẩn) của phản ứng đó, kí hiệu là ![]() .
.
biến thiên enthalpy chuẩn (hay nhiệt phản ứng chuẩn) của phản ứng đó, kí hiệu là ![]() .
.
enthalpy chuẩn (hay nhiệt phản ứng chuẩn) của phản ứng đó, kí hiệu là ![]() .
.
Cho biết phản ứng tạo thành 2 mol HCl(g) ở điều kiện chuẩn sau đây tỏa ra 184,6 kJ:
H2(g) + Cl2(g) ![]() 2HCl(g);(*)
2HCl(g);(*)
Cho các phát biểu sau:
(a) Nhiệt tạo thành của HCl là –184,6 kJ/mol.
(b) Biến thiên enthalpy phản ứng (*) là –184,6 kJ.
(c) Nhiệt tạo thành của HCl là –92,3 kJ/mol.
(d) Biến thiên enthalpy của phản ứng (*) là –92,3 kJ.
Số phát đúng là
1.
2.
3.
4.
