16 câu hỏi
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Mỗi câu hỏi học sinh chỉ chọn một phương án.
Cho phương trình nhiệt hóa học của phản ứng trung hòa sau:
![]()
Phát biểu nào sau đây không đúng?
Biến thiên enthalpy chuẩn của phản ứng là -57,3 kJ.
Phản ứng trên là phản ứng tỏa nhiệt.
Nhiệt tạo thành chuẩn của NaCl (aq) là -57,3 kJ/mol.
Phản ứng trên giải phóng nhiệt năng ra môi trường.
Sự thay đổi nhiệt độ trong phản ứng của calcium với nước được minh họa trong hình bên dưới. Phản ứng của calcium với nước là
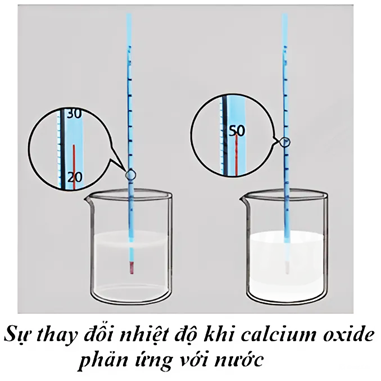
phản ứng thu nhiệt.
phản ứng phân hủy.
phản ứng tỏa nhiệt.
phản ứng thuận nghịch.
Cho phương trình nhiệt hóa học của các phản ứng sau:
(1) ZnO(s) + SO2(g) ![]() ZnSO4(s)
ZnSO4(s)![]() =
= ![]() 235,21 kJ
235,21 kJ
(2) 2Na(s) +2H2O(l)![]() 2NaOH(aq) + H2(g)
2NaOH(aq) + H2(g)![]() =
= ![]() 367,50 kJ
367,50 kJ
(3) CO2(g) ![]() CO(g) +
CO(g) + ![]() O2(g)
O2(g) ![]() = +280,00 kJ
= +280,00 kJ
(4) C3H8 (g) + 5O2 (g) ![]() 3CO2 (g) + 4H2O (l)
3CO2 (g) + 4H2O (l)![]()
Phản ứng thu nhiệt là
(1).
(2).
(4).
(3).
Kí hiệu biến thiên enthalpy (nhiệt phản ứng) của phản ứng ở điều kiện chuẩn là
![]()
![]()
![]()
![]()
Cho các phát biểu:
(a) Tất cả các phản ứng cháy đều tỏa nhiệt.
(b) Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
(c) Tất cả các phản ứng mà chất tham gia có chứa nguyên tố oxygen đều tỏa nhiệt.
(d) Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt.
(e) Lượng nhiệt mà phản ứng hấp thụ hay giải phóng không phụ thuộc vào điều kiện thực hiện phản ứng và thể tồn tại của chất trong phản ứng.
(g) Sự cháy của nhiên liệu (xăng, dầu, khí gas, than, gỗ,…) là những ví dụ về phản ứng thu nhiệt vì cần khơi mào.
Số phát biểu đúng là
2.
3.
4.
5.
Phương trình hóa học nào dưới đây là phương trình biểu thị enthalpy tạo thành chuẩn của một chất?
![]() N2(g) + O(g) → NO(g).
N2(g) + O(g) → NO(g).
Na(s) + ![]() Br2(g) → NaBr(s).
Br2(g) → NaBr(s).
N2(g) + O2(g) → 2NO(g).
4Na(s) + O2(g) → 2Na2O(s).
Chất nào sau đây có nhiệt tạo thành chuẩn (![]() ) bằng 0 (kJ/mol)?
) bằng 0 (kJ/mol)?
NaCl(s).
CO2(g).
H2O(l).
H2(g).
Công thức tính biến thiên enthalpy của phản ứng theo năng lượng liên kết (trong đó, kí hiệu ![]() là tổng năng lượng liên kết của các chất tham gia phản ứng; kí hiệu
là tổng năng lượng liên kết của các chất tham gia phản ứng; kí hiệu ![]() là tổng năng lượng liên kết của các chất sản phẩm phản ứng) là
là tổng năng lượng liên kết của các chất sản phẩm phản ứng) là
![]()
![]()
![]()
![]()
Phản ứng thu nhiệt là phản ứng có
A. ![]() .
.
D. ![]() .
.
Phát biểu nào sau đây đúng?
Điều kiện chuẩn là điều kiện ứng với áp suất 1 bar (với chất khí), nồng độ 1 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298 K.
Điều kiện chuẩn là điều kiện ứng với nhiệt độ 298 K.
Áp suất 760 mmHg là áp suất ở điều kiện chuẩn.
Điều kiện chuẩn là điều kiện ứng với áp suất 1 atm, nhiệt độ 0 °C.
Phương trình nhiệt hóa học nào sau đây là của phản ứng thu nhiệt ở điều kiện chuẩn?
A. ![]() .
.
B. ![]() .
.
C. ![]() .
.
D. ![]() .
.
Một phản ứng có biến thiên enthalpy bằng 65 kJ. Phát biểu nào sau đây là đúng?
Cả phản ứng và môi trường xung quanh đều mất một năng lượng là 65 kJ.
Phản ứng nhận được 65 kJ năng lượng và môi trường xung quanh mất 65 kJ năng lượng.
Phản ứng mất 65 kJ năng lượng và môi trường xung quanh nhận được 65 kJ năng lượng.
Cả phản ứng và môi trường xung quanh đều thu được một năng lượng 65 kJ.
Biến thiên enthalpy chuẩn của phản ứng nào dưới đây chính là enthalpy tạo thành chuẩn của AlCl3(s)?
Al(s) + 3Cl2(g) → AlCl3(s).
Al(s) + 3Cl2(g) → 2AlCl3(s).
3HCl(aq) + Al(OH)3(s) → AlCl3(s) + 3H2O(l).
Al(s) + ![]() Cl2(g) → AlCl3(s).
Cl2(g) → AlCl3(s).
Khái niệm nào sau đây về enthalpy tạo thành chuẩn là chính xác nhất?
Là nhiệt kèm theo (thu vào hoặc tỏa ra) của phản ứng tạo thành 1 mol chất đó từ các đơn chất kém bền nhất ở điều kiện chuẩn.
Là nhiệt kèm theo (thu vào hoặc tỏa ra) của phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất ở điều kiện tiêu chuẩn.
Là nhiệt kèm theo (thu vào hoặc tỏa ra) của phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất ở điều kiện chuẩn.
Là nhiệt kèm theo (thu vào hoặc tỏa ra) của phản ứng tạo thành 2 mol chất đó từ các đơn chất bền nhất ở điều kiện chuẩn.
Enthalpy tạo thành chuẩn của các khí O3, CO2, NH3, HI lần lượt là 142,2 ![]()
![]()
![]() 26,5
26,5 ![]() Thứ tự độ bền tăng dần của các hợp chất trên là
Thứ tự độ bền tăng dần của các hợp chất trên là
![]()
![]()
![]()
![]()
Cho phản ứng chuyển hóa giữa hai dạng đơn chất của carbon:
C (kim cương) → C (graphite)![]()
Nhận xét nào sau đây là đúng?
Phản ứng thu nhiệt, kim cương bền hơn graphite.
Phản ứng thu nhiệt, graphite bền hơn kim cương.
Phản ứng tỏa nhiệt, kim cương bền hơn graphite.
Phản ứng tỏa nhiệt, graphite bền hơn kim cương.
