28 câu trắc nghiệm Hóa 10 Kết nối tri thức Bài 14: Ôn tập chương 3 (Đúng sai - Trả lời ngắn) có đáp án (phần 1)
40 câu hỏi
Theo quy tắc octet, khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững giống như
kim loại kiềm gần kề.
kim loại kiềm thổ gần kề.
nguyên tử halogen gần kề.
nguyên tử khí hiếm gần kề.
Để đạt quy tắc octet, nguyên tử của nguyên tố potassium (Z = 19) phải
nhường đi 2 electron.
nhường đi 1 electron.
nhận thêm 2 electron.
nhận thêm 1 electron.
Nguyên tử trong phân tử nào sau đây ngoại lệ với quy tắc octet?
H2O.
NH3.
HCl.
BF3.
Cation R+ có cấu hình electron 1s22s22p63s23p6. Vị trí của nguyên tố R trong bảng tuần hoàn các nguyên tố hóa học là
chu kì 4, nhóm IA.
chu kì 3, nhóm VIIA.
chu kì 3, nhóm VIIIA.
chu kì 4, nhóm IIA.
Số electron và số proton trong ion NH4+ là
11 electron và 11 proton.
10 electron và 11 proton.
11 electron và 10 proton.
11 electron và 12 proton.
Bán kính của nguyên tử Al như thế nào so với bán kính của cation Al3+ trong tinh thể AlCl3?
Bằng nhau.
Bán kính của Al lớn hơn của Al3+.
Bán kính của Al nhỏ hơn của Al3+.
Không dự đoán được.
Liên kết ion là loại liên kết hóa học được hình thành nhờ lực hút tĩnh điện giữa các phần tử
cation và anion.
anion.
cation và electron tự do.
electron và hạt nhân nguyên tử.
Cho giá trị độ âm điện của các nguyên tố: F (3,98); O (3,44); C (2,55); H (2,20); Na (0,93). Hợp chất nào sau đây là hợp chất ion?
NaF.
CO2.
CH4.
H2O.
Hợp chất A có các tính chất sau: Ở thể rắn trong điều kiện thường, dễ tan trong nước tạo thành dung dịch dẫn điện được. Hợp chất A là
sodium chloride.
glucose.
sucrose.
fructose.
Cho các hình biểu diễn sự xen phủ orbital nguyên tử để tạo liên kết hóa học sau:
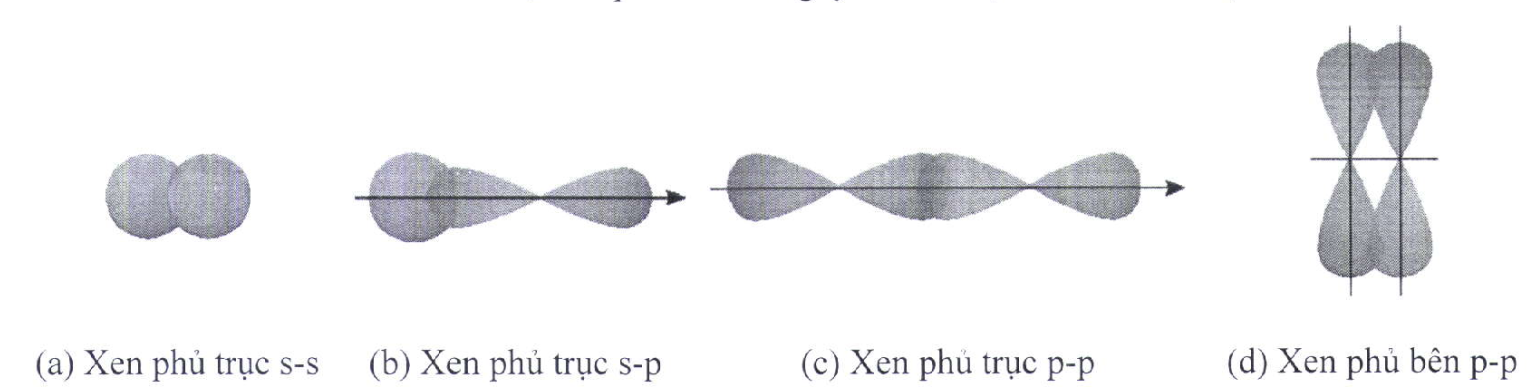
Biết số hiệu các nguyên tử của H, F và S lần lượt là 1, 9 và 16. Sự tạo liên kết trong các phân tử H2S và F2 theo kiểu xen phủ tương ứng là
(a) và (c).
(b) và (c).
(b) và (d).
(c) và (d).
Dựa vào hiệu độ âm điện giữa hai nguyên tố, cho biết liên kết trong phân tử nào sau đây là phân cực nhất.
HF.
HCl.
HBr.
HI.
Liên kết hóa học giữa các nguyên tử trong phân tử HCl thuộc loại liên kết
ion.
cộng hóa trị không cực.
hydrogen.
cộng hóa trị có cực.
Chất vừa có liên kết cộng hóa trị phân cực, vừa có liên kết cộng hóa trị không cực là
HCl.
H2O.
NH3.
C2F6.
Số liên kết σ và liên kết π trong phân tử acetylene (C2H2) lần lượt là
3 và 2.
3 và 1.
2 và 1.
1 và 1.
Chất nào sau đây không thể tạo được liên kết hydrogen?
H2O.
CH4.
CH3OH.
NH3.
Trong phân tử, các electron chuyển động không ngừng, khi các electron tập trung về một phía sẽ hình thành nên
cation.
anion.
một lưỡng cực tạm thời.
một lưỡng cực vĩnh viễn.
Giữa các nguyên tử He có thể có loại liên kết nào?
Liên kết cộng hoá trị.
Liên kết hydrogen.
Tương tác van der Waals.
Không có bất kì liên kết nào.
Khi tham gia hình thành liên kết trong các phân tử HF, F2; orbital tham gia xen phủ tạo liên kết của nguyên tử F thuộc về phân lớp nào, có hình dạng gì?
Phân lớp 2s, hình cầu.
Phân lớp 2s, hình số tám nổi.
Phân lớp 2p, hình số tám nổi.
Phân lớp 2p, hình cánh hoa.
a. Độ âm điện của nguyên tử A nhỏ hơn độ âm điện của nguyên tử B
b. Số electron độc thân của nguyên tử A nhiều hơn số electron độc thân của nguyên tử B
c. Trong các phản ứng hóa học, nguyên tử A có xu hướng nhường 1 electron
d. Khi hình thành liên kết với nguyên tử B, nguyên tử A nhận 1 electron
a. X có xu hướng nhường 1 electron để tạo thành cation X+.
b. Y có xu hướng nhận 2 electron để tạo thành anion Y2–.
c. Hợp chất R có công thức là: XY2
d. Liên kết trong hợp chất R là liên kết ion
a. Các orbital p vừa có khả năng xen phủ tạo liên kết σ vừa có khả năng xen phủ tạo liên kết π tuỳ thuộc vào kiểu xen phủ
b. Liên kết cộng hoá trị không phân cực chỉ có thể tạo thành từ các nguyên tử của cùng một nguyên tố hoá học
c. Tất cả các nguyên tử khi tham gia tạo thành liên kết cộng hoá trị đều thoả mãn quy tắc octet
d. Hiệu độ âm điện giữa hai nguyên tử càng cao thì liên kết càng phân cực
a. Bất kì phân tử nào có chứa nguyên tử hydrogen cũng có thể tạo liên kết hydrogen với phân tử cùng loại
b. Liên kết hydrogen là liên kết hình thành do sự góp chung cặp electron hoá trị giữa nguyên tử hydrogen và nguyên tử có độ âm điện lớn
c. Liên kết hydrogen là loại liên kết yếu nhất giữa các phân tử.
d. Ảnh hưởng của liên kết hydrogen tới nhiệt độ sôi và nhiệt độ nóng chảy của chất là mạnh hơn ảnh hưởng của tương tác van der Waals.
Cho các chất sau: CH4, BF3, NO, BeH2, NH3, SF6 và CO2. Số phân tử tuân theo quy tắc octet là bao nhiêu?
Cho các chất sau: K2O, H2O, H2S, SO2, NaCl, K2S, CaF2 và HCl. Số phân tử có liên kết ion là bao nhiêu?
Nếu nguyên tử X có 3 electron hoá trị và nguyên tử Y có 6 electron hoá trị, thì công thức của hợp chất ion đơn giản nhất tạo bởi X và Y là XnYm. Tổng (n + m) là bao nhiêu?
Cho biết hoá trị của một nguyên tố trong phân tử bằng tổng số liên kết σ và π mà nguyên tử nguyên tố đó tạo thành khi liên kết với các nguyên tử xung quanh. Hoá trị của N trong NH4+ là bao nhiêu?
Cho các chất sau: N2, H2, NH3, NaCl, HCl, H2O. Số chất mà phân tử chỉ chứa liên kết cộng hóa trị không phân cực là bao nhiêu?
Nhiệt độ sôi của từng chất methane (CH4), ethane (C2H6), propane (C3H6) và butane (C4H10) là một trong bốn nhiệt độ sau: 0 oC, –164 oC, –42 oC và –88 oC. Nhiệt độ sôi của butane (C4H10) là bao nhiêu?


