Đề kiểm tra Hóa 12 Cánh diều Chủ đề 7 có đáp án - Đề 2
28 câu hỏi
Trong chế độ dinh dưỡng hàng ngày, khi cơ thể không hấp thu được hoặc thiếu nguyên tố nào dưới đây sẽ dẫn đến nguy cơ loãng xương?
Ba.
Mg.
Be.
Ca.
Nguyên tử của các nguyên tố nhóm IA khác nhau về
số electron lớp ngoài cùng của nguyên tử.
cấu hình electron nguyên tử.
số oxi hóa của nguyên tử trong hợp chất.
kiểu mạng tinh thể của đơn chất.
Kim loại Li nên được bảo quản trong
dầu hoả khan.
phenol.
khí trơ.
bình hút ẩm.
Theo chiều tăng dần của điện tích hạt nhân nguyên tử, sự biến đổi tính chất của các nguyên tố nhóm IA nào sau đây đúng?
Bán kính nguyên tử giảm dần.
Nhiệt độ nóng chảy tăng dần.
Độ cứng giảm dần.
Khối lượng riêng của đơn chất giảm dần.
Nhận định nào sau đây về nước cứng tạm thời là không đúng?
Chứa nhiều ion Ca2+ và Mg2+.
Chứa nhiều ion HCO3-.
Chứa nhiều ion Cl-và SO42-
Đun sôi để trở thành nước mềm.
Cho dãy các nguyên tố: Be, K, Fe, Na, Al và Cs. Số nguyên tố thuộc nhóm IA là
1.
2.
3.
4.
Kim loại kiềm có độ cứng thấp, rất mềm (có thể cắt bằng dao, kéo) là do nguyên nhân nào sau đây?
Mạng tinh thể kim loại kiềm có liên kết kim loại yếu.
Kim loại kiềm có giá trị thế điện cực chuẩn âm.
Kim loại kiềm có cấu trúc tinh thể đặc khít.
Kim loại kiềm tan tốt trong nước.
Một loại muối (X) của kim loại kiềm được dùng làm phân bón, cung cấp cả hai nguyên tố dinh dưỡng đa lượng cho cây trồng. Công thức hoá học của muối X là
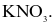
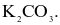
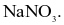
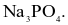
Khi đun nóng nước tự nhiên, muối nào sau đây bị phân huỷ tạo thành cặn đá vôi trong phích nước, ấm đun nước?
Ca3(PO4)2.
CaCl2.
CaSO4.
Ca(HCO3)2.
Khi đun nóng đến 60 °C, thạch cao sống mất một phần nước trở thành thạch cao nung, được dùng để đúc khuôn trong điêu khắc, bó bột trong y học. Thành phần chính của thạch cao nung là
CaSO4.0,5H2O.
Ca(H2PO4)2.
CaCO3.
Ca(OH)2.
Có thể nhận biết dung dịch BaCl2 bằng dung dịch chất nào sau đây?
NaOH.
Na2CO3.
NaCl.
NaNO3.
Muối nào sau đây chỉ tồn tại trong dung dịch và bị phân huỷ khi đun nóng?
Ca(NO3)2.
Ca(HCO3)2.
CaCl2.
CaSO4.
Nước cứng gây nhiều tác hại trong đời sống và sản xuất như đóng cặn đường ống dẫn nước, làm cho xà phòng có ít bọt khi giặt quần áo, làm giảm mùi vị thực phẩm khi nấu ăn. Nước cứng là nước có chứa nhiều các ion
Ca2+ và Mg2+.
Na+ và K+.
- và Cl-.
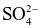 và
và 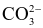 .
.
Soda là hoá chất quan trọng trong sản xuất thuỷ tinh, bột giặt, phẩm nhuộm, giấy, sợi. Công thức hoá học của soda là
NaCl.
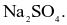
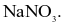
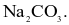
Quá trình nào sau đây dùng để tách kim loại Na từ hợp chất?
Dung dịch NaOH tác dụng với dung dịch HCl.
Điện phân NaCl nóng chảy.
Dung dịch 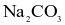 tác dụng với dung dịch HCl.
tác dụng với dung dịch HCl.
Dung dịch NaCl tác dụng với dung dịch 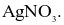
Trong các mẫu nước cứng sau đây, nước cứng tạm thời là
dung dịch Ca(HCO3)2.
dung dịch MgSO4.
dung dịch CaCl2.
dung dịch Mg(NO3)2 .
Cho sơ đồ chuyển hoá sau:
CaO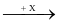 Y
Y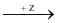 CaCO3
CaCO3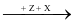 T
T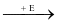 CaSO4
CaSO4
Biết: X, Y, Z, T, E là các hợp chất khác nhau; mỗi mũi tên ứng với một phương trình hoá học. Các chất Z, E thoả mãn sơ đồ trên lần lượt là
Na2CO3, H2SO4.
CO2, KHSO4.
NaHCO3, Na2SO4.
CO2, BaSO4.
Trong cốc nước chứa 0,01 mol Na+; 0,02 mol Ca2+; 0,01 mol Mg2+; 0,05 mol HCO3- và 0,02 mol Cl-. Đun sôi cốc nước hồi lâu, nước thu được là
nước cứng tạm thời.
nước mềm.
nước cứng vĩnh cửu.
nước cứng toàn phần.
Trong phòng thí nghiệm, để phân biệt các ion 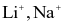 và
và 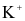 với nhau, người ta nhúng đầu đũa thuỷ tinh trong dung dịch muối bão hoà của các kim loại trên rồi đốt trên đèn khí.
với nhau, người ta nhúng đầu đũa thuỷ tinh trong dung dịch muối bão hoà của các kim loại trên rồi đốt trên đèn khí.
(a) Ngọn lửa khi đốt hợp chất của Li cho màu đỏ tía.
(b) Ngọn lửa khi đốt hợp chất của Na cho màu vàng.
(c) Chỉ các kim loại kiềm mới có hiện tượng tạo màu đặc trưng khi đốt cháy.
(d) Thí nghiệm trên dựa vào hiện tượng màu ngọn lửa đặc trưng của kim loại kiềm khi đốt.
Công đoạn chính của công nghiệp chlorine – kiềm là điện phân dung dịch sodium chlorine bão hòa trong bể điện phân có màng ngăn xốp. Phương trình hóa học của quá trình điện là: 2NaCl + 2H2O 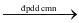 2NaOH + H2 + Cl2.
2NaOH + H2 + Cl2.
(a) Anion Cl – bị khử thành khí chlorine tại anode.
(b) Tại cathode, thu được đồng thời dung dịch bão hòa và tinh thể sodium hydroxide.
(c) Nếu không có màng ngăn xốp, nước Javel được hình thành trong bể điện phân.
(d) Hydrogen cũng là một sản phẩm có giá trị của công nghiệp chlorine – kiềm.
Magnesium 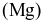 là kim loại được ứng dụng để tạo các hợp kim nhẹ, bền, đặc biệt là cho ngành công nghiệp sản xuất ô tô và hàng không vũ trụ. Magnesium được sản xuất trong công nghiệp theo quá trình Pidgeon với nguyên liệu ban đầu là quặng dolomite. Quá trình được thực hiện qua các giai đoạn sau:
là kim loại được ứng dụng để tạo các hợp kim nhẹ, bền, đặc biệt là cho ngành công nghiệp sản xuất ô tô và hàng không vũ trụ. Magnesium được sản xuất trong công nghiệp theo quá trình Pidgeon với nguyên liệu ban đầu là quặng dolomite. Quá trình được thực hiện qua các giai đoạn sau:
Giai đoạn 1. Nung quặng dolomite:
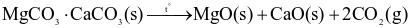
Giai đoạn 2. Dùng Si trong ferrosilicon 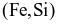 làm chất khử trong điều kiện chân không:
làm chất khử trong điều kiện chân không:
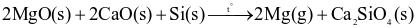
Phản ứng chung của quá trình Pidgeon là:
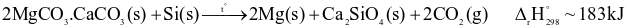
(a) Quá trình Pidgeon là quá trình thu nhiệt.
(b) Phản ứng ở giai đoạn (2) thuộc phương pháp nhiệt luyện.
(c) Phản ứng ở giai đoạn (2) chứng tỏ MgO có tính oxi hoá mạnh hơn CaO.
(d) Nếu hiệu suất của quá trình là 90% thì cứ 1 tấn quặng dolomite sẽ điều chế được 120 kg kim loại magnesium.
Một loại nước cứng có thành phần ion như sau:
| Ion | Nồng độ (M) |
| Calcium (Ca2+) | 0,02 |
| Sodium (Na+) | 0,03 |
Hydrogen carbonate (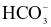 ) ) | x |
(a) Nước cứng đã nêu có tính cứng vĩnh cửu.
(b) Giá trị của x là 0,05.
(c) Có làm mềm mẫu nước cứng trên bằng cách đun nóng.
(d) Để làm mềm 1 lít nước cứng trên, cần dùng ít nhất 40 mL dung dịch NaOH 0,5 M.
NaHCO3 được sử dụng làm bột nở do dễ phân hủy thành khí và hơi tạo ra các lỗ xốp trong bánh. Nếu sử dụng 8,4 gam NaHCO3 thì có thể tạo ra tối đa bao nhiêu lít khí CO2 (đkc)? (Làm tròn kết quả đến hàng phần trăm).
Ở 20oC, độ tan của NaCl trong nước là 35,9 g trong 100 g nước. Ở nhiệt độ này, dung dịch NaCl bão hòa có nồng độ a%. Giá trị của a là bao nhiêu? (Làm tròn kết quả đến hàng phần mười).
Điện phân 2 lít dung dịch NaCl 0,5 M với điện cực trơ, màng ngăn xốp bằng dòng điện có cường độ không đổi 0,2 A. Sau 1930 giây thì dừng điện phân, thu được dung dịch X (giả thiết thể tích dung dịch không đổi). Dung dịch X có pH bằng bao nhiêu? (Làm tròn kết quả đến hàng phần mười).
Ở điều kiện thường, tinh thể Ca có D = 1,55 g/cm3. Giả thiết các nguyên tử Ca là những hình cầu chiếm 74% thể tích tinh thể, phần còn lại là khe rỗng.
Cho biết:
- Công thức tính thể tích hình cầu: V = 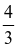 .π.r3
.π.r3
- Số Avogadro NA= 6,023.1023 và số pi π = 3,1416.
Bán kính nguyên tử Ca là bao nhiêu pm? (Làm tròn kết quả đến hàng đơn vị).
Vôi sống có nhiều ứng dụng như: sản xuất vật liệu xây dựng, vật liệu chịu nhiệt, khử chua đất trồng, tẩy uế, sát trùng, xử lí nước thải,... Hiện nay, nhiều lò nung vôi thủ công hoạt động tự phát, gây ảnh hưởng xấu đến môi trường xung quanh. Ở các lò nung vôi công nghiệp, quá trình kiểm soát phát thải ô nhiễm được thực hiện chặt chẽ hơn.
Xét một lò nung vôi công nghiệp sử dụng than đá làm nhiên liệu.
Giả thiết:
+ Đá vôi chỉ chứa CaCO3 và để phân hủy 1 kg đá vôi cần cung cấp một lượng nhiệt là 1800 kJ.
+ Đốt cháy 1 kg than đá giải phóng ra một lượng nhiệt là 27000 kJ và có 50% lượng nhiệt này được hấp thụ ở quá trình phân hủy đá vôi.
+ Công suất của lò nung vôi là 420 tấn vôi sống/ngày.
Tổng khối lượng (tấn) đá vôi và than đá mà lò nung vôi trên sử dụng mỗi ngày là bao nhiêu?
Nhiệt phân hoàn toàn 40g một loại quặng dolomite có lẫn tạp chất trơ sinh ra 9,916 lít khí CO2 (điều kiện chuẩn). Thành phần phần trăm về khối lượng của CaCO3.MgCO3 trong loại quặng nêu trên là bao nhiêu?


