Đề kiểm tra Hóa 10 Kết nối tri thức Chương 5 có đáp án - Đề 2
28 câu hỏi
Phát biểu nào sau đây đúng?
Điều kiện chuẩn là điều kiện ứng với áp suất 1 bar (với chất khí), nồng độ 1 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298 K.
Điều kiện chuẩn là điều kiện ứng với nhiệt độ 298 K.
Áp suất 760 mmHg là áp suất ở điều kiện chuẩn.
Điều kiện chuẩn là điều kiện ứng với áp suất 1 atm, nhiệt độ 0 °C.
Chất nào sau đây có nhiệt tạo thành chuẩn (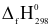 ) bằng 0 (kJ/mol)?
) bằng 0 (kJ/mol)?
NaCl(s).
CO2(g).
2O(l).
2(g).
Công thức tính biến thiên enthalpy của phản ứng theo năng lượng liên kết (trong đó, kí hiệu 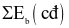 là tổng năng lượng liên kết của các chất tham gia phản ứng; kí hiệu
là tổng năng lượng liên kết của các chất tham gia phản ứng; kí hiệu 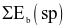 là tổng năng lượng liên kết của các chất sản phẩm phản ứng) là
là tổng năng lượng liên kết của các chất sản phẩm phản ứng) là
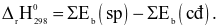
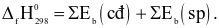
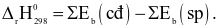
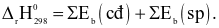
Khái niệm nào sau đây về enthalpy tạo thành chuẩn là chính xác nhất?
Là nhiệt kèm theo (thu vào hoặc tỏa ra) của phản ứng tạo thành 1 mol chất đó từ các đơn chất kém bền nhất ở điều kiện chuẩn.
Là nhiệt kèm theo (thu vào hoặc tỏa ra) của phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất ở điều kiện tiêu chuẩn.
Là nhiệt kèm theo (thu vào hoặc tỏa ra) của phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất ở điều kiện chuẩn.
Là nhiệt kèm theo (thu vào hoặc tỏa ra) của phản ứng tạo thành 2 mol chất đó từ các đơn chất bền nhất ở điều kiện chuẩn.
Enthalpy tạo thành chuẩn của các khí O3, CO2, NH3, HI lần lượt là 142,2 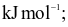
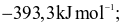
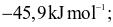 26,5
26,5 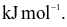 Thứ tự độ bền tăng dần của các hợp chất trên là
Thứ tự độ bền tăng dần của các hợp chất trên là
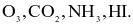

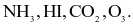
Phương trình hóa học nào sau đây biểu thị enthalpy tạo thành chuẩn của CO(g)?
2C (graphite)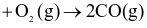 .
.
(graphite) + 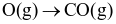 .
.
(graphite)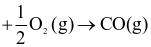 .
.
(graphite) 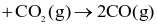 .
.
Cho các phương trình nhiệt hóa học của các phản ứng sau:
(1) 3Fe(s) + 4H2O(l)  Fe3O4(s) + 4H2(g)
Fe3O4(s) + 4H2(g) 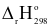 = +26,32 kJ
= +26,32 kJ
(2) N2(g) + O2(g)  2NO(g)
2NO(g) 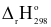 = +179,20 kJ
= +179,20 kJ
(3) Na(s) + 2H2O(l)  NaOH(aq) + H2(g)
NaOH(aq) + H2(g) 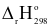 = ‒ 367,50 kJ
= ‒ 367,50 kJ
(4) 2ZnS(s) + 3O2(g)  2ZnO(s) + 2SO2(g)
2ZnO(s) + 2SO2(g)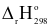 = ‒285,66 kJ
= ‒285,66 kJ
(5) ZnSO4(s)  ZnO(s) + SO3(g) ;
ZnO(s) + SO3(g) ; 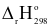 = + 235,21 kJ
= + 235,21 kJ
Có bao nhiêu phản ứng thuộc loại phản ứng tỏa nhiệt?
1.
2.
3.
4.
Cho phương trình nhiệt hóa học của các phản ứng sau:
(1) ZnO(s) + SO2(g)  ZnSO4(s)
ZnSO4(s) 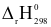 =
= 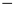 235,21 kJ
235,21 kJ
(2) 2Na(s) +2H2O(l) 2NaOH(aq) + H2(g)
2NaOH(aq) + H2(g) 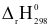 =
= 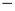 367,50 kJ
367,50 kJ
(3) CO2(g)  CO(g) +
CO(g) + 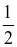 O2(g)
O2(g) 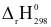 = +280,00 kJ
= +280,00 kJ
(4) C3H8(g) + 5O2(g) 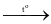 3CO2(g) + 4H2O (l)
3CO2(g) + 4H2O (l) 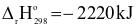
Phản ứng thu nhiệt là
(3).
(2).
(4).
(1).
Cho phương trình nhiệt hóa học của phản ứng trung hòa sau:
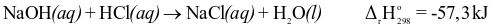
Phát biểu nào sau đây không đúng?
Biến thiên enthalpy chuẩn của phản ứng là -57,3 kJ.
Phản ứng trên là phản ứng tỏa nhiệt.
Nhiệt tạo thành chuẩn của NaCl (aq) là -57,3 kJ/mol.
Phản ứng trên giải phóng nhiệt năng ra môi trường.
Phương trình nhiệt hóa học nào sau đây là của phản ứng thu nhiệt ở điều kiện chuẩn?
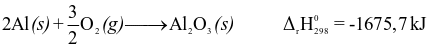 .
.
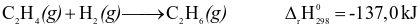 .
.
 .
.
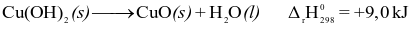 .
.
Một phản ứng có biến thiên enthalpy bằng 65 kJ. Phát biểu nào sau đây làđúng?
Cả phản ứng và môi trường xung quanh đều mất một năng lượng là 65 kJ.
Phản ứng nhận được 65 kJ năng lượng và môi trường xung quanh mất 65 kJ năng lượng.
Phản ứng mất 65 kJ năng lượng và môi trường xung quanh nhận được 65 kJ năng lượng.
Cả phản ứng và môi trường xung quanh đều thu được một năng lượng 65 kJ.
Cho các phát biểu sau:
(a) Biến thiên enthalpy chuẩn của một phản ứng hóa học là lượng nhiệt kèm theo phản ứng ở áp suất 1 atm và 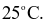
(b) Nhiệt (tỏa ra hay thu vào) kèm theo một phản ứng được thực hiện ở 1 bar và 298 K là biến thiên enthalpy chuẩn của phản ứng đó.
(c) Một số phản ứng khi xảy ra làm môi trường xung quanh nóng lên là phản ứng thu nhiệt.
(d) Một số phản ứng khi xảy ra làm môi trường xung quanh lạnh đi là do các phản ứng này thu nhiệt và lấy nhiệt từ môi trường.
(e) Các phản ứng oxi hóa chất béo cung cấp nhiệt cho cơ thể.
(g) Nhiệt độ của hệ phản ứng sẽ tăng lên nếu phản ứng thu nhiệt.
Có bao nhiêu phát biểu đúng?
5.
6.
3.
4.
Cho phương trình nhiệt hóa học của phản ứng:
CO2(g)  CO(g) +
CO(g) + 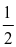 O2(g)
O2(g) 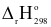 = + 280 kJ
= + 280 kJ
Lượng nhiệt cần cung cấp để tạo thành 56 g CO(g) là
140 kJ.
560 kJ.
–140 kJ.
–560 kJ.
Năng lượng liên kết Cl – Cl là 243 kJ 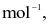 của H – H là 436
của H – H là 436 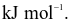 Cho biết enthalpy tạo thành chuẩn của HCl là − 91
Cho biết enthalpy tạo thành chuẩn của HCl là − 91 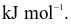 Năng lượng liên kết của H – Cl là
Năng lượng liên kết của H – Cl là
430,5 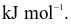
290,0 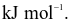
490,0 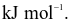
245,0 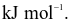
Khi nung vôi, người ta sử dụng phản ứng đốt than để cung cấp nhiệt cho phản ứng phân hủy đá vôi. Phát biểu nào sau đây là đúng?
Phản ứng đốt than là phản ứng thu nhiệt, phản ứng phân hủy đá vôi là phản ứng tỏa nhiệt.
Phản ứng đốt than là phản ứng tỏa nhiệt, phản ứng phân hủy đá vôi là phản ứng thu nhiệt.
Phản ứng đốt than và phản ứng phân hủy đá vôi là phản ứng tỏa nhiệt.
Phản ứng đốt than và phản ứng phân hủy đá vôi là phản ứng thu nhiệt.
Phương trình nhiệt hóa học của phản ứng tổng hợp ammonia như sau:
N2(g) + 3H2(g) 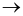 2NH3(g)
2NH3(g)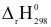 = -92 kJ
= -92 kJ
Biến thiên enthalpy chuẩn của phản ứng trên là
46 kJ.
92 kJ.
-46 kJ.
- 92 kJ.
Cho phương trình nhiệt hóa học của phản ứng:
2H2(g) + O2(g) 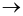 2H2O(l)
2H2O(l) 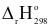 = -571,68kJ
= -571,68kJ
Phản ứng trên là phản ứng
không có sự thay đổi năng lượng.
có sự hấp thụ nhiệt lượng từ môi trường xung quanh.
thu nhiệt.
tỏa nhiệt.
Biết rằng ở điều kiện chuẩn, 1 mol ethanol cháy tỏa ra một nhiệt lượng là 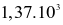 kJ. Nếu đốt cháy hoàn toàn 15,1 gam ethanol, năng lượng được giải phóng ra dưới dạng nhiệt bởi phản ứng là
kJ. Nếu đốt cháy hoàn toàn 15,1 gam ethanol, năng lượng được giải phóng ra dưới dạng nhiệt bởi phản ứng là
0,450 kJ.
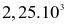 kJ.
kJ.
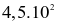 kJ.
kJ.
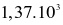 kJ.
kJ.
Cho các phản ứng hóa học sau đây (ở điều kiện chuẩn):
(1) 2H2(g) + O2(g) → 2H2O(l) 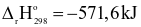
(2) CaCO3(s) → CaO(s) + CO2(g) 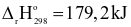
(3) CaO(s) + H2O(l) → Ca(OH)2(aq)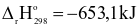
Mỗi phát biểu sau là đúng hay sai?
(a) Các phản ứng (1) và (3) là phản ứng tỏa nhiệt.
(b) Phản ứng (2) là phản ứng tỏa nhiệt.
(c) Nhiệt tạo thành chuẩn của H2O(l) là -571,6 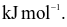
(d) Về mặt năng lượng, phản ứng (3) thuận lợi hơn phản ứng (1) và (2).
Cho phương trình nhiệt hoá học của phản ứng:
N2(g) + O2(g)  2NO(g)
2NO(g) ![]()
(a) Phản ứng trên hấp thụ nhiệt năng từ môi trường.
(b) Nhiệt tạo thành chuẩn của NO (g) là +179,20 kJ/mol.
(c) Phản ứng trên xảy ra dễ dàng ở điều kiện thường.
(d) Để tạo thành 30 gam NO (g) từ N2(g) và O2 (g) ở điều kiện chuẩn cần cung cấp nhiệt lượng tối thiểu là 89,6 kJ.
Khí hydrogen cháy trong không khí tạo thành nước theo phương trình hoá học sau:
2H2(g) + O2(g)  2H2O(g) (1)
2H2O(g) (1) 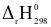 = - 483,64 kJ
= - 483,64 kJ
(a) Nhiệt tạo thành của H2O(g) là -483,64kJ/mol.
(b) Tổng năng lượng của hỗn hợp 1 mol oxygen (gas) và 2 mol hydrogen (gas) có năng lượng lớn hơn năng lượng của 2 mol nước (hơi).
(c) Phản ứng (1) là phản ứng tỏa nhiệt.
(d) Khi tạo thành 27 gam nước (gas) thì phản ứng đã cung cấp cho môi trường một lượng nhiệt là 725,46 kJ.
Cho hai phương trình nhiệt hóa học sau:
(1) 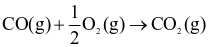
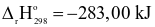
(2) 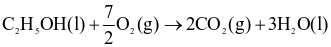

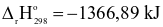
(a) Khi đốt cháy cùng 1 mol CO và 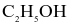 thì phản ứng (2) tỏa ra lượng nhiệt lớn hơn phản ứng (1).
thì phản ứng (2) tỏa ra lượng nhiệt lớn hơn phản ứng (1).
(b) Phương trình (1) là phương trình nhiệt tạo thành CO2(g).
(c) Trong phản ứng (1) thì 1 mol 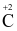 nhận 2 mol electron.
nhận 2 mol electron.
(d) Đốt cháy 0,5 kg cồn 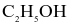 thì tỏa ra nhiệt lượng là 14 857,5 kJ
thì tỏa ra nhiệt lượng là 14 857,5 kJ
Cho các đơn chất sau đây: C(graphite, s); Br2(l); Br2(g); Na(s); Hg(l); Hg(s). Số đơn chất có 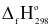 = 0?
= 0?
Một người thợ xây trong buổi sáng kéo được 500 kg vật liệu xây dựng lên tầng cao 10m. Để bù vào năng lượng đã tiêu hao, người đó cần uống cốc nước hòa tan m gam glucose. Biết nhiệt tạo thành của glucose (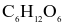 ),
), 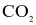 và
và 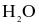 lần lượt là -1271, -393,5 và -285,8 kJ/mol. Giá trị của m bằng bao nhiêu?
lần lượt là -1271, -393,5 và -285,8 kJ/mol. Giá trị của m bằng bao nhiêu?
Trong ngành công nghệ lọc hóa dầu, các alkane thường được loại bỏ hydrogen trong các phản ứng dehydro hóa để tạo ra những sản phẩm hydrocarbon không no có nhiều ứng dụng trong công nghiệp.
Dựa vào năng lượng liên kết, tính biến thiên enthalpy chuẩn của phản ứng (đơn vị kJ):
H3C – CH2 – CH2 – CH3 → CH2 = CH – CH = CH2 + 2H2
Cho biết:
| Liên kết | E b (kJ/mol) | Liên kết | Eb (kJ/mol) |
| C=C | 611 | H–H | 436 |
| C–H | 414 | C-C | 347 |
Hướng dẫn giải
Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:
| Liên kết | C – H | C – C | C = C |
| E b (kJ/mol) | 418 | 346 | 612 |
Biến thiên enthalpy chuẩn của phản ứng C3H8(g) ⟶ CH4(g) + C2H4(g) là bao nhiêu kJ?
Cho phản ứng đốt cháy octane như sau:
C8H18 (g) + 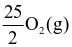 → 8CO2 (g) + 9H2O (l)
→ 8CO2 (g) + 9H2O (l) 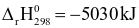
Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:
| Liên kết | C – H | C – C | O = O | C = O | H - O |
| E b (kJ/mol) | 414 | 347 | 498 | 799 | x |
Giá trị của x là bao nhiêu?
Cho phản ứng:
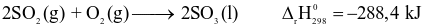
Nhiệt tạo thành chuẩn của khí SO2là bao nhiêu kJ/mol? Biết 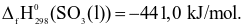 (Làm tròn kết quả đến hàng đơn vị)
(Làm tròn kết quả đến hàng đơn vị)


