Đề kiểm tra Hóa 10 Kết nối tri thức Chương 2 có đáp án - Đề 2
28 câu hỏi
Nguyên tử của nguyên tố neon có 10 electron. Trong bảng tuần hoàn, nguyên tố neon thuộc ô số bao nhiêu?
12.
11.
10.
9.
Trong bảng tuần hoàn, nguyên tố chlorine (Cl) nằm ở chu kì 3, nhóm VIIA. Cấu hình electron của Cl là
1s22s22p5.
1s22s22p63s23p5.
1s22s22p63s2.
1s22s22p63s23p3.
Nguyên tử iron (Fe) có Z = 26. Vị trí của Fe trong bảng tuần hoàn là
ô 26, chu kì 4, nhóm IIA.
ô 24, chu kì 4, nhóm VIIIB.
ô 26, chu kì 4, nhóm VIIIB.
ô 26, chu kì 3, nhóm IIA.
Các khối nguyên tố d và f đều là
khí hiếm.
phi kim.
phi kim hoặc kim loại.
kim loại.
Nguyên tử aluminium (Al) có số hiệu nguyên tử là 13. Nguyên tố Al là
nguyên tố s.
nguyên tố p.
nguyên tố
nguyên tố f.
Cho các nguyên tố sau: O (Z = 8); F (Z = 9); Na (Z = 11); S (Z = 16). Những nguyên tố thuộc cùng một nhóm là
O, Na và S.
F và Na.
Na và S.
O và S.
Độ âm điện (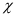 ) là đại lượng đặc trưng cho
) là đại lượng đặc trưng cho
khả năng nhường electron liên kết của một nguyên tử trong phân tử.
khả năng hút electron liên kết của một nguyên tử trong phân tử.
số nguyên tử của một nguyên tố trong phân tử.
khối lượng của nguyên tố trong phân tử.
Trong một nhóm, theo chiều tăng dần điện tích hạt nhân, độ âm điện của các nguyên tử nguyên tố có xu hướng
tăng dần.
giảm dần.
không thay đổi.
giảm sau đó tăng dần.
Phát biểu nào sau đây không đúng?
Trong một nhóm A, theo chiều tăng điện tích hạt nhân, tính kim loại của các nguyên tố có xu hướng tăng dần, tính phi kim của các nguyên tố có xu hướng giảm dần.
Tính kim loại và tính phi kim luôn biến đổi ngược chiều nhau.
Độ âm điện và tính phi kim của các nguyên tử nguyên tố hóa học biến đổi ngược chiều trong một chu kì và một nhóm.
Cs là kim loại mạnh nhất, F là phi kim mạnh nhất.
Nguyên tố Cl ở nhóm VIIA, oxide cao nhất của nguyên tố Cl là
Cl2O3.
Cl2O4.
Cl2O.
Cl2O7.
Oxide nào sau đây vừa có tính acid, vừa có tính base?
Na2O.
Cl2O7.
Al2O3.
MgO.
Cho các nguyên tố X, Y, Z có số hiệu nguyên tử lần lượt là 9, 15, 17. Thứ tự tính phi kim tăng dần là
Y, Z, X.
X, Z, Y.
Z, X, Y.
Y, X, Z.
Nguyên tử của nguyên tố chlorine có Z = 17. Hydroxide cao nhất của nguyên tố này có
tính acid mạnh.
tính acid yếu.
tính base mạnh.
tính base yếu.
Nguyên tố X có Z = 9. Hãy có biết tính chất hóa học cơ bản của X (X là kim loại hay phi kim, mạnh hay yếu)?
Tính phi kim yếu.
Tính kim loại yếu.
Tính phi kim mạnh.
Tính kim loại mạnh.
Nguyên tố neon có Z = 10. Cấu hình electron nguyên tử của neon là
1s22s22p5.
1s22s22p6.
1s22s22p63s1.
1s22s22p63s2.
Nguyên tử zinc có Z = 30. Vị trí của nguyên tố zinc trong bảng tuần hoàn là
ô 30, chu kì 4, nhóm VIIIB.
ô 30, chu kì 4, nhóm IIB.
ô 30, chu kì 3, nhóm VIIIB.
ô 30, chu kì 3, nhóm IIB.
Nguyên tố sodium thuộc chu kì 3, nhóm IA. Khi tham gia phản ứng hóa học, sodium dễ
nhận 1 electron.
nhường 1 electron.
nhận 2 electron.
nhường 2 electron.
Cation R+ có cấu hình electron ở phân lớp ngoài cùng là 3p6. Vị trí của nguyên tố R trong bảng tuần hoàn là
ô 18, chu kì 3, nhóm IIA.
ô 19, chu kì 4, nhóm IIA.
ô 18, chu kì 3, nhóm VIIIA.
ô 19, chu kì 4, nhóm IA.
Ion X+ và Y2- cùng có cấu hình electron là [Ar]. Trong các phát biểu sau, phát biểu nào đúng, phát biểu nào sai?
(a) Số thứ tự ô nguyên tố X, Y hơn kém nhau 3 đơn vị.
(b) X là nguyên tử kim loại, Y là nguyên tử phi kim.
(c) Cả X, Y đều thuộc chu kì 3 cùng với Ar.
(d) Số thứ tự nhóm A của X, Y hơn kém nhau 5 đơn vị.
Nguyên tố sulfur (S) ở ô số 16. Trong các phát biểu sau, phát biểu nào đúng, phát biểu nào sai?
(a) Nguyên tử S có 4 electron ở lớp ngoài cùng.
(b) Nguyên tử S ở chu kì 6.
(c) S có công thức oxide cao nhất là SO3.
(d) S là phi kim.
Xét hai nguyên tố X và Y thuộc cùng chu kì 3 của bảng tuần hoàn. Nguyên tố X có độ âm điện lớn hơn nguyên tố Y. Mỗi phát biểu sau là đúng hay sai?
(a) Bán kính nguyên tử của X lớn hơn Y.
(b) Nếu liên kết X - Y được hình thành, thì cặp electron liên kết sẽ bị lệch về phía nguyên tử X.
(c) Điện tích hạt nhân nguyên tử X nhỏ hơn điện tích hạt nhân nguyên tử Y.
(d) Oxide cao nhất của X sẽ có tính acid mạnh hơn oxide cao nhất của Y.
Oxide ứng với hóa trị cao nhất của một nguyên tố R có công thức thực nghiệm là R2O5. Oxide này là một chất hút nước mạnh, được sử dụng trong tổng hợp chất hữu cơ. Hợp chất khí của R với hydrogen có chứa 8,82% khối lượng hydrogen là chất khí không màu, rất độc, kém bền, sinh ra trong quá trình phân hủy xác động thực vật.
(a) Tính phi kim của R mạnh hơn của nguyên tố S (sulfur).
(b) Nguyên tố R thuộc ô số 15, chu kì 3, nhóm VA.
(c) Khi cho 1 mol hydroxide ứng với hóa trị cao nhất của R tác dụng với dung dịch NaOH dư thì số mol NaOH phản ứng là 3.
(d) Trong công thức oxide cao nhất của R thì R chiếm 34,66% về khối lượng.
Nguyên tử X có 22 electron ở lớp vỏ. Trong bảng tuần hoàn, nguyên tố X thuộc chu kì nào?
Nguyên tố phổ biến nhất trên vỏ Trái Đất nằm ở ô số bao nhiêu trong bảng tuần hoàn?
Cation M3+ có cấu hình electron lớp ngoài cùng là 2s22p6. Hãy xác định số thứ tự nhóm của M trong bảng tuần hoàn? (viết số thường, không viết số La mã)
X là một nguyên tố chu kì 3, nguyên tử có 5 electron lớp ngoài cùng. Tổng số nguyên tử có trong một phân tử hydroxide cao nhất của X là bao nhiêu?
Xét 3 nguyên tố X, Y, T có số thứ tự và cấu hình electron tương ứng như sau:
X: 1s22s1 (1)
Y: 1s22s22p63s1 (2)
T: 1s22s22p63s23p64s1 (3)
Nguyên tố có tính kim loại yếu nhất có số thứ tự là bao nhiêu?
Nguyên tử R có tổng số hạt cơ bản là 52, trong đó số hạt không mang điện trong hạt nhân gấp 1,059 lần số hạt mang điện tích âm. R thuộc ô thứ bao nhiêu trong bảng tuần hoàn các nguyên tố hóa học?


