30 câu hỏi
Chất nào sau đây là muối axit?
KNO₃.
NaHSO₄.
Na₂CO₃
KClO₃.
Xét các phát biểu sau về N₂
a) Trong phòng thí nghiệm khí N₂ được thu bằng phương pháp đẩy nước.
b) Phân tử N₂ có liên kết 3 rất bền.
c) N₂ không duy trì sự cháy và sự hô hấp.
d) Ở điều kiện thường, N₂ khá trơ về mặt hóa học.
e) N₂ có nhiệt độ hóa lỏng thấp hơn O₂.
Số phát biểu đúng là
4
5
3
2
Hình bên là nitơ lỏng.

Ứng dụng của nitơ lỏng là
bảo quản máu
tổng hợp khí amoniac.
sản xuất phân đạm.
tổng hợp axit nitric.
Cho dãy các chất sau: Al(OH)₃, NaHCO₃, (NH₄)₂CO₃, NH₄Cl, CaCO₃, K₂SO₄. Có bao nhiêu chất trong dãy vừa tác dụng được với dung dịch HCl, vừa tác dụng được với dung dịch NaOH?
2
4
5
3
100 mL dung dịch Ba(OH)₂ nồng độ 0,05M có pH bằng
13.
2,3.
2
11,7.
Ở 25⁰C, tích số ion nước có giá trị bằng?
10⁷.
10⁻⁷.
10¹⁴.
10⁻¹⁴.
Cho 0,005 mol muối NH₄Cl vào 100 mL dung dịch chứa NaOH và Ba(OH)₂ có pH = 13 và đun sôi dung dịch, sau đó làm nguội và thêm vào một ít quỳ tím, dung dịch thu được có
màu hồng.
không màu.
màu xanh.
màu tím.
Phát biểu nào sau đây về khí amoniac KHÔNG đúng?
Là khí không màu.
Nhẹ hơn không khí.
Có mùi khai và xốc.
Ít tan trong nước
Nitơ là nguyên tố thuộc chu kì II, nhóm VA trong bảng HTTH. Cấu hình electron lớp ngoài cùng của nguyên tử N là
2s²2p³.
2s²2p⁴.
2s²2p⁵.
2s²2p⁶.
Khí nitơ tác dụng với khí oxi (tia lửa điện) sinh ra khí không màu là
N₂O.
NO₂
N₂O₄.
NO.
Ô nhiễm không khí có thể tạo ra mưa axit, gây ra tác hại rất lớn với môi trường. Khi cho axit nitric tác dụng với kim loại sinh ra khí X là một trong những nguyên nhân gây ra mưa axit. Khí X là
N₂.
NO₂.
NH₃.
N₂O.
Trong phòng thí nghiệm, khí NH₃ được điều chế bằng cách
Đun nóng muối NH₄Cl với Ca(OH)₂
Đun nóng hỗn hợp khí N₂ và H₂.
Cho kim loại Al tác dụng với HNO₃ đặc.
Nhiệt phân muối NH₄Cl.
Vào tháng 8 năm 2020, hai vụ nổ xảy ra tại bến cảng của thành phố Beirut, thủ đô Liban gây ra rất nhiều thiệt hại. Nguyên nhân của vụ nổ là 2750 tấn phân bón amoni nitrat, bị tịch thu từ con tàu bỏ hoang MV Rhosus và được cất giữ tại cảng suốt sáu năm mà không có biện pháp phòng ngừa nào. Công thức amoni nitrat là

NH₄NO₂.
NH₄Cl.
NH₄NO₃.
(NH₄)₂CO₃.
Phương trình điện li nào sau đây đúng?
KNO₃ → K²⁺ + NO₃²⁻
K₃PO4 → 3K+ + PO₄³⁻
HClO → H⁺ + ClO⁻
NaF ⇄ Na⁺ + F⁻
Trong dãy các chất sau: NaHCO₃, K₂HPO₄, NaHSO₄,Ca(HSO₃)₂, Na₂SO₃. Số chất là muối axit bằng?
5
3
4
2
Dung dịch axit nitric khi có ánh sáng bị phân hủy một phần giải phóng khí
N₂.
NH₃.
NO₂.
NO.
Chỉ số pH bình thường của dạ dày là từ 1,6 đến 2,4. Môi trường trong dạ dày là môi trường gì?
Axit.
Bazơ.
Trung tính.
Không xác định.
Dùng axit nitric dư để hòa tan hoàn toàn 16 gam hỗn hợp Mg, Fe (tỉ lệ mol 1:1), thu được dung dịch Y (chỉ chứa hai muối và axit dư) và V lít (đktc) hỗn hợp khí X (gồm NO và N₂O). Tỉ khối của X đối với H₂ bằng 16,4. Giá trị của V là
2,80.
5,60.
2,24.
4,48.
Chất nào sau đây là hiđroxit lưỡng tính?
Mg(OH)₂.
Ba(OH)₂.
KOH.
Zn(OH)₂.
Cho dung dịch Ba(NO₃)₂ tác dụng vừa đủ với 100 mL dung dịch Na₂SO₄ 0,5 M. Khối lượng kết tủa thu được bằng
23,3 gam.
17,475 gam.
7,77 gam.
11,65 gam.
Cho 25ml dung dịch (NH₄)₂SO₄ 1 M tác dụng với lượng dư NaOH. Thể tích khí NH₃ (đktc) thu được bằng
0,56 lit.
1,12 lit.
2,24 lit.
5,6 lit.
Nhỏ từ từ đến dư dung dịch NaOH loãng vào mỗi dung dịch sau: Ba(HCO₃)₂, FeCl₃, CuCl₂, AlCl₃, Mg(NO₃)₂. Sau khi các phản ứng xảy ra hoàn toàn, số trường hợp thu được kết tủa là
5
3
2
4
Cho từng chất: Fe, CuO, Cu(OH)₂, Fe(OH)₃, Fe₃O₄, Fe₂O₃, Fe(NO₃)₂, Fe(NO₃)₃, CuS, Fe₂(SO₄)₃, FeCO₃ lần lượt phản ứng với dung dịch HNO₃ đặc, nóng. Số trường hợp xảy ra phản ứng oxi hoá – khử là
4
5
3
6
Xét các phản ứng dưới đây:
a) NH₃ + H₂O + NaHCO₃.
b) NaHCO₃ + NaOH.
c) KHCO₃ + NH₄HSO₄.
d) Ca(HCO₃)₂ + Ca(OH)₂.
e) NaHCO₃ + Ba(OH)₂
Số phản ứng có phương trình ion thu gọn HCO₃⁻ + OH⁻ → H₂O + CO₃²⁻ là
2
1
0
3
Các dung dịch sau đây có cùng nồng độ mol/L, dung dịch nào dẫn điện tốt nhất?
C₆H₁₂O₆ (glucozơ).
Na₂SO₄.
NH₃ .
K₃PO₄.
Chất nào sau đây là chất điện li mạnh?
NaF.
CH₃COOH.
C₂H₅OH.
HClO.
Xét các phản ứng dưới đây
a) 4NH₃ + 5O₂ → 4NO + 6H₂O (t⁰ cao, xúc tác Pt)
b) NH₃ + HCl → NH₄Cl
c) 8NH₃ + 3Cl₂ → N₂ + 6NH₄Cl
d) 4NH₃ + 3O₂ → 2N₂ + 6H₂O (t⁰)
Số phản ứng mà NH₃ KHÔNG thể hiện tính khử là
4
1
3
2
Hòa tan 35,2 gam Fe₂O₃ vào dd HNO₃ loãng, dư thu được m gam muối nitrat. Giá trị của m là
53,24.
39,6.
106,48.
79,2.
Hình vẽ mô tả thí nghiệm sau chứng minh
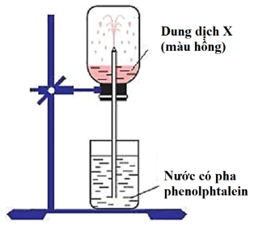
tính tan nhiều trong nước của HCl.
tính bazơ và tan nhiều trong nước của NH₃.
tính tan kém trong nước của NH₃.
tính axit của HCl.
Cho các phản ứng sau:
(a) FeS + 2HCl → FeCl₂ + H₂S;
(b) Na₂S + 2HCl → 2NaCl + H₂S;
(c) 2AlCl₃ + 3Na₂S + 6H₂O → 2Al(OH)₃ + 3H₂S + 6NaCl;
(d) KHSO₄ + KHS → K₂SO₄ + H₂S;
(e) BaS + H₂SO₄ (loãng) → BaSO₄ + H₂S.
Số phản ứng có phương trình ion rút gọn S²⁻ + 2H⁺ → H₂S là
4
2
1
3
