Bộ 3 đề thi giữa kì 2 Hóa 12 Cánh Diều có đáp án (Đề 1)
20 câu hỏi
Kí hiệu cặp oxi hoá − khử ứng với quá trình khử: Fe3+ + 1e → Fe2+ là
Fe3+/Fe2+.
Fe2+/Fe.
Fe3+/Fe.
Fe2+/Fe3+.
Dung dịch X chứa hỗn hợp các muối: MgCl2, CuCl2,FeCl2và NaCl. Kim loại tách ra đầu tiên ở cathode khi điện phân dung dịch là
Cu.
Mg.
Na.
Fe.
Sodium được sản xuất trong công nghiệp bằng phương pháp nào?
Phương pháp thủy luyện.
Phương pháp nhiệt luyện.
Phương pháp điện phân.
Phương pháp điện phân nóng chảy.
So với nguyên tử phi kim cùng chu kì, nguyên tử kim loại
thường có bán kính nguyên tử nhỏ hơn.
thường dễ nhận electron trong các phản ứng hoá học.
thường có số electron ở các phân lớp ngoài cùng nhiều hơn.
thường có năng lượng ion hoá nhỏ hơn.
Kim loại X là kim loại nhẹ, dẫn điện tốt và có lớp màng oxide bền vững bảo vệ nên được sử dụng rộng rãi làm dây dẫn điện ngoài trời. Kim loại X là
iron.
silver.
copper.
aluminium.
Chất nào dưới đây là thành phần chính của quặng bauxite?
Iron(II) oxide.
Iron(III) oxide
Aluminium oxide.
Iron(II) sulfide.
Hợp kim là
vật liệu kim loại thu được sau khi làm nóng chảy hỗn hợp gồm kim loại cơ bản và một số kim loại khác hoặc phi kim.
vật liệu kim loại có chứa kim loại cơ bản và một số kim loại khác hoặc phi kim.
là hỗn hợp kim loại nóng chảy, để nguội.
là hỗn hợp kim loại và phi kim nóng chảy, để nguội.
Để bảo quản potassium, người ta phải ngâm chìm potassium trong
nước.
ethanol.
dầu hỏa.
phenol lỏng.
Khi một vật bằng sắt tây (sát tráng thiếc) bị xây sát sâu tới lớp sắt bên trong để lâu trong không khí ẩm sẽ xảy ra quá trình nào sau đây?
Sn bị ăn mòn điện hoá.
Fe bị ăn mòn điện hoá.
Fe bị ăn mòn hoá học.
Sn bị ăn mòn hoá học.
Cho bột Fe vào dung dịch AgNO3 và Cu(NO3)2. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X gồm hai muối và chất rắn Y gồm hai kim loại. Hai muối trong X và hai kim loại trong Y lần lượt là
Cu(NO3)2; Fe(NO3)2 và Cu; Fe.
Cu(NO3)2; Fe(NO3)2 và Ag, Cu.
Fe(NO3)2; Fe(NO3)3 và Cu, Ag.
Cu(NO3)2; AgNO3 và Cu, Ag.
Để các hợp kim: Fe – Cu; Fe – C; Zn – Fe; Mg – Fe lâu ngày trong không khí ẩm. Số hợp kim mà trong đó Fe bị ăn mòn điện hoá là
1.
2.
3.
4.
Đun nóng tinh thể muối halide nào sau đây với dung dịch sulfuric acid đặc sẽ xảy ra phản ứng oxi hóa – khử?
NaCl.
NaF.
KCl.
KBr.
Cho sơ đồ (1) biểu diễn sự điện phân dung dịch CuSO4(aq) với điện cực trơ, sơ đồ (2) biểu diễn quá trình tinh luyện đồng (Cu) bằng phương pháp điện phân. Trong sơ đồ (2), các khối đồng có độ tinh khiết thấp được gắn với một điện cực của nguồn điện, các thanh đồng mỏng có độ tinh khiết cao được gắn với một điện cực của nguồn điện. Dung dịch điện phân là dung dịch CuSO4.
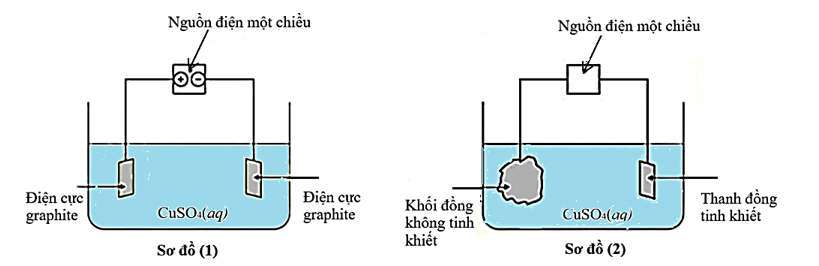
a). Trong sơ đồ (1), điện cực âm được gọi là cathode và điện cực dương gọi là anode.
b). Khi điện phân xảy ra ở sơ đồ (1), thì ban đầu ở cực âm xảy ra quá trình khử ion Cu2+ và ở cực dương xảy ra quá trình oxi hóa H2O.
c). Khi điện phân xảy ra ở sơ đồ (2), nồng độ ion Cu2+ trong dung dịch sẽ giảm dần theo thời gian.
d). Muốn tinh luyện Cu như sơ đồ (2) thì khối Cu không tinh khiết phải được nối vào anode, còn thanh Cu tinh khiết được nối vào cathode, khi đó khối lượng Cu tan ra từ anode bằng khối lượng Cu bám vào cathode.
Thực hiện thí nghiệm cho kim loại kiềm tác dụng với nước như sau: Cho mỗi mẩu kim loại và K bằng hạt đậu xanh vào các chậu thuỷ tinh tương ứng có chứa nước.
a). Mẩu kim loại Li chuyển động trên mặt nước nhanh nhất, có khí thoát ra.
b). Mẩu kim loại Na chuyển động nhanh trên mặt nước, tạo thành khối cầu và có khí thoát ra.
c). Mẩu kim loại K phản ứng với nước êm dịu hơn so với mẩu kim loại Li.
d). Cho mảnh giấy quỳ tím vào mỗi dung dịch sau phản ứng, thấy quỳ tím chuyển sang màu xanh.
Cho các cặp oxi hoá-khử của kimloại và thế điện cực chuẩn tương ứng:
Cặp oxi hoá - khử | Na+/Na | Cu2+/Cu | Ag+/Ag | Au3+/Au |
Thế điện cực chuẩn (V) | -2,713 | 0,340 | 0,799 | 1,52 |
Trong các kim loại trên, số kim loại tác dụng được với dung dịch HCl ở điều kiện chuẩn, giải phóng khí H2 là?
Cho các phát biểu sau đây về vị trí và cấu tạo của kim loại:
(1) Hầu hết các kim loại chỉ có từ 1 electron đến 3 electron lớp ngoài cùng.
(2) Tất cả các nguyên tố phân nhóm B (phân nhóm phụ) đều là kim loại.
(3) Ở trạng thái rắn, đơn chất kim loại có cấu tạo tinh thể.
(4) Các kim loại đều có bán kính nhỏ hơn các phi kim thuộc cùng 1 chu kì.
(5) Liên kết kim loại là liên kết được hình thành giữa các nguyên tử và ion dương kim loại trong mạng tinh thể do sự tham gia của các electron tự do.
Số phát biểu đúng là bao nhiêu?
Cho 3 mẫu hợp kim: Cu – Ag; Cu – Al; Cu – Zn. Nếu chỉ dùng dung dịch hydrochloric acid thì nhận biết được mấy mẫu hợp kim?
NaHCO3 được sử dụng làm bột nở do dễ phân hủy thành khí và hơi tạo ra các lỗ xốp trong bánh. Nếu sử dụng 8,4 gam NaHCO3 thì có thể tạo ra tối đa bao nhiêu lít khí CO2 (đkc)? (Làm tròn kết quả đến hàng phần trăm).
a) Lắp ráp pin điện hoá Sn -Cu ở điều kiện chuẩn. Cho biết các giá trị thế điện cực chuẩn: và . Sức điện động của pin điện hóa trên là bao nhiêu vôn? (Làm tròn kết quả đến phần trăm).
b) Hãy giải thích trường hợp sau: Để bảo vệ vỏ tàu biển làm bằng thép, người ta gắn chặt những tấm kẽm vào phần vỏ tàu ngâm trong nước biển.
a) Viết các phương trình hóa học xảy ra trong các trường hợp sau:
- Potassium tác dụng với nước.
- Điện phân dung dịch NaCl bão hòa, có màng ngăn.
- Sodium tác dụng với chlorine.
- Trung hòa dung dịch NaOH bằng dung dịch HCl.
b) Cho 0,53 gam muối carbonate của kim loại nhóm IA tác dụng với dung dịch HCl, thu được 123,95 mL khí CO2 (đkc). Xác định công thức hóa học của muối.





