Bộ 17 Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 2)
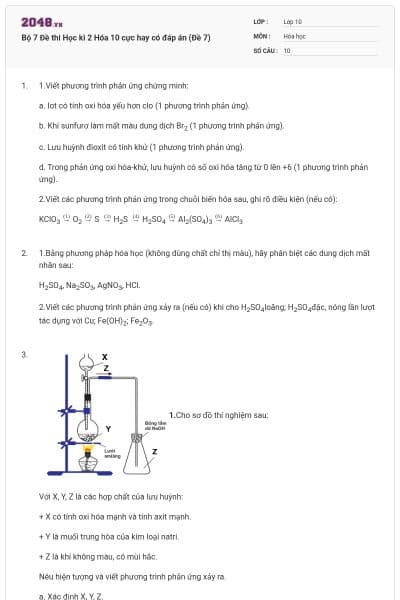
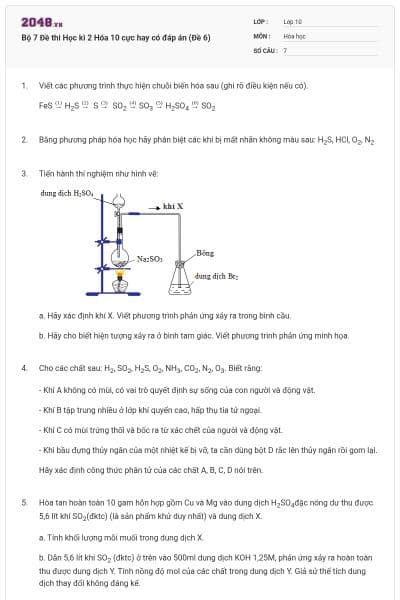
12 câu hỏi
Tính oxi hóa của các halogen giảm dần theo thứ tự:
Cl2>Br2>I2>F2.
F2>Cl2>Br2>I2.
I2>Br2>Cl2>F2.
Br2>F2>Cl2>I2.
Số oxi hóa của Clo trong các chất KClO4, HCl, NaClO lần lượt là
+5; +1; -1.
+5; -1; +1.
+7; -1; +1.
+7; +1; -1.
Dãy chất nào sau đây đều phản ứng với dung dịch axit H2SO4loãng?
NaOH, CuO, Mg.
Fe(OH)2, Na2O, Cu.
Fe, KOH, KCl.
BaO, Ag, Fe2O3.
Để nhận biết các dung dịch mất nhãn HCl, HI, Na2SO4dùng thuốc thử nào sau đây:
AgNO3.
Quỳ tím, BaCl2.
Quỳ tím, Ba(OH)2.
AgNO3, BaCl2.
Trong phòng thí nghiệm không dùng lọ thủy tinh để đựng hóa chất?
NaOH đặc.
Brom đậm đặc.
Axit H2SO4đặc.
Axit HF.
Cho 2,81 gam hỗn hợp (MgO, ZnO, Fe2O3) tác dụng vừa đủ với 400ml dung dịch HCl 0,1M. Khối lượng muối thu được là?
3,91g.
3,59g.
4,27g.
4,23g.
Sục khí SO2dư vào 200ml dung dịch NaOH 0,2M thu được khối lượng muối là?
4,61g.
5,04g.
4,16g.
5,4g.
Nhiệt phân hoàn toàn 12,25g KClO3thu được V lit O2ở đktc. Giá trị của V?
A.3,36.
4,48.
5,6.
2,24.
Cho phản ứng KClO3+ HCl → KCl + Cl2 + H2O. Tổng hệ số các chất trong phản ứng sau khi cân bằng (hệ số tối giản) là?
C.14.
12.
16.
18.
Cho phản ứng: 3H2+ N2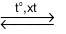 2NH3khi giảm áp suất cân bằng sẽ:
2NH3khi giảm áp suất cân bằng sẽ:
Không bị chuyển dịch.
Chuyển dịch từ phải sang trái.
Chuyển dịch từ trái sang phải.
Sẽ dừng lại.
(2,5 điểm).
Viết các phương trình phản ứng hóa học xảy ra theo sơ đồ sau (ghi rõ điều kiện):
FeS2  SO2
SO2 SO3
SO3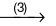 H2SO4
H2SO4  CuSO4
CuSO4 BaSO4
BaSO4
(2,5 điểm).
Cho 3,84 gam hỗn hợp A gồm Mg và FeO tác dụng với dung dịch HCl 0,25M thu được 2,24 lit khí ở đktc.
a, Tính phần trăm khối lượng mỗi chất trong hỗn hợp A.
b, Tính thể tích dung dịch axit HCl đã dùng.
c, Mặt khác, cho hỗn hợp A tác dụng với dung dịch H2SO4đặc nóng dư, thu được V lit hỗn hợp khí Y gồm SO2và H2S (ở đktc). Biết tỉ khối của Y so với H2bằng 26. Tính giá trị của V