Bài tập ôn tập Hóa 12 Kết nối tri thức Chương 7 có đáp án
50 câu hỏi
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Mỗi câu hỏi học sinh chỉ chọn một phương án.
Nguyên tử của các nguyên tố nhóm IA khác nhau về
số electron lớp ngoài cùng của nguyên tử.
cấu hình electron nguyên tử.
số oxi hóa của nguyên tử trong hợp chất.
kiểu mạng tinh thể của đơn chất.
Theo chiều tăng dần của điện tích hạt nhân nguyên tử, sự biến đổi tính chất của các nguyên tố nhóm IA nào sau đây đúng?
Bán kính nguyên tử giảm dần.
Nhiệt độ nóng chảy tăng dần.
Độ cứng giảm dần.
Khối lượng riêng của đơn chất giảm dần.
Kim loại Na, K thường được bảo quản trong
dầu hoả khan.
phenol.
ethanol.
bình hút ẩm.
Kim loại Li nên được bảo quản trong
dầu hoả khan.
phenol.
khí trơ.
bình hút ẩm.
Cho dãy các nguyên tố: Mg, K, Fe, Na, Al và Cs. Số nguyên tố thuộc nhóm IA là
1.
2.
3.
4.
Soda là hoá chất quan trọng trong sản xuất thuỷ tinh, bột giặt, phẩm nhuộm, giấy, sợi. Công thức hoá học của soda là
NaCl.
\({\rm{N}}{{\rm{a}}_2}{\rm{S}}{{\rm{O}}_4}.\)
\({\rm{NaN}}{{\rm{O}}_3}.\)
\({\rm{N}}{{\rm{a}}_2}{\rm{C}}{{\rm{O}}_3}.\)
Quá trình nào sau đây dùng để tách kim loại Na từ hợp chất?
Dung dịch NaOH tác dụng với dung dịch HCl.
Điện phân NaCl nóng chảy.
Dung dịch \({\rm{N}}{{\rm{a}}_2}{\rm{C}}{{\rm{O}}_3}\) tác dụng với dung dịch HCl.
Dung dịch NaCl tác dụng với dung dịch \({\rm{AgN}}{{\rm{O}}_3}.\)
Đặc điểm về tính chất vật lí nào sau đây không đúng với kim loại kiềm?
Khối lượng riêng nhỏ.
Nhiệt độ nóng chảy và nhiệt độ sôi thấp.
Độ cứng thấp.
Dẫn điện tốt hơn Ag.
Kim loại kiềm có độ cứng thấp, rất mềm (có thể cắt bằng dao, kéo) là do nguyên nhân nào sau đây?
Mạng tinh thể kim loại kiềm có liên kết kim loại yếu.
Kim loại kiềm có giá trị thế điện cực chuẩn âm.
Kim loại kiềm có cấu trúc tinh thể đặc khít.
Kim loại kiềm tan tốt trong nước.
Một loại muối (X) của kim loại kiềm được dùng làm phân bón, cung cấp cả hai nguyên tố dinh dưỡng đa lượng cho cây trồng. Công thức hoá học của muối X là
\({\rm{KN}}{{\rm{O}}_3}.\)
\({{\rm{K}}_2}{\rm{C}}{{\rm{O}}_3}.\)
\({\rm{NaN}}{{\rm{O}}_3}.\)
\({\rm{N}}{{\rm{a}}_3}{\rm{P}}{{\rm{O}}_4}.\)
X và Y là các hợp chất vô cơ của một kim loại kiềm, có nhiều ứng dụng trong thực tế và khi đốt nóng ở nhiệt độ cao trên đèn khí cho ngọn lửa màu vàng.
Biết chúng thoả mãn các sơ đồ sau:
Y là chất nào sau đây?
NaOH.
\({{\rm{K}}_2}{\rm{C}}{{\rm{O}}_3}.\)
\({\rm{N}}{{\rm{a}}_2}{\rm{C}}{{\rm{O}}_3}.\)
\({\rm{NaHC}}{{\rm{O}}_3}.\)
Phân kali đỏ (chứa KCl) là một loại phân bón đa lượng phổ biến trên thị trường vì giá thành rẻ, phù hợp rất nhiều loại đất khác nhau và hàm lượng potassium cao. Phân kali đỏ thường được sản xuất từ quặng sylvinite bằng cách tách muối KCl ra khỏi quặng theo sơ đồ sau:
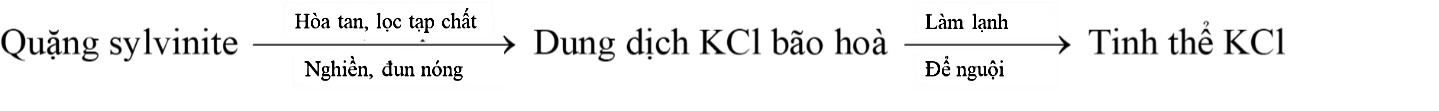
Phương pháp nào sau đây dùng để tách KCl ở trên?
Sắc kí.
Chưng cất.
Chiết.
Kết tinh.
Sodium hydrogencarbonate được sử dụng làm thuốc để hỗ trợ điều trị bệnh
đau dạ dày do dư acid.
đau dạ dày do thiếu acid.
thoái hoá cột sống.
viêm cơ.
Trong phương pháp Solvay, NaHCO3 được tách ra khỏi hỗn hợp phản ứng khá dễ dàng là do đây là hợp chất
dễ phân li.
không tan trong nước.
tan ít trong hỗn hợp phản ứng.
dễ bay hơi.
Hợp chất A tan nhiều trong nước; khi được đốt cháy trên ngọn lửa đèn khí thì tạo ra ngọn lửa màu vàng; khi tan trong dung dịch hydrochloric acid tạo ra khí, khí này làm đục nước vôi trong. Hợp chất A có thể là
K2CO3.
Na2CO3.C. \({\rm{CaC}}{{\rm{O}}_3}\) hoặc \({\rm{Ca}}{\left( {{\rm{HC}}{{\rm{O}}_3}} \right)_2}.\)
\({\rm{N}}{{\rm{a}}_2}{\rm{C}}{{\rm{O}}_3}\) hoặc \({\rm{NaHC}}{{\rm{O}}_3}.\)
Nướccứngkhônggâytáchạinàosauđây?
Làmgiảmkhảnăngtẩyrửacủaxàphòng,làm choquầnáomaumụcnát.
Gâylãngphínhiênliệuvàmấtantoàncho cácnồihơi,làmtắccácđườngốngnướcnóng.
Gâyngộđộcchonướcuống.
Làmhỏngdungdịchphachế,làmthựcphẩmlâuchínvà giảmmùivịcủathựcphẩm.
Số electron lớp ngoài cùng của các nguyên tử kim loại thuộc nhóm IIA là
3.
2.
4.
1.
Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của các kim loại nhóm IIA có dạng chung là
ns1.
ns2.
ns2np3.
ns2np5.
Trong nhóm IIA, nguyên tố phổ biến trong vỏ Trái Đất là
Rb và Sr.
Mg và Ba.
Mg và Ca.
Be và Ca.
Kim loại không phản ứng với nước là
Mg.
Ba.
Be.
Ca.
Khi đun nóng nước tự nhiên, muối nào sau đây bị phân huỷ tạo thành cặn đá vôi trong phích nước, ấm đun nước?
Ca3(PO4)2.
CaCl2.
CaSO4.
Ca(HCO3)2.
Trong chế độ dinh dưỡng hàng ngày, khi cơ thể không hấp thu được hoặc thiếu nguyên tố nào dưới đây sẽ dẫn đến nguy cơ loãng xương?
Ba.
Mg.
Be.
Ca.
Cho sơ đồ chuyển hoá sau:
CaO Y CaCO3 T CaSO4
Biết: X, Y, Z, T, E là các hợp chất khác nhau; mỗi mũi tên ứng với một phương trình hoá học. Các chất Z, E thoả mãn sơ đồ trên lần lượt là
Na2CO3, H2SO4.
CO2, KHSO4.
NaHCO3, Na2SO4.
CO2, BaSO4.
Khi đun nóng đến 60 °C, thạch cao sống mất một phần nước trở thành thạch cao nung, được dùng để đúc khuôn trong điêu khắc, bó bột trong y học. Thành phần chính của thạch cao nung là
CaSO4.0,5H2O.
Ca(H2PO4)2.
CaCO3.
Ca(OH)2.
Trong các mẫu nước cứng sau đây, nước cứng tạm thời là
dung dịch Ca(HCO3)2.
dung dịch MgSO4.
dung dịch CaCl2.
dung dịch Mg(NO3)2 .
Trong tự nhiên, magnesium có nhiều ở khoáng vật nào sau đây?
Dolomite.
Calcite.
Phosphorite.
Halite.
Có thể nhận biết dung dịch BaCl2 bằng dung dịch chất nào sau đây?
NaOH.
Na2CO3.
NaCl.
NaNO3.
Muối nào sau đây chỉ tồn tại trong dung dịch và bị phân huỷ khi đun nóng?
Ca(NO3)2.
Ca(HCO3)2.
CaCl2.
CaSO4.
Bình thuỷ dùng để đun nước lâu ngày bị đóng cặn, có thể dùng dung dịch nào sau đây để hoà tan lớp cặn?
Nước vôi.
Rượu uống.
Giấm ăn.
Muối ăn.
Độ tan trong dãy muối sulfate từ MgSO4 đến BaSO4 biến đổi như thế nào?
Tăng dần.
Giảm dần.
Không có quy luật.
Không đổi.
PHẦN II. Câu trắc nghiệm đúng sai. Trong mỗi ý a), b), c), d) ở mỗi câu, học sinh chọn đúng hoặc sai.
Thực hiện thí nghiệm cho kim loại kiềm tác dụng với nước như sau: Cho mỗi mẩu kim loại \({\rm{Li}},{\rm{Na}}\) và K bằng hạt đậu xanh vào các chậu thuỷ tinh tương ứng có chứa nước.
a. Mẩu kim loại Li chuyển động trên mặt nước chậm nhất, có khí thoát ra.
b. Mẩu kim loại Na chuyển động nhanh trên mặt nước, tạo thành khối cầu và có khí thoát ra.
c. Mẩu kim loại K chuyển động nhanh trên mặt nước, kèm theo cháy mạnh và có khí thoát ra.
d. Cho mảnh giấy quỳ tím vào mỗi dung dịch sau phản ứng, thấy quỳ tím chuyển màu hồng.
Trong phòng thí nghiệm, để phân biệt các ion \({\rm{L}}{{\rm{i}}^ + },{\rm{N}}{{\rm{a}}^ + }\)và \({{\rm{K}}^ + }\)với nhau, người ta nhúng đầu đũa thuỷ tinh trong dung dịch muối bão hoà của các kim loại trên rồi đốt trên đèn khí.
a. Ngọn lửa khi đốt hợp chất của Li cho màu đỏ tía.
b. Ngọn lửa khi đốt hợp chất của Na cho màu vàng.
c. Chỉ các kim loại kiềm mới có hiện tượng tạo màu đặc trưng khi đốt cháy.
d. Thí nghiệm trên dựa vào hiện tượng màu ngọn lửa đặc trưng của kim loại kiềm khi đốt.
Công đoạn chính của công nghiệp chlorine – kiềm là điện phân dung dịch sodium chlorine bão hòa trong bể điện phân có màng ngăn xốp. Phương trình hóa học của quá trình điện là: 2NaCl + 2H2O 2NaOH + H2 + Cl2.
a. Anion Cl – bị khử thành khí chlorine tại anode.
b. Tại cathode, thu được đồng thời dung dịch bão hòa và tinh thể sodium hydroxide.
c. Nếu không có màng ngăn xốp, nước Javel được hình thành trong bể điện phân.
d. Hydrogen cũng là một sản phẩm có giá trị của công nghiệp chlorine – kiềm.
Soda là hoá chất được sử dụng rộng rãi trong ngành công nghiệp hoá chất, hiện nay ở Việt Nam trung bình cần \({5.10^5}\) tấn/năm. Phương pháp Solvay với nguyên liệu đầu vào là đá vôi và muối ăn nên giá thành rẻ, phù hợp với sản xuất tại Việt Nam.
a. Soda được dùng để làm mềm nước cứng, sản xuất thuỷ tinh, giấy, hoá chất,...
b. Phương pháp Solvay giảm thiểu tác động tới môi trường do tuần hoàn tái sử dụng các sản phẩm trung gian như \({\rm{N}}{{\rm{H}}_3},{\rm{C}}{{\rm{O}}_2}, \ldots \)
c. Trong phương pháp Solvay, \({\rm{N}}{{\rm{H}}_3}\) được tái chế qua phương trình hoá học sau:
\(2{\rm{N}}{{\rm{H}}_4}{\rm{Cl}} + {\rm{CaO}} \to 2{\rm{N}}{{\rm{H}}_3} + {\rm{CaC}}{{\rm{l}}_2} + {{\rm{H}}_2}{\rm{O}}\)
d. Phương pháp Solvay chỉ xảy ra theo một giai đoạn sau:
\(2{\rm{NaCl}} + 2{\rm{N}}{{\rm{H}}_3} + {\rm{C}}{{\rm{O}}_2} + {{\rm{H}}_2}{\rm{O}} \to 2{\rm{N}}{{\rm{H}}_4}{\rm{Cl}} + {\rm{N}}{{\rm{a}}_2}{\rm{C}}{{\rm{O}}_3}\)
Magnesium \(({\rm{Mg}})\) là kim loại được ứng dụng để tạo các hợp kim nhẹ, bền, đặc biệt là cho ngành công nghiệp sản xuất ô tô và hàng không vũ trụ. Magnesium được sản xuất trong công nghiệp theo quá trình Pidgeon với nguyên liệu ban đầu là quặng dolomite. Quá trình được thực hiện qua các giai đoạn sau:
Giai đoạn 1. Nung quặng dolomite:
Giai đoạn 2. Dùng Si trong ferrosilicon \(({\rm{Fe}},{\rm{Si}})\) làm chất khử trong điều kiện chân không:
Phản ứng chung của quá trình Pidgeon là:
a. Quá trình Pidgeon là quá trình thu nhiệt.
b. Phản ứng ở giai đoạn (2) thuộc phương pháp nhiệt luyện.
c. Phản ứng ở giai đoạn (2) chứng tỏ MgO có tính oxi hoá mạnh hơn CaO.
d. Nếu hiệu suất của quá trình là 90% thì cứ 1 tấn quặng dolomite sẽ điều chế được 120 kg kim loại magnesium.
Giá trị biến thiên enthalpy chuẩn của phản ứng nhiệt phân muối nitrate của kim loại nhóm IIA (R) (R(NO3)2(s) RO(s) + 2NO2(g) + \(\frac{1}{2}\)O2(g)) theo bảng sau:
Muối R(NO3)2(s) | Mg(NO3)2 | Ca(NO3)2 | Sr(NO3)2 | Ba(NO3)2 |
\({\Delta _r}H_{298}^o(kJ)\) | 255,2 | 369,5 | 452,4 | 506,2 |
a. Độ bền nhiệt của các muối nitrate của kim loại nhóm IIA có xu hướng tăng dần từ \[Mg{\left( {N{O_3}} \right)_2}\]tới\[Ba{\left( {N{O_3}} \right)_2}.\]
b. Dựa vào bảng giá trị biến thiên enthalpy chuẩn ở trên có thể dự đoán xu hướng biến đổi độ bền nhiệt của\[R{\left( {N{O_3}} \right)_2}.\]
c. Phản ứng nhiệt phân muối nitrate của kim loại nhóm IIA \[\left( {R{{\left( {N{O_3}} \right)}_2}} \right)\] là phản ứng oxi hoá – khử, trong đó vai trò chất oxi hoá là\[{R^{2 + }}.\;\]
d. Nhiệt độ phân huỷ theo thứ tự sau: \[Mg{\left( {N{O_3}} \right)_2} < {\rm{ }}Ca{\left( {N{O_3}} \right)_2} < {\rm{ }}Sr{\left( {N{O_3}} \right)_2} < {\rm{ }}Ba{\left( {N{O_3}} \right)_2}.\;\]
Một loại nước cứng có thành phần ion như sau:
Ion | Nồng độ (M) |
Calcium (Ca2+) | 0,02 |
Sodium (Na+) | 0,03 |
Hydrogen carbonate (\(HCO_3^ - \)) | x |
a.Nước cứng đã nêu có tính cứng vĩnh cửu.
b.Giá trị của x là 0,05.
c. Có làm mềm mẫu nước cứng trên bằng cách đun nóng.
d.Để làm mềm 1 lít nước cứng trên, cần dùng ít nhất 40 mL dung dịch NaOH 0,5 M.
Xét các phản ứng phân hủy sau:
CaCO3 (s) CaO (s) + CO2 (g) (1)
BaCO3 (s) BaO (s) + CO2 (g) (2)
Biến thiên enthalpy chuẩn (\({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\)) của phản ứng thuận ở mỗi cân bằng (1) và (2) khi phân hủy 1 mol mỗi chất lần lượt có giá trị là 108,7 kJ và 271,5 kJ.
a. Nhiệt lượng tỏa ra khi phân hủy 1 mol BaCO3 lớn hơn nhiệt lượng tỏa ra khi phân hủy 1 mol CaCO3.
b. BaCO3 bị phân hủy ở nhiệt độ cao hơn CaCO3.
c. Khi tăng nhiệt độ, cả hai phản ứng đều dịch chuyển theo chiều thuận.
d. CO2 cần được lấy ra khỏi lò nung để tăng hiệu suất của phản ứng.
Trong bảng Hệ thống tuần hoàn, sodium (IA) và magnesium (IIA) đứng kề nhau trong một chu kì. Thế điện cực chuẩn của cặp Mg2+/Mg bằng –2,356 V, của cặp Na+/Na bằng –2,710 V.
a. Mg và Na là các kim loại có tính khử mạnh.
b. Mg có tính khử mạnh hơn Na.
c. Mg và Na đều phản ứng mãnh liệt với nước ở điều kiện thường.
d. Ion Mg2+ có tính oxi hóa mạnh hơn ion Na+.
Các muối carbonate của kim loại nhóm IIA đều bị phân hủy bởi nhiệt:
MCO3(s) MO (s) + CO2 (g)
Biến thiên enthalpy chuẩn của quá trình trên được cho trong bảng sau:
Muối | MgCO3 (s) | CaCO3 (s) | SrCO3 (s) | BaCO3 (s) |
∆rH˚298 (kJ) | 100,70 | 179,20 | 234,60 | 271,50 |
a. Phản ứng phân hủy muối carbonate của các kim loại nhóm IIA trên đều là phản ứng thuận lợi về mặt năng lượng.
b. Độ bền nhiệt các muối carbonate của kim loại nhóm IIA tăng dần khi số hiệu nguyên tử của M tăng dần.
c. Khi để vôi bột (thành phần chính là CaO) lâu ngoài không khí có hiện tượng vôi bột dần bị chuyển hóa lại thành đá vôi (thành phần chính là CaCO3).
d. Để sản xuất 1 tấn vôi bột theo phương pháp thủ công, người ta nung đá vôi (có hàm lượng CaCO3 là 72%, còn lại là tạp chất trơ) với than đá (giả sử chỉ chứa carbon và tạp chất trơ), biết = 393,50 kJ.mol−1. Khi đó, thể tích khí CO2 tối thiểu đã thải ra môi trường ở điều kiện chuẩn nhiều hơn 82,0 m3.
PHẦN III. Câu trắc nghiệm yêu cầu trả lời ngắn
Ở 20oC, độ tan của NaCl trong nước là 35,9 g trong 100 g nước. Ở nhiệt độ này, dung dịch NaCl bão hòa có nồng độ a%. Giá trị của a là bao nhiêu? (Làm tròn kết quả đến hàng phần mười).
Điện phân 2 lít dung dịch NaCl 0,5 M với điện cực trơ, màng ngăn xốp bằng dòng điện có cường độ không đổi 0,2 A. Sau 1930 giây thì dừng điện phân, thu được dung dịch X (giả thiết thể tích dung dịch không đổi). Dung dịch X có pH bằng bao nhiêu? (Làm tròn kết quả đến hàng phần mười).
Hòa tan hết 2,34 gam kim loại kiềm R vào nước, thu được 0,7437 lít khí H2 (đkc). Để trung hòa dung dịch thu được, cần Vml dung dịch HCl 0,6 M. Giá trị của V là bao nhiêu?
Cho dung dịch chứa 0,1 mol NaHCO3 tác dụng với dung dịch Ba(OH)2 dư, thu được m gam kết tủa. Tính giá trị của m?
Ion Ca2+ cần thiết cho máu của người hoạt động bình thường. Nồng độ ion calcium không bình thường là dấu hiệu của bệnh. Để xác định nồng độ ion calcium, người ta lấy mẫu máu, sau đó kết tủa ion calcium dưới dạng calcium oxalate (CaC2O4) rồi cho calcium oxalate tác dụng với dung dịch potassium permanganate trong môi trường acid theo phản ứng sau:
Giả sử calcium oxalate kết tủa từ 1 mL máu một người tác dụng vừa hết với 2 mL dung dịch potassium permanganate \[\left( {KMn{O_4}} \right){\rm{ }}{5.10^{ - 4}}M.\] Xác định nồng độ ion calcium trong máu người đó bằng đơn vị \[mg{\rm{ }}C{a^{2 + }}/100{\rm{ }}mL\]máu.
Để đánh giá mức độ tự diễn biến của một phản ứng tại nhiệt độ T, người ta dựa vào đại lượng biến thiên năng lượng tự do Gibbs \[({\Delta _r}G_T^o).\] Nếu \[{\Delta _r}G_T^o > 0\]: phản ứng không tự xảy ra; \[{\Delta _r}G_T^o < 0\]: phản ứng tự xảy ra. Giá trị của đại lượng này được tính theo biểu thức:
\[{\Delta _r}G_T^o = {\rm{ }}{\Delta _r}H_T^o - {\rm{ }}T{\Delta _r}S_T^o.\] Trong đó:
· T: nhiệt độ tính theo thang Kelvin (K);
· \[{\Delta _r}H_T^o\]: Biến thiên enthalpy của phản ứng;
· \[{\Delta _r}S_T^o\]: Biến thiên entropy của phản ứng (đại lượng đặc trưng cho độ mất trật tự của hệ ở một trạng thái và điều kiện xác định).
Tính giá trị thấp nhất của T (làm tròn đến hàng đơn vị) để phản ứng sau tự xảy ra:
CaCO₃(s) → CaO(s) + CO₂(g)
Cho biết: \[{\Delta _r}S_T^o = 159,26{\rm{ }}J/mo{l^{ - 1}}.{K^{ - 1}}\]và nhiệt tạo thành chuẩn của các chất như sau:
Chất | CaCO₃(s) | CaO(s) | CO₂(g) |
\[{\Delta _f}H_{298}^o(kJ.mo{l^{ - 1}})\] | -1207,0 | -635,0 | -393,5 |
Giả sử \[{\Delta _r}H_T^o\] và \[{\Delta _r}S_T^o\] của quá trình không phụ thuộc vào nhiệt độ.
Ở điều kiện thường, tinh thể Ca có D = 1,55 g/cm3. Giả thiết các nguyên tử Ca là những hình cầu chiếm 74% thể tích tinh thể, phần còn lại là khe rỗng.
Cho biết:
- Công thức tính thể tích hình cầu: V = \[\frac{4}{3}\].π.r3
- Số Avogadro NA= 6,023.1023 và số pi π = 3,1416.
Bán kính nguyên tử Ca là bao nhiêu pm? (Làm tròn kết quả đến hàng đơn vị).
Làm mềm \(10\;{{\rm{m}}^3}\) nước cứng có tổng nồng độ \({\rm{M}}{{\rm{g}}^{2 + }}\) và \({\rm{C}}{{\rm{a}}^{2 + }}\) là \(5,5{\rm{mmol}}/{\rm{L}}\) bằng \({\rm{N}}{{\rm{a}}_2}{\rm{C}}{{\rm{O}}_3}\), thu được nước có tổng nồng độ \({\rm{M}}{{\rm{g}}^{2 + }}\) và \({\rm{C}}{{\rm{a}}^{2 + }}\) là \(1,5{\rm{mmol}}/{\rm{L}}\). Coi toàn bộ lượng \({\rm{N}}{{\rm{a}}_2}{\rm{C}}{{\rm{O}}_3}\) cho vào đều chuyển hết thành kết tủa \({\rm{CaC}}{{\rm{O}}_3}\) và \({\rm{MgC}}{{\rm{O}}_3}\). Khối lượng \({\rm{N}}{{\rm{a}}_2}{\rm{C}}{{\rm{O}}_3}\) đã dùng là bao nhiêu kg? (Làm tròn kết quả đến hàng phần trăm)
Vôi sống có nhiều ứng dụng như: sản xuất vật liệu xây dựng, vật liệu chịu nhiệt, khử chua đất trồng, tẩy uế, sát trùng, xử lí nước thải,... Hiện nay, nhiều lò nung vôi thủ công hoạt động tự phát, gây ảnh hưởng xấu đến môi trường xung quanh. Ở các lò nung vôi công nghiệp, quá trình kiểm soát phát thải ô nhiễm được thực hiện chặt chẽ hơn.
Xét một lò nung vôi công nghiệp sử dụng than đá làm nhiên liệu.
Giả thiết:
+ Đá vôi chỉ chứa CaCO3 và để phân hủy 1 kg đá vôi cần cung cấp một lượng nhiệt là 1800 kJ.
+ Đốt cháy 1 kg than đá giải phóng ra một lượng nhiệt là 27000 kJ và có 50% lượng nhiệt này được hấp thụ ở quá trình phân hủy đá vôi.
+ Công suất của lò nung vôi là 420 tấn vôi sống/ngày.
Tổng khối lượng (tấn) đá vôi và than đá mà lò nung vôi trên sử dụng mỗi ngày là bao nhiêu?
Nhiệt phân hoàn toàn 40g một loại quặng dolomite có lẫn tạp chất trơ sinh ra 9,916 lít khí CO2 (điều kiện chuẩn). Thành phần phần trăm về khối lượng của CaCO3.MgCO3 trong loại quặng nêu trên là bao nhiêu?


