Bài tập ôn tập Hóa 10 Chân trời sáng tạo Chương 3 có đáp án
50 câu hỏi
Liên kết σ là liên kết được hình thành do
sự xen phủ bên của 2 orbital.
cặp electron chung.
lực hút tĩnh điện giữa hai ion.
sự xen phủ trục của hai orbital.
Liên kết hóa học là
sự kết hợp giữa các hạt cơ bản hình thành nguyên tử bền vững.
sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
sự kết hợp của các phân tử hình thành các chất bền vững.
sự kết hợp của chất tạo thành vật thể bền vững.
Cho bảng số liệu sau:
| Chất | Nước (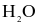 ) ) | Hydrogen sulfide (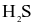 ) ) |
Nhiệt độ sôi 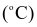 ở 1 atm ở 1 atm | 100,0 | - 60,7 |
Phát biểu nào sau đây sai?
Liên kết O – H trong phân tử 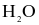 kém phân cực hơn liên kết S – H trong phân tử
kém phân cực hơn liên kết S – H trong phân tử 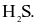
Số liên kết trong phân tử 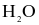 bằng số liên kết trong phân tử
bằng số liên kết trong phân tử 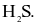
Trong phân tử 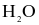 và phân tử
và phân tử 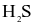 chỉ có các liên kết cộng hóa trị.
chỉ có các liên kết cộng hóa trị.
Do có liên kết hydrogen giữa các phân tử nên 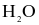 có nhiệt độ sôi cao hơn H2S.
có nhiệt độ sôi cao hơn H2S.
Khi hình thành liên kết hóa học, nguyên tử nào sau đây có xu hướng nhường 1 electron để đạt tới cấu hình electron bền vững theo quy tắc octet?
Al (Z = 13).
F (Z = 9).
Na (Z = 11).
Ne (Z = 10).
Chất nào sau đây không tạo được liên kết hydrogen giữa các phân tử?
2H5OH.
NH3.
HF.
CH4.
Phân tử nào sau đây có liên kết cộng hóa trị không phân cực?
KCl.
SO2.
HBr.
Cl2.
Trong phân tử carbon dioxide (O=C=O) số liên kết  và liên kết
và liên kết  lần lượt là
lần lượt là
0 và 4.
2 và 2.
3 và 1.
4 và 0.
Cho các hình biểu diễn sự xen phủ orbital nguyên tử để tạo liên kết hóa học sau:
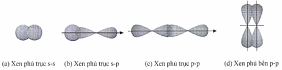
Biết số hiệu các nguyên tử của H, F và S lần lượt là 1, 9 và 16. Sự tạo liên kết trong các phân tử H2S và F2 theo kiểu xen phủ tương ứng là
(a) và (c).
(b) và (c).
(b) và (d).
(c) và (d).
Dãy gồm các chất trong phân tử chỉ có liên kết cộng hoá trị phân cực là
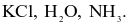

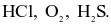
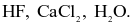
Phân tử nào sau đây chứa nguyên tử không tuân theo quy tắc octet?
Biết: H (Z = 1), B (Z = 5), C (Z = 6), N (Z = 7), O (Z = 8).
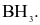
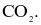
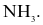
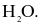
Trong phân tử HCl, số cặp electron dùng chung và cặp electron hóa trị riêng của nguyên tử Cl lần lượt là
1 và 4.
1 và 3.
3 và 1.
2 và 2.
Magnesium oxide thường được sử dụng để lót bên trong các lò công nghiệp vì có nhiệt độ nóng chảy cao. Loại liên kết hay tương tác hoá học trong magnesium oxide là
liên kết ion.
liên kết cộng hoá trị.
liên kết hydrogen.
tương tác van der Waals.
Vì sao các nguyên tử Ne (Z = 10) và Ar (Z = 18) hiếm khi tạo thành hợp chất?
Vì chúng có lớp electron ngoài cùng đã bão hoà.
Vì chúng có phân lớp electron bên trong đã được được điền đầy đủ.
Vì bán kính nguyên tử của chúng rất nhỏ.
Vì mỗi nguyên tử đã có đủ 8 electron.
Nitrogen là nguyên tố thuộc chu kì 2 và nhóm VA trong bảng tuần hoàn. Nitrogen có xu hướng nhường hay nhận bao nhiêu electron để đạt được cấu hình electron bền vững?
Nhường 5 electron.
Nhận 3 electron.
Nhường 3 electron.
Nhận 5 electron.
Trong các phân tử  số lượng phân tử chỉ chứa các liên kết cộng hoá trị không phân cực là
số lượng phân tử chỉ chứa các liên kết cộng hoá trị không phân cực là
2.
3.
4.
5.
Nguyên tử phosphorus và nguyên tử aluminium có xu hướng nhận hay nhường lần lượt bao nhiêu electron để đạt được cấu hình bền vững?
Nhận 5 electron, nhường 5 electron.
Nhận 3 electron, nhường 3 electron.
Nhường 3 electron, nhận 3 electron.
Nhường 5 electron, nhận 5 electron.
Số lượng electron tham gia hình thành liên kết đơn, đôi và ba lần lượt là
1, 2, 3.
2, 4, 6.
1, 3, 5.
2, 3, 4.
Giữa các nguyên tử khí hiếm Ar, có thể hình thành loại liên kết hay tương tác hoá học nào?
Liên kết ion.
Liên kết cộng hoá trị.
Liên kết hydrogen.
Tương tác van der Waals.
Trong các cặp nguyên tố sau, cặp nguyên tố nào có nhiều khả năng tạo thành liên kết ion nhất?
Nitrogen và oxygen.
Carbon và hydrogen.
Sulfur và oxygen.
Sodium và oxygen.
Trong số các cặp nguyên tố sau, cặp nguyên tố nào có nhiều khả năng tạo thành liên kết cộng hoá trị nhất?
K và O.
S và O.
Al và Mg.
Br và Na.
Liên kết ion có bản chất là
sự dùng chung các electron.
lực hút tĩnh điện của các ion mang điện tích trái dấu.
lực hút tĩnh điện giữa cation kim loại với các electron tự do.
lực hút giữa các phân tử.
Các nguyên tố F, Cl, Br và I đều thuộc nhóm VIIA và ở các chu kì tương ứng là 2, 3, 4 và 5. Dựa vào độ âm điện, liên kết cộng hoá trị trong phân tử HX (X là F, Cl, Br, I) nào phân cực mạnh nhất?
HF.
HCl.
HBr.
HI.
Cho bảng số lượng electron, neutron và proton của các phần tử (nguyên tử hoặc ion) sau:
| Phần tử | Số electron | Số neutron | Số proton |
| (a) | 8 | 8 | 8 |
| (b) | 10 | 12 | 11 |
| (c) | 19 | 20 | 19 |
| (d) | 18 | 18 | 17 |
Những phần tử thuộc loại ion là
(a) và (d).
(a) và (b).
(c) và (d).
(b) và (d).
Hợp chất trong phân tử có liên kết ion là
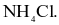
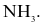
HBr.
Cho công thức Lewis của các phân tử sau:
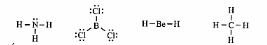
Số phân tử mà nguyên tử trung tâm không thoả mãn quy tắc octet là
1.
2.
3.
4.
Sodium hydride (NaH) là một hợp chất được sử dụng như một chất lưu trữ hydrogen trong các phương tiện chạy bằng pin nhiên liệu do khả năng giải phóng hydrogen của nó. Trong sodium hydride, nguyên tử sodium có cấu hình electron bền của khí hiếm
helium.
argon.
krypton
neon.
Cho hai nguyên tố X (Z = 20), Y (Z = 17). Công thức hợp chất tạo thành từ nguyên tố X, Y và liên kết trong phân tử là
XY: liên kết cộng hóa trị.
X2Y: liên kết ion.
X2Y3: liên kết cộng hóa trị.
XY2: liên kết ion.
Khi tham gia hình thành liên kết trong phân tử HF, F2; orbital tham gia xen phủ tạo liên kết của nguyên tử F thuộc về phân lớp nào, có dạng gì?
Phân lớp 2s, hình cầu.
Phân lớp 2s, hình số tám nổi.
Phân lớp 2p, hình số tám nổi.
Phân lớp 2p, hình cánh hoa.
Đặt độ dài các liên kết N – N, N = N và N ≡ N lần lượt là I1; I2 và I3. Thứ tự tăng dần độ dài các liên kết là
I1; I2; I3.
I1; I3; I2.
I2; I1; I3.
I3; I2; I1.
Chất vừa có liên kết cộng hoá trị phân cực, vừa có liên kết cộng hoá trị không phân cực là
CO₂.
H₂O.
NH3.
C₂F6.
Sodium fluoride (NaF) là thành phần hoạt chất phổ biến nhất trong kem đánh răng để ngăn ngừa sâu răng, hình thành men răng.
(a) Trong phân tử NaF, các nguyên tử Na và F đều đã đạt cấu hình bền của khí hiếm gần nhất.
(b) NaF là hợp chất cộng hóa trị phân cực.
(c) Khi hình thành liên kết trong phân tử NaF, nguyên tử Na có xu hướng nhường 1 electron, nguyên tử F có xu hướng nhận 1 electron.
(d) Nguyên tử Na có 2 electron hóa trị, nguyên tử F có 5 electron hóa trị.
Cho các hợp chất sau: 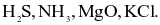
(a) Có 3 hợp chất ion.
(b) 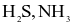 là các hợp chất cộng hóa trị.
là các hợp chất cộng hóa trị.
(c) Chỉ có KCl là hợp chất ion.
(d) Có 2 hợp chất ion là: MgO và KCl.
Độ âm điện của N và H tương ứng là 3,04 và 2,2.
(a) Liên kết H−N là liên kết cộng hoá trị không phân cực.
(b) Hợp chất  có nhiệt độ nóng chảy, nhiệt độ sôi cao.
có nhiệt độ nóng chảy, nhiệt độ sôi cao.
(c) Cặp electron dùng chung trong liên kết H−N lệch về phía nguyên tử N.
(d)  là hợp chất ion.
là hợp chất ion.
Các nguyên tố phổ biến thuộc nhóm halogen (VIIA) trong bảng tuần hoàn các nguyên tố hóa học gồm: F (Z = 9), Cl (Z = 17), Br (Z = 35) và I (Z = 53). Đơn chất halogen tồn tại dạng phân tử X2, giữa các phân tử X2 thường có tương tác với nhau.
Cho giá trị năng lượng liên kết X – X ở bảng sau:
| Liên kết | F – F | Cl – Cl | Br – Br | I – I |
Năng lượng liên kết (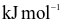 ) )ở | 159 | 243 | 193 | 151 |
Năng lượng liên kết X – X càng lớn thì liên kết càng bền.
(a) Liên kết giữa các nguyên tử trong 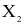 là liên kết cộng hóa trị không phân cực.
là liên kết cộng hóa trị không phân cực.
(b) Tương tác giữa các phân tử 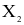 là tương tác van der Waals.
là tương tác van der Waals.
(c) Cấu hình electron lớp ngoài cùng của nguyên tử X có dạng 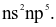
(d) Năng lượng liên kết Cl – Cl lớn nhất trong dãy trên vì Cl có bán kính nguyên tử nhỏ nhất.
Cho các nhận định sau về liên kết hóa học:
(a) Các orbital p vừa có khả năng xen phủ tạo liên kết vừa có khả năng xen phủ tạo liên kết tuỳ thuộc vào kiểu xen phủ.
(b) Liên kết cộng hoá trị không phân cực chỉ có thể tạo thành từ các nguyên tử của cùng một nguyên tố hoá học.
(c) Tất cả các nguyên tử khi tham gia tạo thành liên kết cộng hoá trị đều thoả mãn quy tắc octet.
(d) Hiệu độ âm điện giữa hai nguyên tử càng cao thì liên kết càng phân cực.
Phân tử  có cấu tạo như sau:
có cấu tạo như sau:
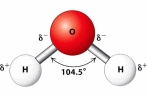
(a) Liên kết H–O là liên kết cộng hoá trị không phân cực.
(b) Cặp electron dùng chung trong liên kết H – O lệch về phía nguyên tử O.
(c) Nguyên tử O còn một cặp electron hoá trị riêng.
(d) Các phân tử H2O có khả năng tạo liên kết hydrogen với nhau.
Khi đun nóng dung dịch sodium chloride bão hòa, thu được tinh thể sodium chloride khan. Sau đó, nung nóng đến khoảng 800 °C thì tinh thể sodium chloride chảy lỏng.
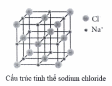
(a) Quá trình hình thành tinh thể sodium chloride ở trên được gọi là sự kết tinh.
(b) Quá trình hình thành tinh thể sodium chloride ở trên là quá trình sắp xếp lại các ion 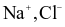 từ chuyển động tự do thành cấu trúc có trật tự trong tinh thể.
từ chuyển động tự do thành cấu trúc có trật tự trong tinh thể.
(c) Trong tinh thể sodium chloride, xung quanh 1 ion 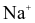 có 6 ion
có 6 ion 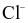 gần nhất.
gần nhất.
(d) Tinh thể sodium chloride nóng chảy ở khoảng 800 °C, chứng tỏ lực liên kết giữa các ion trong tinh thể là yếu.
Nguyên tố X tích luỹ trong tế bào thực vật nên rau và trái cây tươi là nguồn cung cấp tốt nguyên tố X cho cơ thể. Các nghiên cứu chỉ ra khẩu phần ăn chứa nhiều X có thể giảm nguy cơ cao huyết áp và đột quỵ. Nguyên tố Z được dùng để chế tạo dược phẩm, phẩm nhuộm và chất nhạy với ánh sáng. X thuộc loại nguyên tố s, nguyên tử X chỉ có 7 electron ở phân lớp s, nguyên tử Z chỉ có 17 electron ở phân lớp p.
(a) X là sodium (Na), Z là bromine (Br).
(b) Hợp chất tạo bởi X và Z là hợp chất ion.
(c) Khi hình thành liên kết, nguyên tử X có xu hướng nhường 1 electron và nguyên tử Z có xu hướng nhận 1 electron.
(d) Hợp chất tạo bởi X và Z tan tốt trong nước do tạo được liên kết hydrogen.
Liên kết được tạo nên từ sự xen phủ trục của hai AO gọi là liên kết sigma. Liên kết được tạo nên từ sự xen phủ bên của hai AO gọi là liên kết pi.
(a) Các AO s chỉ có khả năng xen phủ tạo liên kết 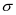 .
.
(b) Các AO p không có khả năng xen phủ tạo liên kết 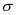 .
.
(c) Liên kết 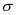 bền vững hơn liên kết
bền vững hơn liên kết 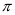 .
.
(d) Liên kết 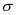 có thể tạo thành từ sự xen phủ trục của hai AO khác loại.
có thể tạo thành từ sự xen phủ trục của hai AO khác loại.
Trong các phát biểu sau, phát biểu nào đúng, phát biểu nào sai?
(a) Độ âm điện của chlorine nhỏ hơn của nitrogen.
(b) Liên kết N – H phân cực hơn liên kết H – Cl.
(c)Bất kì phân tử nào có chứa nguyên tử hydrogen cũng có thể tạo liên kết hydrogen với phân tử cùng loại.
(d)Ảnh hưởng của liên kết hydrogen tới nhiệt độ sôi và nhiệt độ nóng chảy của chất là mạnh hơn ảnh hưởng của tương tác van der Waals.
Trong công thức 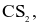 tổng số cặp electron lớp ngoài cùng của C và S chưa tham gia liên kết là?
tổng số cặp electron lớp ngoài cùng của C và S chưa tham gia liên kết là?
Không cần sử dụng hiệu độ âm điện, có bao nhiêu phân tử trong số các phân tử sau có liên kết cộng hóa trị: 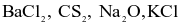 và HI?
và HI?
Có bao nhiêu hợp chất ion trong dãy các chất sau: NH3, CaO, KCl, CH4, NaF, H2?
Tổng số các phân tử không có cực trong số các phân tử sau: 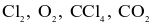 và
và 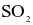 là bao nhiêu?
là bao nhiêu?
Cho số hiệu của nguyên tố N và O lần lượt là 7 và 8. Biết rằng hóa trị của nguyên tố N trong phân từ HNO3 bằng tổng số liên kết 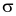 và liên kết
và liên kết  mà nguyên tử N tạo thành khi liên kết với các nguyên tử xung quanh. Trong phân từ HNO3, nguyên tử N không liên kết với nguyên tử H mà liên kết với 3 nguyên tử O. Từ đó viết được công thức Lewis phù hợp của phân tử HNO3 với hóa trị của N là n. Giá trị của n là bao nhiêu?
mà nguyên tử N tạo thành khi liên kết với các nguyên tử xung quanh. Trong phân từ HNO3, nguyên tử N không liên kết với nguyên tử H mà liên kết với 3 nguyên tử O. Từ đó viết được công thức Lewis phù hợp của phân tử HNO3 với hóa trị của N là n. Giá trị của n là bao nhiêu?
Biết độ âm điện của H, Br, C, O và Mg lần lượt là 2,20; 2,96; 2,55; 3,44; 1,31. Trong các chất sau: H2, HBr. CO2, MgO. Số hợp chất ion là?
Cho các phân tử sau: 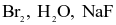 và
và 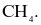 Có bao nhiêu nguyên tử trong các phân tử trên đạt cấu hình electron bền của khí hiếm neon?
Có bao nhiêu nguyên tử trong các phân tử trên đạt cấu hình electron bền của khí hiếm neon?
Cho các chất sau: CO, O3, CO2, HNO3, NH4Cl, NaNO3, H2O2. Số chất có chứa liên kết cho – nhận là?
Nhiệt độ sôi của từng chất methane (CH4), ethane (C2H6), propane (C3H8) và butane (C4H10) là một trong bốn nhiệt độ sau: 0 oC; – 164 oC; – 42 oC và – 88 oC. Dựa trên kiến thức về liên kết hóa học, dự đoán nhiệt độ sôi của ethane là bao nhiêu oC?
Cho các phân tửH2O, NH3, HF, H2S, CO2, HCl. Số phân tử có thể tạo liên kết hydrogen với phân tử cùng loại là?

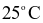 và 1 bar
và 1 bar