Bài tập ôn tập Hóa 10 Cánh diều Chủ đề 4 có đáp án
50 câu hỏi
Số oxi hóa của S trong H2SO4 là
+4.
+6.
–2.
0.
Số oxi hóa của Fe trong hợp chất Fe2O3 là
+2.
+3.
+4.
+6.
Số oxi hóa của C trong K2CO3 là
+2.
+4.
+6.
+8.
Số oxi hóa của S trong hợp chất KAl(SO4)2 là
-2.
+2.
+4.
+6.
Số oxi hóa của N trong ion  là
là
-3.
+2.
+4.
+5.
Số oxi hóa của N trong ion  là
là
-3.
+2.
+4.
+5.
Phản ứng oxi hóa – khử là
phản ứng hóa học giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất.
phản ứng hóa học trong đó một chất sinh ra hai hay nhiều chất mới.
phản ứng hóa học trong đó có sự thay đổi số oxi hóa của ít nhất một nguyên tố hóa học.
phản ứng hóa học trong đó hai hay nhiều chất ban đầu sinh ra một chất mới.
Phản ứng nào sau đây là phản ứng oxi hóa – khử?
CaCO3  CaO + CO2.
CaO + CO2.
BaCl2 + Na2SO4  BaSO4
BaSO4 + 2NaCl.
+ 2NaCl.
NaOH + HCl  NaCl + H2O.
NaCl + H2O.
4Al + 3O2  2Al2O3.
2Al2O3.
Phát biểu nào sau đây là đúng khi nói về chất oxi hóa và chất khử?
Chất khử (chất bị oxi hóa) là chất nhường electron, chất oxi hóa (chất bị khử) là chất nhận electron.
Chất khử (chất bị oxi hóa) là chất nhận electron, chất oxi hóa (chất bị khử) là chất nhường electron.
Chất khử (chất bị oxi hóa) và chất oxi hóa (chất bị khử) đều là chất nhận electron.
Chất khử (chất bị oxi hóa) và chất oxi hóa (chất bị khử) đều là chất nhường electron.
Số oxi hóa của Mn trong KMnO4 là
+1.
+3.
+5.
+7.
Số oxi hóa của nitrogen tăng dần trong dãy nào sau đây?
NH4Cl, N2, NO2, HNO3.
NH3, N2O, N2, NO.
NH4Cl, N2, NO2, NO.
NH3, HNO3, N2, N2O.
Trong phản ứng: CaO + CO2 → CaCO3, carbon dioxide đóng vai trò là
chất oxi hóa.
chất khử.
vừa là chất khử vừa là chất oxi hóa.
không bị oxi hóa cũng không bị khử.
Phương trình hóa học nào thể hiện tính oxi hóa của HCl?
Fe + 2HCl → FeCl2 + H2.
NaOH + HCl → NaCl + H2O.
Al2O3 + 6HCl → 2AlCl3 + 3H2O.
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O.
Cho phương trình hóa học của phản ứng:
Cl2 + 2NaOH  NaCl + NaClO + H2O
NaCl + NaClO + H2O
Trong phản ứng trên, Cl2 đóng vai trò
là chất oxi hóa.
là chất khử.
không là chất oxi hóa, không là chất khử
vừa là chất oxi hóa, vừa là chất khử.
Quá trình nào sau đây là quá trình oxi hóa?
Cl2 + 2e  2
2 .
.
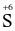 + 2e
+ 2e 
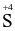 .
.
Cu 
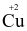 + 2e.
+ 2e.
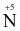 +8e
+8e 
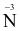 .
.
Cho phương trình hóa học: Mg + HNO3  Mg(NO3)2 + NO
Mg(NO3)2 + NO + H2O. Tổng hệ số của các chất tham gia trong phản ứng trên là
+ H2O. Tổng hệ số của các chất tham gia trong phản ứng trên là
8.
11.
15.
18.
Cho phương trình hóa học: aZn + bH2SO4 (đặc) 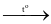 cZnSO4 + dH2S
cZnSO4 + dH2S + fH2O. Giá trị của b trong phương trình hóa học trên là
+ fH2O. Giá trị của b trong phương trình hóa học trên là
5.
4.
3.
2.
Phản ứng HCl + MnO2 → MnCl2 + Cl2 + H2O có hệ số cân bằng của các chất lần lượt là
2, 1, 1, 1, 1.
2, 1, 1, 1, 2.
4, 1, 1, 1, 2.
4, 1, 2, 1, 2.
Cho phản ứng:
KMnO4 + FeSO4 + H2SO4 → Fe2(SO4)3+ K2SO4+ MnSO4+ H2O
Hệ số của chất oxi hóa và chất khử trong phản ứng trên lần lượt là
10 và 2.
1 và 5.
2 và 10.
5 và 1.
Cho phản ứng:
Fe3O4 + HNO3 → Fe(NO3)3 + NO2 + H2O
Quá trình khử trong phản ứng trên là
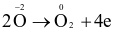 .
.
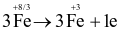 .
.
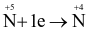 .
.
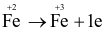 .
.
Dấu hiệu để nhận biết một phản ứng oxi hóa - khử là
có sự thay đổi số oxi hóa của các nguyên tử.
có sự thay đổi trạng thái của chất phản ứng.
có xuất hiện hiện sản phẩm là chất khí.
có xuất hiện sản phẩm là chất kết tủa.
Phản ứng nào sau đây là phản ứng oxi hóa - khử
NaOH + HCl → NaCl + H2O.
FeO + H2SO4 → FeSO4 + H2O.
NH3 + HCl → NH4Cl.
4NH3 + 3O2 → 2N2 + 6H2O.
Trong phản ứng: 3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O, phân tử Cl2 đóng vai trò là
chất oxi hóa.
chất khử.
vừa là chất khử vừa là chất oxi hóa.
chất bị oxi hóa.
Cho các phản ứng sau (ở điều kiện thích hợp):
(a) SO2 + C → CO2 + S
(b) 2SO2 + O2 → 2SO3
(c) SO2 + 2NaOH → Na2SO3 + H2O
(d) SO2 + 2H2S → 3S + 2H2O
(e) SO2 + Br2 + H2O → H2SO4 + 2HBr
Số phản ứng mà SO2 đóng vai trò chất oxi hóa là
2.
3.
4.
5.
Cho phản ứng:
SO2 + Br2 + 2H2O → 2HBr + H2SO4
Trong phản ứng trên, vai trò của Br2 là
chất oxi hóa.
chất tạo môi trường.
chất khử.
chất bị oxi hóa.
Cho phản ứng hoá học: 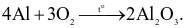 Trong phản ứng trên xảy ra:
Trong phản ứng trên xảy ra:
sự oxi hoá Al và sự khử O2.
sự khử Al và sự oxi hoá O2.
sự oxi hoá Al và sự oxi hoá O2.
sự khử Al và sự khử O2.
Hệ số cân bằng (là các số nguyên, tối giản) của Cu2S và HNO3 trong phản ứng: Cu2S + HNO3 → Cu(NO3)2 + H2SO4 + NO + H2O là
3 và 22.
3 và 18.
3 và 10.
3 và 12.
Tổng hệ số cân bằng (hệ số nguyên, tối giản) của phản ứng: FeS2 + O2 → SO2 + Fe2O3 là
23.
24.
25.
26.
Cho phản ứng:
aFe + bHNO3 → cFe(NO3)3 + dNO + eH2O
Các hệ số a,b, c, d, e là những số nguyên, tối giản. Tổng (a + b) bằng:
5.
4.
3.
6.
Trong phản ứng đốt cháy CuFeS2 tạo ra sản phẩm CuO, Fe2O3 và SO2 thì một phân tử CuFeS2 sẽ
nhận 13 electron.
nhường 13 electron.
nhường 12 electron.
nhận 12 electron.
Cho kim loại Mg vào dung dịch acid sulfuric đặc, nóng xảy ra phản ứng:
Mg + H2SO4 → MgSO4 + SO2 + H2O
(a) Hệ số cân bằng là số nguyên, tối giản của Mg là 2.
(b) Tỉ lệ số phân tử H2SO4 đóng vai trò chất khử : môi trường là 1 : 1.
(c)Một nguyên tử magnesium nhận 2 electron.
(d) Phản ứng được dùng để chứng minh Mg đứng trước H trong dãy hoạt động hóa học.
Cho các phản ứng sau:
(1) S + 2Na 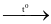 Na2S.
Na2S.
(2) S + 6HNO3 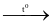 H2SO4 + 6NO2 + 2H2O.
H2SO4 + 6NO2 + 2H2O.
(3) S + 3F2 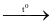 SF6.
SF6.
(4) 4S + 6NaOH(đặc) 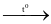 2Na2S + Na2S2O3 + 3H2O.
2Na2S + Na2S2O3 + 3H2O.
(a) Có 2 phản ứng trong các phản ứng trên S chỉ thể hiện tính khử.
(b) Trong phản ứng (4), S vừa có tính khử vừa có tính oxi hóa.
(c) Trong phản ứng (3), S thể hiện tính oxi hóa.
(d) Trong phản ứng (1), S thể hiện tính khử.
Cảnh sát giao thông sử dụng các dụng cụ phân tích rượu ethyl alcohol có chứa CrO3. Khi tài xế hà hơi thở vào dụng cụ phân tích trên, nếu trong hơi thở có chứa hơi rượu thì hơi rượu sẽ tác dụng với CrO3 có màu da cam và biến thành Cr2O3 có màu xanh đen theo phản ứng hóa học sau:
CrO3 + C2H5OH  CO2↑ + Cr2O3 + H2O
CO2↑ + Cr2O3 + H2O
(a) Tỉ lệ cân bằng của phản ứng trên là 4 : 1 : 2 : 2 : 3.
(b) Tỉ lệ chất khử : chất oxi hóa ở phương trình hóa học trên là 1: 4.
(c) Số oxi hóa của carbon trước và sau phản ứng lần lượt là +2 và +4.
(d) Trong phản ứng trên thì CrO3 đóng vai trò là chất khử.
Sulfur dioxide là một chất có nhiều ứng dụng trong công nghiệp (dùng để sản xuất sulfuric acid, tẩy trắng bột giấy trong công nghiệp giấy, tẩy trắng dung dịch đường trong sản xuất đường tinh luyện, …) và giúp ngăn cản sự phát triển của một số loại vi khuẩn và nấm gây hư hại cho thực phẩm. Sulfur dioxide làm mất màu dung dịch thuốc tím theo phương trình sau:
SO2 + KMnO4 + H2O  MnSO4 + K2SO4 + H2SO4
MnSO4 + K2SO4 + H2SO4
(a) Số oxi hóa của Mn trong KMnO4 là +7
(b)Ở phản ứng trên SO2 đóng vai trò là chất oxi hóa.
(c) Ở phản ứng trên MnSO4đóng vai trò là chất khử.
(d) Hệ số tối giản nhất của các chất tham gia ở phản ứng trên theo thứ tự là: 5:2:2.
Cho phản ứng: 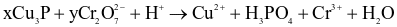 (trong đó x, y là các hệ số nguyên, tối giản). Mỗi phát biểu sau là đúng hay sai?
(trong đó x, y là các hệ số nguyên, tối giản). Mỗi phát biểu sau là đúng hay sai?
(a) Giá trị của x = 6.
(b) Trong Cu3P, số oxi hóa của Cu là +1 và của P là -1.
(c) Cu trong Cu3P bị oxi hóa từ 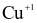 lên
lên 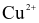 và P trong Cu3P bị oxi hóa từ
và P trong Cu3P bị oxi hóa từ 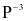 lên
lên 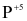 trong
trong 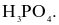
(d) Số electron trao đổi trong quá trình oxi hóa một tiểu phân Cu3P là 11.
Copper(II) sulfate được dùng để diệt tảo, rong rêu trong nước bể bơi; dùng để pha chế thuốc Bordeaux (trừ bệnh mốc sương trên cây cà chua, khoai tây; bệnh thối thân trên cây ăn quả, cây công nghiệp), … Để diệt nấm trên cây cà chua, thuốc Bordeaux được pha với nước theo tỉ lệ 25g/8L nước. Trung bình mỗi ha cây cà chua cần phun khoảng 500 L dung dịch thuốc Bordeaux.
Trong công nghiệp, copper(II) sulfate thường được sản xuất bằng 2 cách:
- Cách 1: Ngâm đồng phế liệu trong dung dịch sulfuric acid loãng và sục không khí:
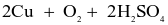 (loãng)
(loãng) 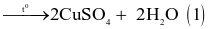
- Cách 2: Cho đồng phế liệu tác dụng với sulfuric acid đặc, nóng:
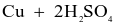 (đặc)
(đặc) 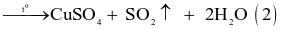
(a) Trong 2 cách trên, cách 1 sử dụng ít sulfuric acid hơn.
(b) Trong 2 cách trên, cách 1 ít gây ô nhiễm môi trường hơn.
(c) Để phun một mảnh vườn rộng 5 ha cần dùng 1,5 kg thuốc Bordeaux.
(d) Trong phản ứng (1): Cu là chất khử, 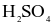 là chất oxi hóa.
là chất oxi hóa.
Trong công nghiệp, sulfuric acid được sản xuất từ quặng pirite sắt có thành phần chính là 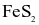 theo sơ đồ sau:
theo sơ đồ sau:
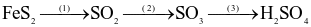
(a) Cả 3 quá trình trên đều xảy ra phản ứng oxi hóa – khử.
(b) Số oxi hóa của Fe trong 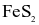 là +2.
là +2.
(c) Trong quá trình (2), 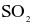 đóng vai trò là chất oxi hóa.
đóng vai trò là chất oxi hóa.
(d) Từ 1 tấn quặng chứa 60% 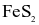 thu được 0,8 tấn
thu được 0,8 tấn 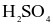 98%. (Cho hiệu suất cả quá trình là 80%).
98%. (Cho hiệu suất cả quá trình là 80%).
Cho sơ đồ phản ứng sau (với x, y, z, t, m, n, p là các số nguyên tối giản của nhau):
xFeSO4 + yK2Cr2O7 + zH2SO4  tCr2(SO4)3 + mFe2(SO4)3 + nK2SO4 + pH2O
tCr2(SO4)3 + mFe2(SO4)3 + nK2SO4 + pH2O
Hòa tan 25,02 gam FeSO4.7H2O trong dung dịch H2SO4 loãng dư thu được dung dịch X. Cho dung dịch X tác dụng với lượng vừa đủ với V mL dung dịch K2Cr2O7 1,47% (D = 1,25 g/mL). Cho các nhận định sau:
(a) Giá trị của V là 240.
(b) Khối lượng H2SO4 đã tham gia phản ứng là 10,29 gam.
(c) Giá trị 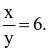
(d) Trong phản ứng trên, FeSO4 đóng vai trò là chất bị khử.
“Calcium chloride dùng trong điện phân để sản xuất calcium kim loại và điều chế các hợp kim của calcium. Với tính chất hút ẩm lớn, calcium chloride được dùng làm tác nhân sấy khí và chất lỏng. Do nhiệt độ đông đặc thấp nên dung dịch calcium chloride được dùng làm chất tải lạnh trong các hệ thống lạnh…. Ngoài ra, calcium chloride còn được làm chất keo tụ trong hóa dược và dược phẩm hay trong các công việc khoan dầu khí.Trong phản ứng tạo thành calcium chloride từ đơn chất: Ca + Cl2 → CaCl2. (Cho nguyên tử khối của Ca = 40)
(a) Trong phản ứng trên thì mỗi nguyên tử chlorine nhường 2e.
(b)Số oxi hóa của Ca và Cl trước phản ứng lần lượt là +2 và -1.
(c) Nếu dùng 4 gam calcium thì số mol electron calcium nhường là 0,8 mol.
(d) Liên kết trong phân tử CaCl2 là liên kết ion.
Cho phản ứng sau:
KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
(a) Trong phản ứng trên HCl là chất bị oxi hóa.
(b) Hệ số của HCl trong phản ứng trên là 5.
(c) Để tạo thành 9,916 lít khí Cl2 (đkc) thì lượng KMnO4 tối thiểu cần dùng là 25,28 gam.
(d) Có thể dùng phản ứng trên để điều chế khí chlorine trong phòng thí nghiệm.
Hòa tan hoàn toàn 6,5 gam Zn bằng dung dịch H2SO4 loãng, thu được V lít H2 (đkc). Giá trị của V là?
Hàm lượng iron(II) sulfate được xác định qua phản ứng oxi hóa – khử với potassium permanganate như sau:
FeSO4 + KMnO4 + H2SO4  Fe2(SO4)3 + K2SO4 + MnSO4 + H2O
Fe2(SO4)3 + K2SO4 + MnSO4 + H2O
Thể tích dung dịch KMnO4 0,02M để phản ứng vừa đủ với 20 mL dung dịch FeSO4 0,10M là bao nhiêu mL?
Thực hiện thí nghiệm xác định công thức của một oxide của kim loại sắt bằng nitric acid đặc, nóng thu được 2,479 lít (đkc) khí màu nâu là nitrogen dioxide. Phần dung dịch đem cô cạn thu được 72,6 gam Fe(NO3)3. Giả sử phản ứng không tạo thành các sản phẩm khác (biết 1 mol khí chiếm 24,79 lít đo ở đkc 25oC, 1bar).Số nguyên tử oxygen có trong một phân tử oxide là?
Dưới tác dụng của các chất xúc tác, glucose lên men tạo thành ethanol:
C6H12O6 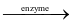 2C2H5OH + 2CO2 (1)
2C2H5OH + 2CO2 (1)
Ethanol sinh ra lên men thành acetic acid:
C2H5OH + O2 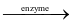 CH3COOH + H2O (2)
CH3COOH + H2O (2)
Giả sử hiệu suất cả quá trình là 60%. Lượng glucose cần dùng để thu được 1 lít acetic acid 1M là bao nhiêu gam?
Cho 8,4 gam Fe phản ứng hoàn toàn với lượng dư dung dịch HNO3, thể tích khí NO (đkc) bay ra là bao nhiêu lít (coi NO là sản phẩm khử duy nhất)? (Làm tròn kết quả đến hàng phần trăm).
| Hướng dẫn giải |
Ion Ca+2 cần thiết cho máu của người hoạt động bình thường. Nồng độ ion calcium không bình thường là dấu hiệu của bệnh. Để xác định nồng độ ion calcium, người ta lấy mẫu máu, sau đó kết tủa ion calcium dưới dạng calcium oxalate (CaC2O4) rồi cho calcium oxalate tác dụng với dung dịch potassium permanganate trong môi trường acid theo phản ứng sau:
KMnO4 + CaC2O4 + H2SO4  CaSO4 + K2SO4 + MnSO4 + CO2 + H2O
CaSO4 + K2SO4 + MnSO4 + CO2 + H2O
Giả sử calcium oxalate kết tủa từ 1 mL máu một người tác dụng vừa hết với 2,05 mL dung dịch potassium permanganate (KMnO4) 4,88.10-4M.
Xác định nồng độ ion calcium trong máu người đó bằng đơn vị mg Ca+2/100 mL máu.
Để xác định hàm lượng ethanol trong máu của người lái xe cần chuẩn độ ethanol bằng K2Cr2O7 trong môi trường acid. Khi đó 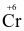 bị khử thành
bị khử thành 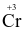 , ethanol (C2H5OH) bị oxi hóa thành acetaldehyde (CH3CHO).
, ethanol (C2H5OH) bị oxi hóa thành acetaldehyde (CH3CHO).
Khi chuẩn độ 25 gam huyết tương máu của một lái xe cần dùng 20 ml dung dịch K2Cr2O7 0,01M. Xác định nồng độ C2H5OH có trong máu của người lái xe này.
Giả sử rằng trong thí nghiệm trên chỉ có ethanol tác dụng với K2Cr2O7. (Làm tròn kết quả đến hàng phần trăm).
Cho potassium iodide (KI) tác dụng với potassium permanganate (KMnO4) trong dung dịch sulfuric acid (H2SO4) thu được 3,02 gam manganese (II) sulfate (MnSO4), I2 và K2SO4. Khối lượng iodine (I2) tạo thành là bao nhiêu gam?
Xét phản ứng trong giai đoạn đầu của quá trình Ostwald:
NH3 + O2 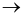 NO + H2O
NO + H2O
Biết trong không khí chứa 21% thể tích oxygen và các thể tích khí đo ở cùng điều kiện nhiệt độ và áp suất. Trong công nghiệp, lượng thể tích không khí cần trộn với 1 thể tích khí ammonia với để thực hiện phản ứng trên là?
Quặng pyrite có thành phần chính là FeS2 được dùng làm nguyên liệu để sản xuất sulfuric acid. Phản ứng xảy ra theo sơ đồ sau: 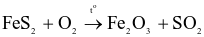
Thể tích không khí (chứa 21% thể tích oxygen, ở điều kiện chuẩn) cần dùng để đốt cháy hoàn toàn 2,4 tấn FeS2 trong quặng pyrite là bao nhiêu m3? (Làm tròn kết quả đến hàng đơn vị)
