Bài tập ôn tập Hóa 10 Cánh diều Chủ đề 2 có đáp án
50 câu hỏi
Số thứ tự của ô nguyên tố bằng
số hiệu nguyên tử.
số neutron.
số lớp electron.
số electron lớp ngoài cùng.
Nguyên tử của nguyên tố neon có 10 electron. Trong bảng tuần hoàn, nguyên tố neon thuộc ô số bao nhiêu?
12.
11.
10.
9.
Trong bảng tuần hoàn các nguyên tố hóa học, tập hợp các nguyên tố hóa học mà nguyên tử của chúng có cùng số lớp electron gọi là
ô nguyên tố.
nhóm.
chu kì.
dãy nguyên tố.
Trong bảng tuần hoàn, nguyên tố chlorine (Cl) nằm ở chu kì 3, nhóm VIIA. Cấu hình electron của Cl là
1s22s22p5.
1s22s22p63s23p5.
1s22s22p63s2.
1s22s22p63s23p3.
Nguyên tử iron (Fe) có Z = 26. Vị trí của Fe trong bảng tuần hoàn là
ô 26, chu kì 4, nhóm IIA.
ô 24, chu kì 4, nhóm VIIIB.
ô 26, chu kì 4, nhóm VIIIB.
ô 26, chu kì 3, nhóm IIA.
Nhóm A gồm những loại nguyên tố nào sau đây?
Nguyên tố s và nguyên tố p.
Nguyên tố d và nguyên tố f.
Nguyên tố s và nguyên tố d.
Nguyên tố p và nguyên tố f.
Các khối nguyên tố d và f đều là
khí hiếm.
phi kim.
phi kim hoặc kim loại.
kim loại.
Nguyên tử aluminium (Al) có số hiệu nguyên tử là 13. Nguyên tố Al là
nguyên tố s.
nguyên tố p.
nguyên tố
nguyên tố f.
Cho các nguyên tố sau: O (Z = 8); F (Z = 9); Na (Z = 11); S (Z = 16). Những nguyên tố thuộc cùng một nhóm là
O, Na và S.
F và Na.
Na và S.
O và S.
Cho các nguyên tố sau: O (Z = 8); C (Z = 6); Mg (Z = 12); Ne (Z = 10). Những nguyên tố thuộc cùng một chu kì là
O, C và Ne.
O, C và Mg.
Mg và Ne.
Mg và Ne.
Độ âm điện (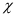 ) là đại lượng đặc trưng cho
) là đại lượng đặc trưng cho
khả năng nhường electron liên kết của một nguyên tử trong phân tử.
khả năng hút electron liên kết của một nguyên tử trong phân tử.
số nguyên tử của một nguyên tố trong phân tử.
khối lượng của nguyên tố trong phân tử.
Trong một nhóm, theo chiều tăng dần điện tích hạt nhân, độ âm điện của các nguyên tử nguyên tố có xu hướng
tăng dần.
giảm dần.
không thay đổi.
giảm sau đó tăng dần.
Cho các nguyên tố: X (Z = 11); Y (Z = 13); T (Z = 17). Độ âm điện của nguyên tử các nguyên tố tăng dần theo thứ tự là:
T < Y < Z.
X < T < Y.
T < X < Y.
X < Y < T.
Phát biểu nào sau đây không đúng?
Trong một nhóm A, theo chiều tăng điện tích hạt nhân, tính kim loại của các nguyên tố có xu hướng tăng dần, tính phi kim của các nguyên tố có xu hướng giảm dần.
Tính kim loại và tính phi kim luôn biến đổi ngược chiều nhau.
Độ âm điện và tính phi kim của các nguyên tử nguyên tố hóa học biến đổi ngược chiều trong một chu kì và một nhóm.
Cs là kim loại mạnh nhất, F là phi kim mạnh nhất.
Nguyên tố Cl ở nhóm VIIA, oxide cao nhất của nguyên tố Cl là
Cl2O3.
Cl2O4.
Cl2O.
Cl2O7.
Oxide nào sau đây vừa có tính acid, vừa có tính base?
Na2O.
Cl2O7.
Al2O3.
MgO.
Công thức hydroxide của nguyên tố Na (Z = 11) và nguyên tố S (Z = 16) lần lượt là
NaOH; H2SO3.
Na(OH)2; H2SO4.
NaOH; H2SO4.
Na(OH)2, H2SO3.
Cho các nguyên tố X, Y, Z có số hiệu nguyên tử lần lượt là 9, 15, 17. Thứ tự tính phi kim tăng dần là
Y, Z, X.
X, Z, Y.
Z, X, Y.
Y, X, Z.
Cho các nguyên tố A, B, C, D có số hiệu nguyên tử lần lượt là 11, 12, 13, 14. Trong các nguyên tố trên, nguyên tố có tính kim loại mạnh nhất là
nguyên tố A
nguyên tố B
nguyên tố C
nguyên tố D
Nguyên tử của nguyên tố chlorine có Z = 17. Hydroxide cao nhất của nguyên tố này có
tính acid mạnh.
tính acid yếu.
tính base mạnh.
tính base yếu.
Nguyên tố X có Z = 19. Công thức oxide và hydroxide cao nhất của X lần lượt là
Na2O, NaOH.
SO3; H2SO4.
K2O; KOH.
KO, K(OH)2.
Nguyên tố X có Z = 9. Hãy có biết tính chất hóa học cơ bản của X (X là kim loại hay phi kim, mạnh hay yếu)?
Tính phi kim yếu.
Tính kim loại yếu.
Tính phi kim mạnh.
Tính kim loại mạnh.
Theo quy luật biến đổi tính chất của các nguyên tố trong bảng tuần hoàn thì
phi kim mạnh nhất là fluorine.
phi kim mạnh nhất là bromine.
kim loại mạnh nhất là lithium.
kim loại yếu nhất là caesium.
Nguyên tố neon có Z = 10. Cấu hình electron nguyên tử của neon là
1s22s22p5.
1s22s22p6.
1s22s22p63s1.
1s22s22p63s2.
Nguyên tử zinc có Z = 30. Vị trí của nguyên tố zinc trong bảng tuần hoàn là
ô 30, chu kì 4, nhóm VIIIB.
ô 30, chu kì 4, nhóm IIB.
ô 30, chu kì 3, nhóm VIIIB.
ô 30, chu kì 3, nhóm IIB.
Nguyên tố sodium thuộc chu kì 3, nhóm IA. Khi tham gia phản ứng hóa học, sodium dễ
nhận 1 electron.
nhường 1 electron.
nhận 2 electron.
nhường 2 electron.
Cation R+ có cấu hình electron ở phân lớp ngoài cùng là 3p6. Vị trí của nguyên tố R trong bảng tuần hoàn là
ô 18, chu kì 3, nhóm IIA.
ô 19, chu kì 4, nhóm IIA.
ô 18, chu kì 3, nhóm VIIIA.
ô 19, chu kì 4, nhóm IA.
Anion X- có cấu hình electron ở phân lớp ngoài cùng là 3p6. Nguyên tố X là
chlorine.
fluorine.
sodium.
potassium.
Nguyên tố Y ở chu kì 3, nhóm IA trong bảng tuần hoàn. Tính chất hóa học cơ bản của Y là
kim loại.
khí hiếm.
phi kim.
base.
Chromium (Cr) và các hợp chất của nó được sử dụng nhiều trong các ngành công nghiệp. Nguyên tố Cr nằm ở ô thứ 24 của bảng tuần hoàn. Mỗi phát biểu sau là đúng hay sai?
(a) Cr có hai phân lớp electron bán bão hòa.
(b) Cr là nguyên tố chu kì 4.
(c) Số electron lớp vỏ ngoài cùng của Cr là 6.
(d) Nguyên tử Cr có 4 lớp electron đã được điền đầy đủ.
Natri (sodium, 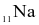 ) và magnesium (
) và magnesium (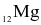 ) thuộc chu kì 3 trong bảng tuần hoàn các nguyên tố hóa học.
) thuộc chu kì 3 trong bảng tuần hoàn các nguyên tố hóa học.
(a) Tính base của sodium hydroxide yếu hơn tính base của magnesium hydroxide.
(b) Dựa vào mức độ phản ứng của Na và Mg với nước ở điều kiện thường, có thể so sánh được độ hoạt động hóa học giữa Na với Mg.
(c) Theo xu hướng biến đổi tính kim loại, Mg có tính kim loại yếu hơn Na.
(d) Khi phản ứng với Cl2, Na và Mg đều tạo ra hợp chất ion.
Xét hai nguyên tố X và Y thuộc cùng chu kì 3 của bảng tuần hoàn. Nguyên tố X có độ âm điện lớn hơn nguyên tố Y. Mỗi phát biểu sau là đúng hay sai?
(a) Bán kính nguyên tử của X lớn hơn Y.
(b) Nếu liên kết X - Y được hình thành, thì cặp electron liên kết sẽ bị lệch về phía nguyên tử X.
(c) Điện tích hạt nhân nguyên tử X nhỏ hơn điện tích hạt nhân nguyên tử Y.
(d) Oxide cao nhất của X sẽ có tính acid mạnh hơn oxide cao nhất của Y.
Cho các nguyên tố X, Y, Z với số hiệu nguyên tử lần lượt là 4, 12, 20.
(a) Bán kính nguyên tử tăng dần từ X < Y < Z.
(b) Thứ tự giảm dần tính base là 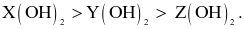
(c) Các nguyên tố này đều là kim loại mạnh nhất trong chu kì.
(d) X, Y, Z là các nguyên tố s và có cấu hình electron dạng 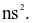
Oxide ứng với hóa trị cao nhất của một nguyên tố R có công thức thực nghiệm là R2O5. Oxide này là một chất hút nước mạnh, được sử dụng trong tổng hợp chất hữu cơ. Hợp chất khí của R với hydrogen có chứa 8,82% khối lượng hydrogen là chất khí không màu, rất độc, kém bền, sinh ra trong quá trình phân hủy xác động thực vật.
(a) Tính phi kim của R mạnh hơn của nguyên tố S (sulfur).
(b) Nguyên tố R thuộc ô số 15, chu kì 3, nhóm VA.
(c) Khi cho 1 mol hydroxide ứng với hóa trị cao nhất của R tác dụng với dung dịch NaOH dư thì số mol NaOH phản ứng là 3.
(d) Trong công thức oxide cao nhất của R thì R chiếm 34,66% về khối lượng.
X là nguyên tố chu kì 2, phân lớp ngoài cùng của nguyên tử nguyên tố X có 3 electron độc thân. Mỗi phát biểu sau là đúng hay sai?
(a) Số electron lớp ngoài cùng của X là 3.
(b) X là nguyên tố nhóm IIIA hoặc IIIB.
(c) X là một kim loại.
(d) Số electron lớp ngoài cùng của X là 5.
Sulfur (S) là chất rắn, xốp, màu vàng ở điều kiện thường. Sulfur và hợp chất của nó được sử dụng trong acquy, bột giặt, thuốc diệt nấm; do dễ cháy nên S còn được dùng để sản xuất các loại diêm, thuốc súng, pháo hoa,….Sulfur là nguyên tố thuộc nhóm VIA, chu kì 3 trong bảng tuần hoàn.
(a) Nguyên tử S có 2 lớp electron và có 6 electron lớp ngoài cùng.
(b) Công thức oxide cao nhất của S có dạng SO3 và là acidic oxide.
(c) Nguyên tố S có tính phi kim mạnh hơn nguyên tố O (Z = 8).
(d) Hydroxide ứng với oxide cao nhất của S có dạng H2SO4 và có tính acid.
Các kim loại X, Y, Z có cấu hình electron nguyên tử lần lượt là 1s22s22p63s1; 1s22s22p63s2; 1s22s22p63s23p1.
(a) X, Y, Z thuộc cùng một nhóm IIIA trong bảng tuần hoàn.
(b) X, Y, Z thuộc chu kì 3 trong bảng tuần hoàn.
(c) Tính kim loại giảm dần theo thứ tự: X, Y, Z.
(d) Z có bán kính nguyên tử lớn nhất trong 3 kim loại.
Nguyên tố X ở ô thứ 17 của bảng tuần hoàn. Cho các phát biểu sau:
(a) X có độ âm điện lớn và là một phi kim mạnh
(b) X có thể tạo thành ion bền có dạng 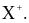
(c) Oxide cao nhất của X có công thức 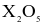 và là acidic oxide.
và là acidic oxide.
(d) Hydroxide của X có công thức 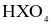 và là acid mạnh.
và là acid mạnh.
Cho 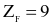 và
và 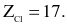 Mỗi phát biểu sau là đúng hay sai?
Mỗi phát biểu sau là đúng hay sai?
(a) Độ âm điện của F cao hơn Cl.
(b) F và Cl là các nguyên tố thuộc cùng một nhóm A.
(c) Công thức oxide cao nhất của F và Cl có dạng 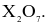
(d) F và Cl nằm ở hai chu kì kế tiếp nhau.
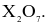 (d) F và Cl nằm ở hai chu kì kế tiếp nhau.
(d) F và Cl nằm ở hai chu kì kế tiếp nhau.Nguyên tử của một nguyên tố X có cấu hình electron: [Ar]4s2. Nguyên tố này là một trong những nguyên tố thiết yếu cho cơ thể, được bổ sung trong các sản phẩm sữa. Cho biết X nằm ở ô bao nhiêu trong bảng tuần hoàn.
X là một nguyên tố chu kì 3, nguyên tử có 5 electron lớp ngoài cùng. Tổng số nguyên tử có trong một phân tử hydroxide cao nhất của X là bao nhiêu?
Phosphorus được dùng vào mục đích quân sự như sản xuất bom, đạn cháy, đạn khói. Nguyên tố phosphorus ở ô số 15, chu kì 3, nhóm VA trong bảng tuần hoàn. Số electron phân lớp ngoài cùng của nguyên tử phosphorus là bao nhiêu?

Cho các phát biểu sau:
(a) Theo quy luật biến đổi tính chất các đơn chất trong bảng tuần hoàn thì phi kim mạnh nhất là fluorine.
(b) Các nguyên tố nhóm A trong bảng tuần hoàn là là các nguyên tố s và nguyên tố p.
(c) Các nguyên tố nhóm IIA, từ Mg đến Ba, theo chiều điện tích hạt nhân tăng, tính kim loại giảm dần.
(d) Các nguyên tố trong cùng một nhóm A có cùng số electron lớp ngoài cùng (trừ He).
(e) Các nguyên tố trong nhóm VA (xét từ N đến Bi), theo chiều điện tích hạt nhân tăng, tính phi kim tăng dần.
(g) Nguyên tố X có cấu hình electron lớp ngoài cùng là 3s23p3. X thuộc nhóm VA.
Số phát biểu đúng là bao nhiêu?
Tổng số hạt proton, neutron và electron trong nguyên tử của nguyên tố X là 10. Xác định vị trí ô của X trong bảng tuần hoàn các nguyên tố hoá học.
Cho 4,8 gam kim loại M thuộc nhóm IIA tác dụng với dung dịch HCl dư, sau phản ứng thu được 4,958 lít khí H2 (đkc). Xác định nguyên tử khối kim loại M.
Trong oxide cao nhất của nguyên tố R thuộc nhóm VIA, nguyên tố oxygen chiếm 60% về khối lượng. Hãy xác định nguyên tử khối nguyên tố R.
Nguyên tố R thuộc nhóm IVA trong bảng tuần hoàn. Hợp chất khí của R với hydrogen có 25% H về khối lượng. R thuộc chu kì mấy trong bảng tuần hoàn?
Xét 3 nguyên tố X, Y, T có số thứ tự và cấu hình electron tương ứng như sau:
X: 1s22s1 (1)
Y: 1s22s22p63s1 (2)
T: 1s22s22p63s23p64s1 (3)
Nguyên tố có tính kim loại yếu nhất có số thứ tự là bao nhiêu?
Độ âm điện của H và N lần lượt là 2,2 và 3,0. Trong phân tử NH3, cặp electron liên kết
sẽ bị lệch về phía nguyên tử H.
không bị lệch về phía nguyên tử nào.
sẽ bị lệch về phía nguyên tử N.
ban đầu bị lệch về phía nguyên tử N, sau đó bị lệch về phía nguyên tử H.
Cho các phi kim: P (Z = 15), O (Z = 8) và S (Z = 16). Phi kim mạnh nhất trong dãy có số hiệu nguyên tử là bao nhiêu?
