Bài tập ôn tập Hóa 10 Cánh diều Chủ đề 1 có đáp án
50 câu hỏi
Nguyên tử được tạo nên từ các hạt cơ bản là
proton, neutron và electron.
proton và neutron.
proton và electron.
neutron và electron.
Trong nguyên tử, hạt nào không mang điện tích?
Proton.
Electron.
Neutron.
Neutron và proton.
Nguyên tử nguyên tố Potassium (K) có 19 proton và 20 neutron. Khối lượng gần đúng của nguyên tử K là (biết me = 0,00055 amu; mp = 1 amu; mn = 1 amu)
29,01 amu.
38,02 amu.
39,01 amu.
32,10 amu.
Tính tổng số proton, neutron và electron trong một phân tử carbon dioxide (CO2). Biết trong phân tử này, nguyên tử C có 6 proton và 6 neutron; nguyên tử O có 8 proton và 8 neutron.
42 hạt.
66 hạt.
60 hạt.
55 hạt.
Các nguyên tử thuộc cùng về một nguyên tố hóa học khi
có cùng số hạt proton.
có cùng số hạt neutron.
có cùng số hạt electron và neutron.
có cùng khối lượng nguyên tử.
Nguyên tử aluminium (Al) có 13 proton và 14 neutron. Kí hiệu nguyên tử của nguyên tố này là
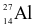 .
.
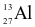 .
.
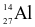 .
.
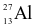 .
.
Cho biết kí hiệu nguyên tử của nguyên tố fluorine là 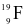 . Số proton, neutron và electron trong nguyên tử fluorine lần lượt là
. Số proton, neutron và electron trong nguyên tử fluorine lần lượt là
9, 9, 10.
9, 10, 9.
10, 9, 9.
9, 19, 9.
Cho các nguyên tử sau: 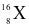 ,
, 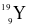 ,
, 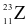 ,
, 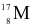 ,
, 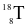 . Những nguyên tử nào là đồng vị của nhau?
. Những nguyên tử nào là đồng vị của nhau?
X, Y, Z.
Y, Z, M.
Y, M, T.
X, M, T.
Nguyên tử khối là
khối lượng tuyệt đối của một nguyên tử.
khối lượng tương đối của một nguyên tử.
tổng số hạt proton, neutron và electron trong nguyên tử.
tổng số proton và electron trong nguyên tử.
Trong tự nhiên, argon có các đồng vị là 40Ar chiếm khoảng 99,604% số nguyên tử; 38Ar chiếm khoảng 0,063% số nguyên tử và 36Ar. Nguyên tử khối trung bình của Ar là
40,265.
38,994.
39,985.
41, 226.
Nguyên tử aluminium có 13 electron. Điện tích hạt nhân của nguyên tử này là
13.
27.
+13.
+27.
Nguyên tử potassium (K) có 19 electron; 19 proton và 20 neutron. Số khối nguyên tử của K là
20.
19.
39.
58.
Số hiệu nguyên tử của một nguyên tố là
điện tích hạt nhân nguyên tử của nguyên tố đó
số đơn vị điện tích hạt nhân nguyên tử của nguyên tố đó
tổng số proton và neutron trong nguyên tử của nguyên tố đó
tổng số proton và electron trong nguyên tử của nguyên tố đó
Theo mô hình nguyên tử Rutherford – Bohr, electron thuộc lớp nào sau đây có năng lượng thấp nhất?
Lớp N.
Lớp L.
Lớp M.
Lớp K.
Số electron tối đa trên lớp L là
4.
6.
2.
8.
Khu vực không gian xung quanh hạt nhân nguyên tử mà xác xuất tìm thấy electron ở khu vực đó là lớn nhất (khoảng 90%) gọi là
lớp vỏ electron.
orbital nguyên tử.
cấu hình nguyên tử.
trọng tâm nguyên tử.
Phát biểu nào sau đây là đúng khi nói về hình dạng của orbital nguyên tử?
AO s hình số tám nổi; AO p hình cầu.
AO s hình vuông; AO p hình cầu.
AO s hình cầu; AO p hình số tám nổi.
AO s hình cầu; AO p hình vuông.
Một AO chỉ chứa tối đa
1 electron.
2 electron.
3 electron.
4 electron.
Nguyên tử sodium có 11 electron. Nguyên tử này có
1 lớp electron.
2 lớp electron.
3 lớp electron.
4 lớp electron.
Nguyên tử magnesium có 3 lớp electron, trong đó lớp ngoài cùng có 2 electron. Số proton trong nguyên tử magnesium là
10.
13.
11.
12.
Nguyên tử nguyên tố X có 8 neutron và có số khối là 16. Lớp ngoài cùng của nguyên tử X có
2 electron.
3 electron.
1 electron.
6 electron.
Lớp electron thứ 3 có bao nhiêu phân lớp và kí hiệu các phân lớp này là gì?
1 phân lớp, kí hiệu là 1s.
2 phân lớp, kí hiệu là 2s và 2p.
3 phân lớp, kí hiệu là 3s, 3p và 3d.
4 phân lớp, kí hiệu là 4s, 4p, 4d và 4f.
Số lượng AO trong mỗi phân lớp s, p, d, f lần lượt là
1, 3, 5, 6.
1, 3, 5, 7.
2, 4, 6, 8.
2, 3, 4, 5.
Kí hiệu 1s2 cho biết
phân lớp 1s có 2 electron.
phân lớp 2s có 1 electron.
phân lớp 1s có 2 AO.
phân lớp 2s có 1 AO.
Phân lớp nào sau đây chưa bão hòa?
1s2.
2p6.
3d8.
4f14.
Nguyên tử K có Z = 19. Cấu hình electron của K là
[Ar]4s1.
[Ar]3d1.
[Ar]4s2.
[Ar]3d2.
Nguyên tử Iron (Fe) có Z = 26. Cấu hình electron của nguyên tử Fe là
[Ar]4s23d6.
[Ar]3d6.
[Ar]3d64s2.
[Ar]4s2.
Nguyên tử sodium (Na) có Z = 11. Cấu hình electron của Na+ là
1s22s22p6.
1s22s22p63s1.
1s22s22p63s2.
1s22s22p5.
Nguyên tử nitrogen (Z = 7) có
2 electron độc thân.
3 electron độc thân.
4 electron độc thân.
1 electron độc thân.
Nguyên tố hydrogen là một trong những nguyên tố phổ biến trong vũ trụ.
(a) Là nguyên tố có đồng vị nhẹ nhất.
(b) Là nguyên tố duy nhất có đồng vị mà hạt nhân chỉ tạo bởi các hạt p.
(c) Nước chỉ tạo nên bởi các đồng vị 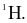
(d) Hydrogen được xem là nguồn năng lượng xanh của tương lai.
Orbital nguyên tử (kí hiệu AO) là khu vực không gian xung quanh hạt nhân nguyên tử mà xác xuất tìm thấy electron trong khu vực đó là lớn nhất (khoảng 90%).
(a) Orbital 1s có dạng hình cầu, orbital 2s có dạnh hình số tám nổi.
(b) Trong một nguyên tử, năng lượng của electron thuộc AO 1s thấp hơn năng lượng của electron thuộc AO 2s.
(c) Trong một nguyên tử, năng lượng của electron thuộc AO 2s thấp hơn nhiều so với năng lượng của electron thuộc AO 2p.
(d) Trong một nguyên tử, năng lượng của electron thuộc AO 2s gần bằng năng lượng của electron thuộc AO 2p.
Một nguyên tử của một nguyên tố có 2 electron ở lớp thứ nhất, 8 electron ở lớp thứ 2 và 8 electron ở lớp thứ 3. Đối với nguyên tử này, mỗi phát biểu sau đúng hay sai?
(a) Tổng số electron trong các orbital s là 2.
(b) Tổng số electron trong các orbital p là 6.
(c) Số hiệu nguyên tử của nguyên tố đó là 18.
(d) Không thể xác định được số lượng neutron trong hạt nhân nguyên tử này.
Cho thí nghiệm bắn phá lá vàng bằng các hạt alpha (ion 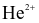 , kí hiệu là α) của Rutherford như sau:
, kí hiệu là α) của Rutherford như sau:
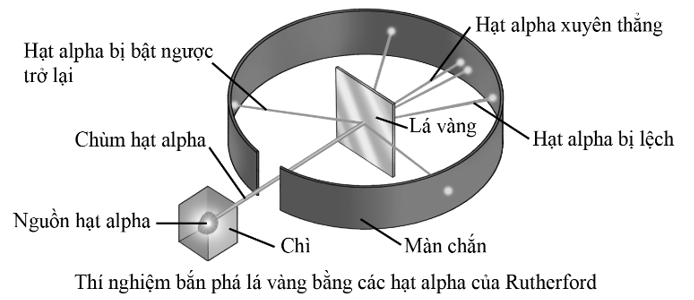
(a) Hầu hết các hạt α xuyên thẳng qua lá vàng.
(b) Nguyên tử hầu như đặc khít.
(c) Không có hạt α nào bị bật ngược trở lại.
(d) Hạt nhân nguyên tử cùng điện tích dương như hạt α.
Khi điền electron vào các lớp và phân lớp trong nguyên tử, mỗi phát biểu sau là đúng hay sai?
(a) Electron được điền đầy hết các lớp bên trong rồi mới tới những lớp bên ngoài.
(b) Thứ tự điền electron theo đúng thứ tự các lớp electron trong nguyên tử.
(c) Mỗi orbital nguyên tử chỉ điền được tối đa 2 electron.
(d) Số lượng electron tối đa có thể điền vào mỗi phân lớp là 2.
Trong lịch sử các thuyết về mô hình nguyên tử có mô hình hành tinh nguyên tử (mô hình Rutherford – Bord) và mô hình hiện đại của nguyên tử.

(a) Với nguyên tử hydrogen, mô hình (1) là mô hình hiện đại, mô hình (2) là mô hình hành tinh nguyên tử.
(b) Khái niệm về xác suất tìm thấy electron xuất phát từ mô hình hành tinh nguyên tử.
(c) Theo mô hình (1), electron chuyển động trên quỹ đạo xác định xung quanh hạt nhân.
(d) Khái niệm về orbital nguyên tử xuất phát từ mô hình hiện đại của nguyên tử.
Nguyên tử R có tổng số hạt cơ bản là 52, trong đó số hạt không mang điện trong hạt nhân gấp 1,059 lần số hạt mang điện tích âm
(a)Cấu hình electron nguyên tử R là 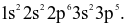
(b) R có số khối là 35.
(c) Nguyên tử R có 7 electron lớp ngoài cùng.
(d) Nguyên tố R là phi kim và có 5 electron độc thân.
Ở trạng thái cơ bản, nguyên tử của một nguyên tố X có 2 electron ở lớp thứ nhất, 8 electron ở lớp thứ hai và 7 electron ở lớp thứ 3.
(a) Số hiệu nguyên tử của nguyên tố X là 17.
(b) X có tổng số electron trong các orbital s là 4.
(c) Các electron ở lớp thứ ba của X phân bố vào 5 AO.
(d) Tổng số electron trong các orbital p của X là 8.
Orbital nguyên tử kí hiệu là AO (viết tắt của cụm từ tiếng anh: Atomic Orbital) là khu vực không gian xung quanh hạt nhân nguyên tử mà xác xuất tìm thấy electron trong khu vực đó là lớn nhất (khoảng 90%).
(a) Mỗi orbital nguyên tử có thể chứa tối đa hai electron.
(b) Orbital 1s, 2s và 3s đều có dạng hình cầu.
(c) Có thể có các orbital khác ngoài orbital s, p.
(d) Các lớp electron khác nhau có cùng một số lượng orbital.
Nguyên tử Fe có kí hiệu nguyên tử 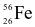 .
.
(a) Nguyên tử của nguyên tố Fe có 8 electron ở lớp ngoài cùng.
(b) Nguyên tử của nguyên tố Fe có 30 neutron ở trong hạt nhân.
(c) Fe là một phi kim.
(d) Fe là nguyên tố khối s.
Nguyên tử của nguyên tố X có tổng số hạt (proton, electron, neutron) là 40, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12. Xác định số khối của nguyên tử X.
X là nguyên tố hóa học có trong thành phần của muối ăn. Nguyên tử X có tổng số các loại hạt bằng 52, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt. Xác định điện tích hạt nhân nguyên tử X.
Nguyên tử helium có 2 proton, 2 neutron và 2 electron. Khối lượng của các electron chiếm bao nhiêu % khối lượng nguyên tử helium? (Làm tròn kết quả đến hàng phần trăm)
Khối lượng riêng của calcium kim loại là 1,55 g/cm3. Giả thiết rằng, trong tinh thể calcium, các nguyên tử là những hình cầu chiếm 74% thể tích tinh thể, phần còn lại là khe rỗng. Cho khối lượng nguyên tử calcium là 40 amu. Tính bán kính nguyên tử calcium theo đơn vị angstrom (Làm tròn kết quả đến hàng phần trăm).
Nguyên tử Fe có bán kính nguyên tử là 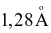 và khối lượng nguyên tử là 55,847 amu. Biết khối lượng riêng của Fe là 7,87 g/cm3, xác định phần trăm thể tích nguyên tử Fe trong tinh thể (Làm tròn kết quả đến hàng đơn vị).
và khối lượng nguyên tử là 55,847 amu. Biết khối lượng riêng của Fe là 7,87 g/cm3, xác định phần trăm thể tích nguyên tử Fe trong tinh thể (Làm tròn kết quả đến hàng đơn vị).
Trong nguyên tử một nguyên tố M có tổng số các loại hạt là 58. Biết trong ion M+ thì số hạt mang điện tích dương ít hơn số hạt không mang điện là 1 hạt. Số hạt neutron có trong M là?
Bằng phương pháp phổ khối lượng, người ta xác định được trong tự nhiên zirconium (kí hiệu Zr) có các đồng vị được thể hiện qua biểu đồ và bảng sau:
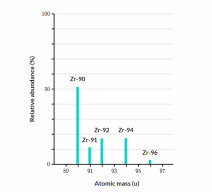
| Khối lượng nguyên tử (amu) | 90 | 91 | 92 | 94 | 96 |
| % đồng vị | 51,45 | 11,22 | 17,15 | 17,38 | 2,8 |
Xác định nguyên tử khối trung bình của zirconium. (Làm tròn kết quả đến hàng phần mười)
Chlorine có hai đồng vị bền 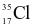 và
và 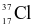 . Nguyên tử khối trung bình của chlorine là 35,5. Nếu có 300 nguyên tử
. Nguyên tử khối trung bình của chlorine là 35,5. Nếu có 300 nguyên tử 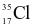 thì số lượng nguyên tử
thì số lượng nguyên tử 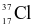 là bao nhiêu?
là bao nhiêu?
Cấu hình electron nguyên tử nguyên tố X là: 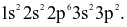 Cho biết số electron độc thân của X ở trạng thái cơ bản?
Cho biết số electron độc thân của X ở trạng thái cơ bản?
Điện tích của một electron là
\( - 1,602 \times {10^{ - 19}}\) C.
\( - 1\) C.
\(1,602 \times {10^{ - 19}}\) C.
\(1\) C.
Nguyên tử nguyên tố X có hai lớp electron, trong đó có một electron độc thân. Có bao nhiêu nguyên tố phù hợp với X?
