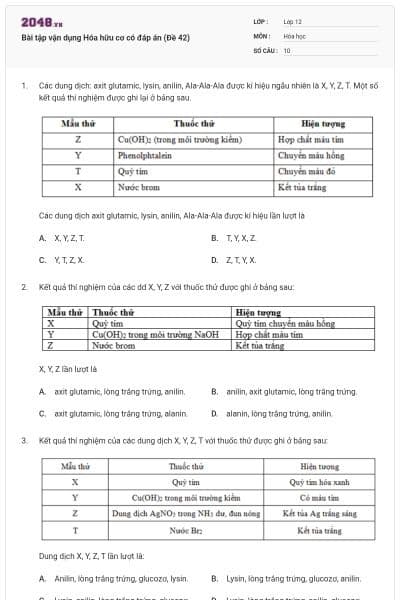
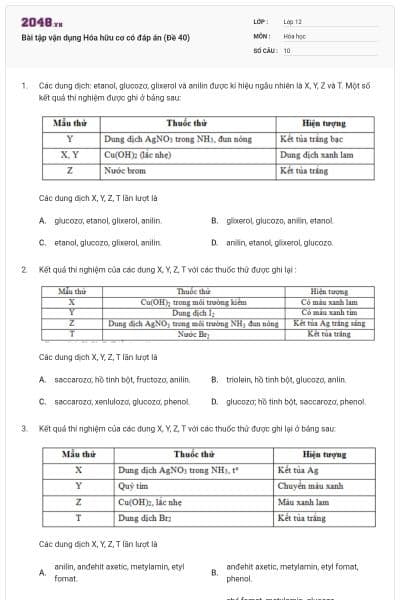
Bài luyện tập số 8
37 câu hỏi
Tiến hành các thí nghiệm sau:
(a) Cho lá Fe vào dung dịch gồm CuSO4 và H2SO4 loãng;
(b) Đốt dây Fe trong bình đựng khí O2;
(c) Cho lá Cu vào dung dịch gồm Fe(NO3)3 và HNO3;
(d) Cho lá Zn vào dung dịch HCl;
Số thí nghiệm có xảy ra ăn mòn điện hoá là
3
2
1
4
Cho các cặp kim loại nguyên chất tiếp xúc trực tiếp với nhau: Fe và Pb; Fe và Zn; Fe và Sn; Fe và Ni. Khi nhúng các cặp kim loại trên vào dung dịch axit, số cặp kim loại trong đó Fe bị phá huỷ trước là
1
3
2
4
Kim loại M bị ăn mòn điện hoá khi tiếp xúc với sắt trong không khí ẩm. M có thể là
Bạc
Đồng
Chì
Kẽm
Tiến hành bốn thí nghiệm sau:
- Thí nghiệm 1: Nhúng thanh Fe vào dung dịch FeCl3;
- Thí nghiệm 2: Nhung thanh Fe vào dung dịch CuSO4;
- Thí nghiệm 3: Nhúng thanh Cu vào dung dịch FeCl3;
- Thí nghiệm 4: Cho thanh Fe tiếp xúc với thanh Cu rồi nhúng vào dung dịch HCl.
Số trường hợp xuất hiện ăn mòn điện hoá là:
1
4
2
3
Thực hiện các thí nghiệm sau:
(1) Thả một viên Fe vào dung dịch HCl.
(2) Thả một viên Fe vào dung dịch Cu(NO3)2.
(3) Thả một viên Fe vào dung dịch FeCl3.
(4) Nối một dây Ni với một dây Fe rồi để trong không khí ẩm.
(5) Đốt một dây Fe trong bình kín chứa đầy khí O2.
(6) Thả một viên Fe vào dung dịch chứa đồng thời CuSO4 và H2SO4 loãng.
Các thí nghiệm mà Fe không bị ăn mòn điện hoá học là:
(1), (3), (5).
(2), (3), (4), (6).
(2), (4), (6).
(1), (3), (4), (5).
Sắt không bị ăn mòn điện hoá khi tiếp xúc với kim loại nào sau đây trong không khí ẩm?
Zn
Sn
Ni
Pb
Có 6 dung dịch riêng biệt: Fe(NO3)3, AgNO3, CuSO4, ZnCl2, Na2SO4, MgSO4. Nhúng vào mỗi dung dịch một thanh Cu kim loại, số trường hợp xảy ra ăn mòn điện hoá là
3
1
4
2
Cho các cặp kim loại tiếp xúc trực tiếp Fe-Pb, Fe-Zn, Fe-Ni, Fe-Cu, nhúng từng cặp kim loại vào dung dịch axit. Số cặp kim loại mà Fe bị ăn mòn trước là:
3
4
1
2
Quá trình xảy ra trong pin điện hoá Fe – Cu và quá trình xảy ra khi nhúng thanh hợp kim Fe – Cu vào dung dịch HCl có đặc điểm chung là:
Đều có khí H2 thoát ra trên bề mặt kim loại Cu
Kim loại Cu bị ăn mòn điện hoá học
Kim loại Fe chỉ bị ăn mòn hoá học
Kim loại Fe đều bị ăn mòn điện hoá học
Trường hợp xảy ra ăn mòn điện hoá là:
Nhúng thanh Fe vào dung dịch chứa hỗn hợp H2SO4 loãng và lượng nhỏ CuSO4
Nhúng thanh Fe vào dung dịch hỗn hợp Fe2(SO4)3 và H2SO4 loãng
Nhúng thanh Fe vào dung dịch Fe2(SO4)3
Nhúng thanh Fe vào dung dịch H2SO4 loãng
Tiến hành bốn thí nghiệm sau:
- Thí nghiệm 1: Nhúng thanh Zn vào dung dịch FeCl3 (dư);
- Thí nghiệm 2: Nhúng thanh Zn vào dung dịch CuSO4;
- Thí nghiệm 3: Nhúng thanh Cu vào dung dịch FeCl3;
- Thí nghiệm 4: Cho thanh Zn tiếp xúc với thanh Cu rồi nhúng vào dung dịch HCl.
Số trường hợp xuất hiện ăn mòn điện hoá là:
1
2
3
4
Số thí nghiệm xảy ra ăn mòn điện hoá trong các thí nghiệm sau là bao nhiêu ?
1. Nhúng thanh Zn vào dung dịch AgNO3.
2. Cho vật bằng gang vào dung dịch HCl.
3. Cho Na vào dung dịch CuSO4
4.Để miếng tôn (Fe trắng Zn) có vết xước sâu ngoài không khí ẩm.
5. Cho đinh sắt vào dung dịch H2SO4 2M.
6. Cho Mg vào dung dịch FeCl3 dư
3
2
4
5
Cho các hợp kim sau: Cu-Fe (I); Zn-Fe (II); Fe-C (III); Sn-Fe (IV). Khi tiếp xúc với dung dịch chất điện li thì các hợp kim mà trong đó Fe đều bị ăn mòn trước là:
I, II và III
I, II và IV
I, III và IV
II, III và IV
Biết rằng ion Pb2+ trong dung dịch oxi hoá được Sn. Khi nhúng hai thanh kim loại Pb và Sn được nối với nhau bằng dây dẫn điện vào một dung dịch chất điện li thì:
Cả Pb và Sn đều bị ăn mòn điện hoá
Cả Pb và Sn đều không bị ăn mòn điện hoá
Chỉ có Pb bị ăn mòn điện hoá
Chỉ có Sn ăn mòn điện hoá
Có 4 dung dịch riêng biệt: a) HCl, b) CuCl2, c) FeCl3, d) HCl có lẫn CuCl2. Nhúng vào mỗi dung dịch một thanh Fe nguyên chất. Số trường hợp xuất hiện ăn mòn điện hoá là
0
1
2
3
Tiến hành bốn thí nghiệm sau:
- Thí nghiệm 1: Nhúng thanh Fe vào dung dịch FeCl3;
- Thí nghiệm 2: Nhúng thanh Fe vào dung dịch CuSO4;
- Thí nghiệm 3: Nhúng thanh Cu vào dung dịch FeCl3;
- Thí nghiệm 4: Cho thanh Fe tiếp xúc với thanh Cu rồi nhúng vào dung dịch HCl. Số trường hợp xuất hiện ăn mòn điện hoá là:
1
2
4
3
Có 4 dung dịch riêng biệt: CuSO4, ZnCl2, FeCl3, AgNO3. Nhúng vào mỗi dung dịch một thanh Ni. Số trường hợp xuất hiện ăn mòn điện hoá là:
2
3
4
1
Trường hợp nào dưới đây, kim loại không bị ăn mòn điện hoá ?
Đốt Al trong khí Cl2
Để gang ở ngoài không khí ẩm
Vỏ tàu làm bằng thép neo đậu ngoài bờ biển
Fe và Cu tiếp xúc trực tiếp cho vào dung dịch HCl
Tiến hành các thí nghiệm sau:
(a) Cho lá Fe vào dung dịch gồm CuSO4 và H2SO4 loãng;
(b) Đốt dây Fe trong bình đựng khí O2;
(c) Cho lá Cu vào dung dịch gồm Fe(NO3)3 và HNO3;
(d) Cho lá Zn vào dung dịch HCl;
Số thí nghiệm có xảy ra ăn mòn điện hoá là:
3
2
1
4
Phát biểu nào dưới đây không đúng ?
Nguyên tắc chung để điều chế kim loại là khử ion kim loại thành nguyên tử kim loại
Bản chất của ăn mòn kim loại là quá trình oxi hoá – khử
Tính chất hoá học đặc trưng của kim loại là tính khử
Ăn mòn hoá học phát sinh dòng điện
Tiến hành các thí nghiệm sau:
a. Cho lá Fe vào dung dịch gồm CuSO4 và H2SO4 loãng;
b. Đốt dây Fe trong bình đựng khí O2;
c. Cho lá Cu vào dung dịch gồm Fe(NO3)3 và HNO3;
d. Cho lá Zn vào dung dịch HCl;
Số thí nghiệm có xảy ra ăn mòn điện hoá là
3
2
1
4
Trường hợp nào sau đây kim loại bị ăn mòn điện hoá học ?
Cho kim loại Zn nguyên chất vào dung dịch HCl
Cho kim loại Cu nguyên chất vào trong dung dịch HNO3 loãng
Thép cacbon để trong không khí ẩm
Đốt dây sắt nguyên chất trong khí O2
Khi vật bằng gang , thép bị ăn mòn điện hoá trong không khí ẩm, nhận định nào sau đây là nhận định đúng
Tinh thể cacbon là cực âm xảy ra quá trình oxi
Tinh thể cacbon là cực dương, xảy ra quá trình oxi hoá
Tinh thể sắt cực dương xảy ra quá trình khử
Tinh thể sắt là cực âm xảy ra quá trình oxi hoá
Tiến hành các thí nghiệm sau:
- Ngâm một lá đồng trong dung dịch AgNO3.
- Ngâm một lá kẽm trong dung dịch HCl loãng.
- Ngâm một lá nhôm trong dung dịch NaOH.
- Ngâm ngập một đinh sắt được quấn một đoạn dây đồng trong dung dịch NaCl.
- Để một vật bằng gang ngoài không khí ẩm.
- Ngâm một miếng đồng vào dung dịch Fe2(SO4)3.
Số thí nghiệm xảy ra ăn mòn điện hoá là:
4
2
3
1
Thực hiện các thí nghiệm sau:
(1) Thả một viên Fe vào dung dịch HCl.
(2) Thả một viên Fe vào dung dịch Cu(NO3)2.
(3) Thả một viên Fe vào dung dịch FeCl3.
(4) Nối một dây Ni vào một dây Fe rồi để trong không khí ẩm.
(5) Đốt một dây Fe trong bính kín chứa đầy khí O2.
(6) Thả một viên Fe vào dung dịch chứa đồng thời CuSO4 và H2SO4 loãng.
Trong các thí nghiệm trên thì thí nghiệm mà Fe không bị ăn mòn điện hoá là
(2), (3), (4), (6)
(1), (3), (4), (5)
(2), (4), (6)
(1), (3), (5)
Vật làm bằng hợp kim Zn-Cu trong môi trường không khí ẩm (hơi nước có hoà tan O2) đã xảy ra quá trình ăn mòn điện hoá. Tại anot xảy ra quá trình
Khử O2
Khử Zn
Ôxi hoá Cu
Ôxi hoá Zn
Thanh sắt nguyên chất và sợi dây thép thường cho vào dung dịch giấm ăn. Thanh sắt và sợi dây thép sẽ bị ăn mòn theo kiểu:
Điện hoá
Đều không bị ăn mòn
Thanh sắt bị ăn mòn hoá học, sợi đây thép bị ăn mòn điện hoá
Hoá học
Trường hợp nào sau đây, kim loại bị ăn mòn điện hoá học ?
Đốt dây sắt trong không khí oxi khô
Kim loại sắt trong dung dịch HNO3 loãng
Kim loại kẽm trong dung dịch HCl
Thép cacbon để trong không khí ẩm
Cho các hợp kim sau: Al - Zn (1); Fe – Zn (2); Zn – Cu (3); Mg – Zn (4). Khi tiếp xúc với dung dịch axit H2SO4 loãng thì các hợp kim mà trong đó Zn bị ăn mòn điện hoá học là
(3) và (4)
(1), (2) và (3)
(2), (3) và (4)
(2) và (3)
“ Ăn mòn kim loại” là sự phá huỷ kim loại do:
Tác dụng hoá học của môi trường xung quanh
Kim loại tác dụng với dung dịch chất điện ly tạo nên dòng điện
Kim loại phản ứng hoá học với chất khí hoặc hơi nước ở nhiệt độ cao
Tác động cơ học
Ngâm một lá Zn tinh khiết trong dung dịch HCl, sau đó thêm vài giọt dung dịch CuSO4 vào. Trong quá trình thí nghiệm trên:
Chỉ xảy ra hiện tượng ăn mòn điện hoá học
Lúc đầu xảy ra hiện tượng ăn mòn điện hoá học sau đó xảy ra thêm hiện tượng ăn mòn hoá học
Lúc đầu xảy ra hiện tượng ăn mòn hoá học sau đó xảy ra thêm hiện tượng ăn mòn điện hoá học
Chỉ xảy ra hiện tượng ăn mòn hoá học
Tiến hành các thí nghiệm sau:
- TN1: Cho hơi nước đi qua ống đựng bột sắt nung nóng.
- TN2: Cho đinh sắt nguyên chất vào dung dịch H2SO4 loãng có nhỏ thêm vài giọt dung dịch CuSO4.
- TN3: Cho từng giọt dung dịch Fe(NO3)2 vào dung dịch AgNO3.
- TN4: Để thanh thép (hợp kim của sắt với cacbon) trong không khí ẩm.
- TN5: Nhúng lá kẽm nguyên chất vào dung dịch CuSO4.
Số trường hợp xảy ra ăn mòn điện hoá học là
3
4
1
2
Nếu vật làm bằng hợp kim Fe-Zn bị ăn mòn điện hoá thì trong quá trình ăn mòn:
Sắt đóng vai trò anot và bị oxi hoá
Kẽm đóng vai trò anot và bị oxi hoá
Sắt đóng vai trò catot và ion H+ bị oxi hoá
Kẽm đóng vai trò catot và bị oxi hoá
Trường hợp nào sau đây xảy ra ăn mòn điện hoá ?
Sợi dây bạc nhúng trong dung dịch HNO3
Đốt lá sắt trong khí Cl2
Thanh nhôm nhúng trong dung dịch H2SO4 loãng
Thanh kẽm nhúng trong dung dịch CuSO4
Tiến hành các thí nghiệm sau đây:
(a) Ngâm một lá kẽm vào dung dịch CuSO4.
(b) Ngâm một lá đồng vào dung dịch FeCl3.
(c) Cho thép cacbon tiếp xúc với nước mưa.
(d) Cho thép vào dung dịch axit clohiđric.
(e) Để sắt tây tiếp xúc với nước tự nhiên.
Trong các thí nghiệm trên có bao nhiêu trường hợp xảy ra ăn mòn điện hoá?
2
5
3
4
Tiến hành các thí nghiệm sau;
(1) Cho lá sắt vào dung dịch HCl có thêm vài giọt CuSO4.
(2) Cho lá sắt vào dung dịch FeCl3.
(3) Cho lá thép vào dung dịch CuSO4.
(4) Cho lá sắt vào dung dịch CuSO4.
(5) Cho lá kẽm vào dung dịch HCl.
Số trường hợp xảy ra sự ăn mòn điện hoá là
4
3
2
1
Cho lá Al vào dung dịch HCl, có khí thoát ra. Thêm vài giọt dung dịch CuSO4 vào thì:
Phản ứng ngừng lại
Tốc độ thoát khí tăng
Tốc độ thoát khí giảm
Tốc độ thoát khí không đổi