41 câu Trắc nghiệm Hóa 12 Cánh diều Chủ đề 8: Sơ lược về kim loại chuyển tiếp dãy thứ nhất và phức chất
41 câu hỏi
Nguyên tố nào sau đây nằm trong chu kì 4 nhưng không thuộc những nguyên tố chuyển tiếp dãy thứ nhất?
đồng (copper).
sắt (iron).
potassium.
nickel.
Vì sao calcium (Z = 20) không phải là nguyên tố chuyển tiếp?
Vì Ca có ít electron hoá trị.
Vì trong cấu hình electron nguyên tử Ca không có phân lớp d chưa bão hoà.
Vì Ca không phải là nguyên tố nhóm B.
Vì trong cấu hình electron nguyên tử Ca không có electron d.
Trong cấu hình electron nguyên tử hoặc cấu hình electron của cation nguyên tố chuyển tiếp dãy thứ nhất phải có
phân lớp 4s chưa bão hoà electron.
phân lớp 3d chưa bão hoà electron.
phân lớp 3d và 4s đều chưa bão hoà electron.
sự điền electron vào phân lớp 3d.
Số hiệu nguyên tử của chromium là 24. Theo các nguyên lí và quy tắc thông thường thì cấu hình electron của nguyên tử chromium được viết ở dạng (I). Tuy nhiên, dựa vào kết quả thực nghiệm về phổ phát xạ của nguyên tử người ta cho rằng nguyên tử chromium phải có 6 electron độc thân, nên cấu hình electron của nguyên tử này được viết ở dạng (II). Dạng (I) và dạng (II) lần lượt là
\(1{s^2}2{s^2}2{p^6}3{s^2}3{p^6}3{d^4}4{s^2}\) và \(1{s^2}2{s^2}2{p^6}3{s^2}3{p^6}3{d^5}4{s^1}.\)
\(1{s^2}2{s^2}2{p^6}3{s^2}3{p^6}3{d^6}\) và \(1{s^2}2{s^2}2{p^6}3{s^2}3{p^6}3{d^4}4{s^2}.\)
\(1{s^2}2{s^2}2{p^6}3{s^2}3{p^6}3{d^6}\) và \(1{s^2}2{s^2}2{p^6}3{s^2}3{p^6}3{d^5}4{s^1}.\)
\(1{s^2}2{s^2}2{p^6}3{s^2}3{p^6}3{d^4}4{s^2}\) và \(1{s^2}2{s^2}2{p^6}3{s^2}3{p^6}4{s^2}4{p^2}4{d^2}.\)
Vì sao kẽm (zinc, Z = 30) không phải là nguyên tố chuyển tiếp?
Vì cấu hình electron của nguyên tử Zn và cấu hình electron của cation Zn2+ có phân lớp d đã bão hoà.
Vì Zn không thuộc nguyên tố chu kì 4.
Vì Zn không phải là nguyên tố nhóm B.
Vì cấu hình electron của nguyên tử Zn có phân lớp d chưa bão hoà.
Một nguyên tố của dãy chuyển tiếp thể hiện nhiều số oxi hoá dương trong các hợp chất khác nhau. Đó là do:
nguyên tử có bán kính lớn và có nhiều electron hoá trị.
nguyên tử có nhiều electron hoá trị, nguyên tố có độ âm điện nhỏ.
nguyên tử có nhiều electron hoá trị, nguyên tố có độ âm điện lớn.
nguyên tử có bán kính lớn, nguyên tố có độ âm điện nhỏ.
M là nguyên tố kim loại chuyển tiếp dãy thứ nhất, có một số đặc điểm sau:
• Có nhiều số oxi hoá trong các hợp chất, trong đó có số oxi hoá +2 và +3.
• Nguyên tử có 4 electron độc thân.
• Ở dạng đơn chất, là kim loại nặng.
M là nguyên tố nào sau đây?
Cr.
Ni.
Fe.
Cu.
M là nguyên tố kim loại chuyển tiếp dãy thứ nhất, có một số đặc điểm sau:
• Nguyên tử M có 1 electron ở lớp ngoài cùng.
• Trong hợp chất, số oxi hoá phổ biến của nguyên tố M là +2.
M là nguyên tố nào sau đây?
Fe.
Ni.
Mn.
Cu.
M là nguyên tố kim loại chuyển tiếp dãy thứ nhất, có một số đặc điểm sau:
• Hợp chất M(II) có tính oxi hoá nên phản ứng được với dung dịch thuốc tím.
• Ion Mcó 5 electron độc thân.
• Là nguyên tố kim loại thuộc nhóm nguyên tố hoá học phổ biến trong tự nhiên.
M là nguyên tố nào sau đây?
Fe.
Ni.
Mn.
Cu.
Phần tử có thể trở thành phối tử trong phức chất là
Anion hoặc phân tử trung hoà có cặp electron hoá trị riêng.
Anion có kích thước lớn.
Phân tử trung hoà có hoặc không có cặp electron hoá trị riêng.
Cation kim loại chuyển tiếp có các orbital trống.
Phần tử có thể trở thành nguyên tử trung tâm trong phức chất khi chúng sử dụng các orbital trống để nhận cặp electron hoá trị riêng từ phối tử. Các phần tử đó là
Tất cả các cation kim loại.
Nguyên tử hoặc cation của một số kim loại.
Các nguyên tử nguyên tố chuyển tiếp dãy thứ nhất.
Các cation kim loại của nguyên tố chuyển tiếp dãy thứ nhất.
Theo thuyết Liên kết hoá trị, tương tác giữa phối tử và nguyên tử trung tâm trong phức chất là
Liên kết cộng hoá trị theo kiểu cho – nhận.
Liên kết ion.
Tương tác van der Waals.
Liên kết hydrogen.
Phức chất có công thức [PtCl2(NH3)2] có cấu tạo như hình bên:
![Phức chất có công thức [PtCl2(NH3)2] có cấu tạo như hình bên: Phát biểu nào dưới đây về phức chất trên là không đúng? (ảnh 1)](https://video.vietjack.com/upload2/quiz_source1/2024/07/blobid0-1720881867.png)
Phát biểu nào dưới đây về phức chất trên là không đúng?
Phức chất có điện tích bằng 0.
Có hai loại phối tử trong phức chất.
Để hình thành phức chất trên thì cation Pt2+ đã dùng 4 orbital trống để nhận các cặp electron hoá trị riêng của các phân tử NH3 và các anion CF.
Nối từng cặp phối tử cạnh nhau ở cấu tạo trên bằng một đoạn thẳng. Bốn đoạn thẳng tạo ra hình dạng của phức chất, đó là hình tứ diện.
Cho phức chất có cấu tạo như hình bên.
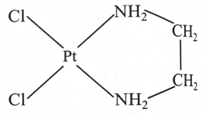
Có bao nhiêu phát biểu đúng trong những phát biểu sau về các phức chất trên?
(a) Điện tích của phức chất bằng 0.
(b) Số liên kết cho – nhận giữa mỗi phối tử với nguyên tử trung tâm là như nhau.
(c) Số oxi hoá của nguyên tử trung tâm trong phức chất là +4.
(d) Tất cả các liên kết trong phức chất đều là liên kết cộng hoá trị.
(e) Theo thuyết Liên kết hoá trị, các liên kết quanh nguyên tử trung tâm là liên kết cộng hoá trị theo kiểu cho - nhận.
2.
3.
4.
5.
Khi hoà tan hợp chất CoCl2 vào nước thì hình thành phức chất aqua có dạng hình học là bát diện. Công thức của phức chất là
\({\left[ {{\rm{Co}}{{\left( {{\rm{O}}{{\rm{H}}_2}} \right)}_6}} \right]^{3 + }}.\)
\({\left[ {{\rm{Co}}{{\left( {{\rm{O}}{{\rm{H}}_2}} \right)}_6}} \right]^{2 + }}.\)
\(\left[ {{\rm{CoC}}{{\rm{l}}_2}{{\left( {{\rm{O}}{{\rm{H}}_2}} \right)}_4}} \right].\)
\({\left[ {{\rm{CoC}}{{\rm{l}}_2}{{\left( {{\rm{O}}{{\rm{H}}_2}} \right)}_4}} \right]^{2 + }}.\)
Khi hoà tan hợp chất AgNO3 vào nước thì thu được dung dịch chứa phức chất tứ diện [Ag(OH2)m]n+ (aq).
Có các phát biểu dưới đây về phức chất [Ag(OH2)m]n+:
(a) có điện tích là +1.
(b) được hình thành từ quá trình cation Ag+ (aq) nhận các cặp electron hoá trị riêng từ các phân tử nước.
(c) có giá trị của m là 4.
(d) bền hơn cation Ag (aq).
Số phát biểu đúng là
1.
2.
3.
4.
Khi vừa hoà tan phèn nhôm - kali có công thức \({{\rm{K}}_2}{\rm{S}}{{\rm{O}}_4} \cdot {\rm{A}}{{\rm{l}}_2}{\left( {{\rm{S}}{{\rm{O}}_4}} \right)_3} \cdot 24{{\rm{H}}_2}{\rm{O}}\) vào nước thu được dung dịch chứa \({{\rm{K}}^ + },{\left[ {{\rm{Al}}{{\left( {{\rm{O}}{{\rm{H}}_2}} \right)}_6}} \right]^{3 + }}\) và \({\rm{SO}}_4^{2 - }\). Sau đó, một phần phức chất aqua chuyền thành phức chất không tan theo phương trình hoá học sau:
Có các phát biểu dưới đây.
(1) Trong dung dịch có diễn ra quá trình phân li và quá trình hình thành phức chất.
(2) Chỉ có nguyên tố chuyển tiếp mới tạo được phức chất aqua.
(3) Giá trị n ở phức chất trong cân bằng (*) là 1.
(4) Trong phản ứng thuận của cân bằng (*), phức chất aqua đóng vai trò acid theo Brønsted - Lowry.
(5) Trong thực tế, sự hình thành phức chất từ phản ứng thuận của cân bằng (*) giúp giải thích ứng dụng làm trong nước của phèn nhôm – kali. Các phát biểu đúng là
(1), (4), (5).
(1), (2), (3).
(3), (5).
(2), (4), (5).
a. Nếu xác định được thể tích của dung dịch thuốc tím đã dùng cho đến điểm tương đương (là y mL) thì tính được số mol của Fe2+ trong dung dịch A.
b. Dung dịch B được cho vào bình tam giác, dung dịch A được rót vào burette.
c. Cần phải sử dụng chất chỉ thị màu để xác định được điểm kết thúc chuẩn độ.
d. Nếu xác định được thể tích của dung dịch thuốc tím đã dùng cho đến điểm tương đương là y mL thì số mol Fe2+ trong dung dịch A là \(\frac{{xy}}{5}\).
a. Mẫu nước trên có pH lớn hơn 7.
b. Ion bị oxi hoá và gây nên hiện tượng trên là \({\left[ {{\rm{Fe}}{{\left( {{\rm{O}}{{\rm{H}}_2}} \right)}_6}} \right]^{2 + }}.\)
c. Trong nước, ion H+ nhận cặp electron từ H2O để tạo thành ion H3O+.
d. Chất màu nâu sinh trong mô tả trên là phức chất có công thức là \(\left[ {{\rm{Fe}}{{({\rm{OH}})}_2}{{\left( {{\rm{O}}{{\rm{H}}_2}} \right)}_4}} \right]\)
a. Biểu thức tính hằng số cân bằng của phản ứng ở thí nghiệm 1 là:
b. Trong thí nghiệm 1, phức chất \({\left[ {{\rm{Cu}}{{\left( {{\rm{O}}{{\rm{H}}_2}} \right)}_6}} \right]^{2 + }}\) bền hơn phức chất \({\left[ {{\rm{CuC}}{{\rm{l}}_4}} \right]^{2 - }}\).
c. Trong thí nghiệm 2, không có dấu hiệu của phản ứng hình thành phức chất.
d. Khi cho dung dịch HCl có nồng độ khoảng 5,3 M vào dung dịch copper(II) sulfate 0,5% thì không quan sát thấy dấu hiệu của phản ứng tạo phức chất [CuCl4]2- .
a. Phản ứng trên là phản ứng giữa acid và base theo quan điểm của Brønsted - Lowry.
b. Phần dung dịch trong ống nghiệm có pH >7.
c. Trong nước, iron(III) sulfate là hợp chất bền.
d. Nếu hoà tan iron(III) sulfate trong ống nghiệm chứa nước và vài giọt dung dịch sulfuric acid loãng thì hạn chế được hiện tượng xuất hiện kết tủa màu nâu.
Số electron hoá trị trong nguyên tử Cr (Z = 24) là bao nhiêu?
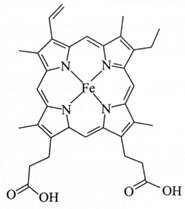
Heme B là phức chất trong hồng cầu có cấu tạo như hình bên. Cho biết trong heme B có bao nhiêu phối tử liên kết với nguyên tử trung tâm.
Cho các chất gồm \(\left[ {{\rm{Ag}}{{\left( {{\rm{N}}{{\rm{H}}_3}} \right)}_2}} \right]{\rm{OH,}}{\left[ {{\rm{Ag}}{{\left( {{\rm{N}}{{\rm{H}}_3}} \right)}_2}} \right]^ + },\)\({\rm{N}}{{\rm{a}}_2}\left[ {{\rm{CuC}}{{\rm{l}}_4}} \right],{\left[ {{\rm{CuC}}{{\rm{l}}_4}} \right]^{2 - }},{\rm{NaF}},{\rm{HN}}{{\rm{O}}_3},{\rm{N}}{{\rm{H}}_3},{\rm{NH}}_4^ + ,{\rm{C}}{{\rm{H}}_3} - {\rm{CO}} - {\rm{C}}{{\rm{H}}_3},\)\({\rm{C}}{{\rm{H}}_3}{\rm{COONa}}\). Trong các chất trên có bao nhiêu chất có liên kết cộng hoá trị theo kiểu cho - nhận?
Cần dùng 22,5 mL dung dịch KMnO4 0,04 M để phản ứng vừa đủ với \(20\;{\rm{mL}}\) dung dịch A gồm \({\rm{F}}{{\rm{e}}^{2 + }}\) (hay \(\left. {{{\left[ {{\rm{Fe}}{{\left( {{\rm{O}}{{\rm{H}}_2}} \right)}_6}} \right]}^{2 + }}} \right),{{\rm{H}}^ + }\)và \({\rm{SO}}_4^{2 - }\). Giá trị nồng độ \({\rm{mol}}\) của \({\rm{F}}{{\rm{e}}^{2 + }}\) trong dung dịch A là bao nhiêu?
Hemoglobin là thành phần cấu tạo nên hồng cầu trong các mạch máu. Mỗi phân tử hemoglobin chứa 4 heme B. Mỗi heme B là phức chất với nguyên tử trung tâm là sắt (iron). Heme B kết hợp thêm một phân tử oxygen thông qua đường hô hấp để vận chuyển dưỡng khí đến mộ.
Mỗi lần đến mô, một phân tử hemoglobin có thể đem đến cho mô tối đa bao nhiêu nguyên tử oxygen?
Số liên kết cộng hoá trị trong phức chất [Ag(NH3)2]OH là bao nhiêu?
Theo thuyết Liên kết hoá trị, có tối đa bao nhiêu orbital trống của cation \({\rm{C}}{{\rm{o}}^{2 + }}\) nhận cặp electron hoá trị đề tạo thành phức chất \({\left[ {{\rm{Co}}{{({\rm{en}})}_2}{{\left( {{\rm{O}}{{\rm{H}}_2}} \right)}_2}} \right]^{2 + }}\) ? Với en là \({{\rm{H}}_2}{\rm{NC}}{{\rm{H}}_2}{\rm{C}}{{\rm{H}}_2}{\rm{N}}{{\rm{H}}_2}\).
Giá trị tuyệt đối của số oxi hoá của nguyên tử trung tâm trong phức chất (NH4)2[PtCL6] là bao nhiêu?
