25 câu hỏi
Trình tự các bước của nhiên liệu và không khí trong buồng lửa hỗn hợp trước:
Nung nóng -> Phản ứng -> Hỗn hợp.
Phản ứng -> Hỗn hợp -> Nung nóng.
Hỗn hợp -> Nung nóng -> Phản ứng.
Tro xuất hiện trong thành phần nào của nhiên liệu?
Chỉ có trong thành phần hữu cơ
Chỉ có trong thành phần cháy
Chỉ có trong trong thành phần khô
Cho phản ứng hóa học: 2A + 3B -> 4C + 5D. Tốc độ phản ứng theo nồng độ chất sản phẩm là:
+[C]/t
-4[C]/t
+1/4[C]/t
+4[C]/t
-1/4 [C]/t
Cho phản ứng hóa học 1A +2B +1C -> 2D + 1E, tốc độ phản ứng: r = k
[D]2[E]1Phát biểu nào sau đây là SAI:
Phản ứng là bậc 1 theo nồng độ chất [A]
Phản ứng là bậc 2 theo đồng độ chất [B]
Phản ứng là bậc 1 theo nồng độ chất [C]
Bậc chung của phản ứng là 3.
Cho tốc độ phản ứng r = k[A][B]3/2, bậc của phản ứng theo A là ..........., bậc của phản ứng theo B là...., bậc chung của phản ứng là.......
0; 3/2, 3/2
1; 3/2; 5/2
1; 3/2; 7/2
1; 3/2; 1
Bậc không thể xác định nếu không có phản ứng hóa học.
Tốc độ ban đầu của phản ứng: 2N2O5(g) ->4NO2(g) + O2 được cho giá trị hằng số tốc độ cho phản ứng này.
|
Thực nghiệm |
[N2O5](M) |
Tốc độ phản ứng (M/s) |
|
1 |
1,28x102 |
22,5 |
|
2 |
2,56x102 |
45,0 |
4.09 𝑠−1
0,176 𝑠−1
0 0569 𝑠−1
0,225 𝑠−1
80,1 𝑠−1
Phương trình Arrhenius được xây dựng dựa trên các yếu tố nào:
Số lượng các hạt va chạm trong một đơn vị thời gian, lượng va chạm và mức năng lượng chạm lớn hơn hoặc bằng năng lượng hoạt hóa.
Thuyết va chạm, sự phân bố các hạt, và mức enthalpy của phản ứng.
Tần suất va chạm và năng lượng của sự va chạm
Độ chênh lệch năng lượng tự do của chất tham gia phản ứng và sản phẩm
Phát biểu nào sau đây ĐÚNG khi tăng nhiệt độ của phản ứng:
Tốc độ phản ứng tăng và hằng số phản ứng tăng.
Năng lượng hoạt hóa tăng và tốc độ phản ứng tăng
Hãng sổ tốc độ tăng và năng lượng hoạt hóa tăng
Cả A, B, C
Nhiệt độ cháy lý thuyết của nhiên liệu phụ thuộc vào:
Nồng độ bụi trong không khí
Nồng độ NOx trong không khí
Nồng độ Oxy trong chất oxy hóa
Vùng hạt nhân của dòng phun tự do rối có đặc điểm:
Vận tốc thay đổi theo đường parabol
Vận tốc thay đổi tuyến tính
Vận tốc không đổi
Cho đồ thị hình 1 biến đổi của phương trình Arrlienius với 02 phản ứng có các mức năng lượng hoạt hóa là Ea1 và Ea2 như sau. So sánh 2 giá trị của 2 mức năng lượng này:
Ea1 < Ea2>
Ea1 > Ea2
Ea1 = Ea2
Chưa đủ thông tin để xác định
Khi đốt cháy khí thiên nhiên trong công nghiệp người ta chọn hệ số không khí thừa là:
0.9 – 1,0
1,0 – 1,1
1,1 – 1,2
Phản ứng phân ly của H2O và CO2 trong buồng đốt diễn ra ở 1600oC. Ảnh hưởng của sự phân ly:
CO2 ⇔ 2CO + O2
2 H2O ⇔ 2H2+ O2
Làm nhiệt độ buồng đốt tăng do là phản ứng thu nhiệt
Làm nhiệt độ buồng đốt tăng do là phản ứng tỏa nhiệt
Làm cho nhiệt độ buồng đốt giảm do là phản ứng thu nhiệt
Làm cho nhiệt độ buồng đốt giảm do là phản ứng tỏa nhiệt
Giả sử xảy ra hiện tượng phân ly của H2O và CO2 trong buồng đốt diễn ra ở 1000 oC. Ảnh hưởng của hệ số không khí (α)
Sự phân ly không bị ảnh hưởng khi thay đổi lượng không khí đưa vào buồng đốt.
Sự phân ly lớn nhất khi α = 1,0.
Sự phân ly nhỏ nhất khi α = 1,0.
Sự phân ly lớn nhất khi α > 1,0 và nhỏ nhất khi α < 1,0
Đồ thị hình 2 – đặc điểm tốc độ quá trình cháy trong buồng lửa như sau.
Phát biểu nào sau đây là đúng
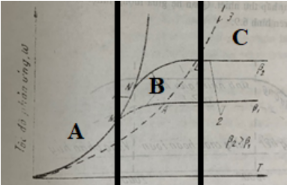
A là vùng động học phản ứng, B-C là vùng khuếch tán.
A là vùng động học phản ứng, C là vùng khuếch tán.
A là vùng khuếch tán, B là vùng chuyển tiếp, C là vùng động học phản ứng.
A - B là vùng động học phản ứng, C là vùng khuếch tán
Nhiệt độ bắt lửa của nhiên liệu khí là:
Nhiệt độ cháy thực tế trong không khí.
Nhiệt độ cháy thực tế trong oxy.
Nhiệt độ bắt đầu phản ứng cháy.
Tỷ lệ NOx sinh ra trong quá trình cháy than phun lớn nhất do
Cơ chế nhiệt.
Cơ chế nhiên liệu
Cơ chế phản ứng tức thời.
Nhiệt độ cháy càng cao NOx sinh ra càng nhiều.
Ở cùng một điều kiện nhiệt độ, áp suất, phản ứng hóa học xảy a giữa các chất càng nhanh nếu phản ứng có năng lượng hoạt hóa
Càng cao.
Càng thấp.
Không thay đổi.
Cả trường hợp a và b đều sai
Tốc độ phản ứng hóa học cuả hai hay nhiều chất tăng dần khi nhiệt độ phản ứng càng tăng, gia tăng tốc độ phản ứng này càng giảm khi:
Nhiệt độ càng tăng.
Nhiệt độ càng giảm.
A và B sai.
Áp suất càng tăng.
Phản ứng phân hủy CO2 thường xảy ra ở điều kiện:
Nhận nhiệt.
Tỏa nhiệt.
Môi trường cháy giàu nhiên liệu và có nhiệt độ cao (trên 1500 oC).
Môi trường oxy hóa ở nhiệt độ cao.
Hệ số không khí thừa (α) của 3 loại nhiên liệu rắn, lỏng, khí của một buồng đốt có cùng công suất thì khẳng định nào sau đây là đúng?
α cháy nhiên liệu khí là cao nhất.
α cháy nhiên liệu lỏng là cao nhất.
Không kết luận được
α cháy nhiên liệu rắn là cao nhất.
Trong thí nghiệm đèn Busen, trường hợp ngọn lửa chỉ có màu xanh điều đó chứng tỏ:
Quá trình cháy thiếu oxi.
Quá trình cháy khuếch tán.
Quá trình cháy có áp suất cao.
Quá trình cháy hỗn hợp trước.
Sự chuyển động của ngọn lửa đèn Busen ở dạng dòng chảy rối khi đó là quá trình cháy nào dưới đây:
Cháy động học.
Cháy khuếch tán.
Không thể kết luận được gì.
Đáp án A và B đúng.
Công nghệ giảm thiểu NOx, trong quá trình cháy thực chất là:
Giảm hệ số không khí thừa.
Tăng hệ số không khí thừa.
Tách NOx ra khỏi sản phẩm cháy.
Kỹ thuật phân cấp không khí hoặc nhiên liệu tối ưu.
Phản ứng dây chuyền có đặc điểm nào dưới đây:
Kích hoạt hóa trị, truyền hóa trị, đứt dây chuyền.
Dây chuyền không phát triển và dây chuyền phát triển.
Cả đáp án A và B.
Ý kiến khác.
