68 bài tập Khoa học tự nhiên 8 Chân trời sáng tạo Bài 9 có đáp án
68 câu hỏi
Phân tử acid gồm có
một nguyên tử kim loại liên kết với một hay nhiều nhóm hydroxide (–OH).
một hay nhiều nguyên tử hydrogen liên kết với gốc acid, các nguyên tử hydrogen này có thể thay thế bằng các nguyên tử kim loại.
một hay nhiều nguyên tử kim loại liên kết với một hay nhiều gốc acid.
một hay nhiều nguyên tử hydrogen liên kết với một nguyên tử phi kim.
Công thức hóa học của acid có gốc acid (= S) và (≡ PO4) lần lượt là:
HS2; H3PO4.
H2S; H(PO4)3.
H2S; H3PO4.
HS; HPO4.
Chất nào sau đây là acid?
HCl.
NaCl.
Ba(OH)2.
MgSO4.
Acid là những chất làm cho quỳ tím chuyển sang màu nào trong số các màu sau đây?
Xanh.
Đỏ.
Tím.
Vàng.
Một chất lỏng không màu có khả năng hóa đỏ một chất chỉ thị thông dụng. Nó tác dụng với một số kim loại giải phóng hydrogen và nó giải phóng khí CO2 khi thêm vào muối hydrocarbonate. Kết luận nào dưới đây là phù hợp nhất cho chất lỏng ban đầu?
Oxide.
Base.
Muối.
Acid.
Dãy chất toàn bao gồm acid là
HCl; NaOH.
CaO, H2SO4.
H3PO4, HNO3, HCl.
NaCl, KOH.
Nhóm các dung dịch nào sau đây có pH < 7?
NaOH, HCl.
HCl, NaOH.
HCl, HNO3.
KOH, NaCl.
Xác định công thức hóa học của acid, biết phân tử acid chỉ chứa 1 nguyên tử S và thành phần khối lượng các nguyên tố trong acid như sau: %H = 2,04%; %S = 32,65%, %O = 65,31%.
H2SO4.
H2SO5.
H2SO3.
H2SO2.
Dãy dung dịch nào dưới đây làm đổi màu quỳ tím thành đỏ?
HCl, H2SO4, H3PO4, HNO3, NaCl.
HCl, H2SO4, Ba(NO3)2, K2CO3, NaOH.
Ba(OH)2, Na2SO4, H3PO4, HNO3, H2SO3.
HCl, H2SO4, H3PO4, HNO3, H3PO3.
Có 3 chất rắn là: Cu, Fe, CuO đựng riêng biệt trong 3 lọ bị mất nhãn. Để nhận biết 3 chất rắn trên, ta dùng thuốc thử là
dung dịch NaOH.
dung dịch CuSO4.
dung dịch HCl.
khí O2.
Chọn câu sai?
Acid luôn chứa nguyên tử H.
Tên gọi của H2S là acid hydro sulfide.
Acid gồm nhiều nguyên tử hydrogen và gốc acid.
Công thức hóa học của acid dạng HnA.
Cho dãy các acid sau: HCl, HNO3, H2SO3, H2CO3, H3PO4, H3PO3, HNO2. Số acid có ít nguyên tử oxygen là
2.
3.
4.
5.
Nitric acid là tên gọi của acid nào sau đây?
H3PO4.
HNO3.
HNO2.
H2SO3.
Hydrochloric acid có công thức hoá học là
HCl.
HClO.
HClO2.
HClO3.
Dãy các gốc acid có cùng hóa trị là
Cl, SO3, CO3.
SO4, SO3, CO3.
PO4, SO4.
NO3, Cl, SO3.
Trong số những chất có công thức hoá học dưới đây, chất nào có khả năng làm cho quỳ tím đổi màu đỏ? 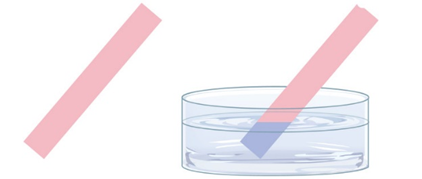
HNO3.
NaOH.
Ca(OH)2.
NaCl.
Oxide tương ứng với acid H2SO3 là
SO2.
SO3.
SO.
CO2.
Cho các chất sau: H2SO4, HCl, NaCl, CuSO4, NaOH, Mg(OH)2. Số chất thuộc loại acid là
1.
2.
3.
4.
Dãy gồm các kim loại tác dụng được với dung dịch H2SO4 loãng là
Fe, Cu, Mg.
Zn, Fe, Cu.
Zn, Fe, Al.
Fe, Zn, Ag.
Nhóm chất tác dụng với nước và với dung dịch HCl là
Na2O, SO3, CO2.
K2O, P2O5, CaO.
BaO, SO3, P2O5.
CaO, BaO, Na2O.
Dãy oxide tác dụng với dung dịch HCl tạo thành muối và nước là
CO2, SO2, CuO.
SO2, Na2O, CaO.
CuO, Na2O, CaO
CaO, SO2, CuO.
Dãy oxide tác dụng với dung dịch H2SO4 loãng là
MgO, Fe2O3, SO2, CuO.
Fe2O3, MgO, P2O5, K2O.
MgO, Fe2O3, CuO, K2O.
MgO, Fe2O3, SO2, P2O5.
Dãy các chất không tác dụng được với dung dịch H2SO4 loãng là
Zn, ZnO, Zn(OH)2.
Cu, CuO, Cu(OH)2.
Na2O, NaOH, Na2CO3.
MgO, MgCO3, Mg(OH)2.
Dãy các chất không tác dụng được với dung dịch HCl là
Al, Fe, Pb.
Al2O3, Fe2O3, Na2O
Al(OH)3, Fe(OH)3, Cu(OH)2.
BaCl2, Na2SO4, CuSO4.
Chất tác dụng với dung dịch HCl tạo thành chất khí nhẹ hơn không khí là
Mg.
CaCO3.
MgCO3.
Na2SO3.
CuO tác dụng với dung dịch H2SO4 tạo thành dung dịch có màu nào?

Dung dịch không màu.
Dung dịch có màu lục nhạt.
Dung dịch có màu xanh lam.
Dung dịch có màu vàng nâu.
Cặp chất tác dụng với nhau tạo thành sản phẩm có chất khí?
Barium oxide và sulfuric acid loãng.
Barium hydroxide và sulfuric acid loãng.
Barium carbonate và sulfuric acid loãng.
Barium chloride và sulfuric acid loãng.
Zinc (Kẽm) tác dụng với dung dịch hydrochloric acid sinh ra?
Dung dịch có màu xanh lam và chất khí màu nâu.
Dung dịch không màu và chất khí có mùi hắc.
Dung dịch có màu vàng nâu và chất khí không màu.
Dung dịch không màu và chất khí cháy được trong không khí.
Chất phản ứng được với dung dịch HCl tạo ra một chất khí có mùi hắc, nặng hơn không khí và làm đục nước vôi trong là
Zn.
Na2SO3.
FeS.
Na2CO3.
Nhóm chất tác dụng với dung dịch H2SO4 loãng sinh ra chất kết tủa màu trắng?
ZnO, BaCl2.
CuO, BaCl2.
BaCl2, Ba(NO3)2.
Ba(OH)2, ZnO.
MgCO3 tác dụng với dung dịch HCl sinh ra chất khí có tính chất gì?
Chất khí cháy được trong không khí.
Chất khí làm vẫn đục nước vôi trong.
Chất khí duy trì sự cháy và sự sống.
Chất khí không tan trong nước.
Dãy chất tác dụng với dung dịch H2SO4 loãng tạo thành dung dịch có màu xanh lam?
CuO, MgCO3.
Cu, CuO.
Cu(NO3)2, Cu.
CuO, Cu(OH)2.
Dùng quỳ tím để phân biệt được cặp chất nào sau đây?
Dung dịch HCl và dung dịch KOH.
Dung dịch HCl và dung dịch H2SO4.
Dung dịch Na2SO4 và dung dịch NaCl.
Dung dịch NaOH và dung dịch KOH.
Để phân biệt 2 dung dịch HCl và H2SO4 loãng. Ta dùng một kim loại là

Mg.
Zn.
Cu.
Ba.
Nhóm chất tác dụng với dung dịch HCl và với dung dịch H2SO4 loãng là
CuO, BaCl2, ZnO.
CuO, Zn, ZnO.
CuO, BaCl2, Zn.
BaCl2, Zn, ZnO.
Dãy các chất tác dụng được với dung dịch H2SO4 loãng tạo thành sản phẩm có chất khí?
BaO, Fe, CaCO3.
Al, MgO, KOH.
Na2SO3, CaCO3, Zn.
Zn, Fe2O3, Na2SO3.
Giấy qùy tím chuyển sang màu đỏ khi nhúng vào dung dịch được tạo thành từ?
0,5 mol H2SO4 và 1,5 mol NaOH.
1 mol HCl và 1 mol KOH.
1,5 mol Ca(OH)2 và 1,5 mol HCl.
1 mol H2SO4 và 1,7 mol NaOH.
Thuốc thử dùng để nhận biết 3 dung dịch: HCl, HNO3,H2SO4 đựng trong 3 lọ khác nhau đã mất nhãn. Các thuốc thử dùng để nhận biết được chúng là
Dung dịch AgNO3 và giấy quỳ tím.
Dung dịch BaCl2 và dung dịch AgNO3.
Dùng quỳ tím và dung dịch NaOH.
Dung dịch BaCl2 và dung dịch phenolphthalein.
Kim loại X tác dụng với HCl sinh ra khí hydrogen. Dẫn khí hydrogen qua oxide của kim loại Y đun nóng thì thu được kim loại Y. Hai kim loại X và Y lần lượt là
Cu, Ca.
Pb, Cu.
Pb, Ca.
Ag, Cu.
Khi cho từ từ dung dịch NaOH cho đến dư vào ống nghiệm đựng dung dịch hỗn hợp gồm HCl và một ít phenolphthalein. Hiện tượng quan sát được trong ống nghiệm là
Màu đỏ mất dần.
Không có sự thay đổi màu.
Màu đỏ từ từ xuất hiện.
Màu xanh từ từ xuất hiện.
Cho 300 ml dung dịch HCl 1M vào 300 ml dung dịch NaOH 0,5M. Nếu cho quỳ tím vào dung dịch sau phản ứng thì quỳ tím chuyển sang?
Màu xanh.
Không đổi màu.
Màu đỏ.
Màu vàng nhạt.
Khi trộn lẫn dung dịch X chứa 1 mol HCl vào dung dịch Y chứa 1,5 mol NaOH được dung dịch Z. Dung dịch Z làm quỳ tím chuyển sang màu gì?
Màu đỏ.
Màu xanh.
Không màu.
Màu tím.
Cho phản ứng: BaCO3 + 2X H2O + Y + CO2
X và Y lần lượt là
H2SO4 và BaSO4.
H2SO4 và BaCl2.
H3PO4 và Ba3(PO4)2.
H2SO4 và BaCl2.
Trung hòa 200 ml dung dịch H2SO4 1M bằng 200 gam dung dịch NaOH 10%. Dung dịch sau phản ứng làm quỳ tím chuyển sang màu gì?
Đỏ.
Vàng nhạt.
Xanh.
Không màu
Dung dịch A có pH < 7 và tạo ra kết tủa khi tác dụng với dung dịch Barium nitrate (Ba(NO3)2). Chất A là?
HCl.
Na2SO4.
H2SO4.
Ca(OH)2.
Thuốc thử dùng để nhận biết 4 chất: HNO3, Ba(OH)2, NaCl, NaNO3 đựng riêng biệt trong các lọ mất nhãn là
Dùng quỳ tím và dung dịch Ba(NO3)2.
Dùng dung dịch phenolphthalein và dung dịch AgNO3.
Dùng quỳ tím và dung dịch AgNO3.
Dùng dung dịch phenolphthalein và dung dịch Ba(NO3)2.
Dùng thuốc thử nào sau đây để nhận biết các chất chứa trong các ống nghiệm mất nhãn: HCl, KOH, NaNO3, Na2SO4.
Dùng quỳ tím và dung dịch CuSO4.
Dùng dung dịch phenolphthalein và dung dịch BaCl2.
Dùng quỳ tím và dung dịch BaCl2.
Dùng dung dịch phenolphthalein và dung dịch H2SO4.
Cho 4,8 gam kim loại magnessium tác dụng vừa đủ với dung dịch sulfuric acid. Thể tích khí hydrogen thu được ở điều kiện chuẩn là
49,58 lít.
4,958 lít.
2,479 lít.
24,79 lít.
Cho 0,1 mol kim loại Zinc vào dung dịch HCl dư. Khối lượng muối thu được là
13,6 g.
1,36 g.
20,4 g.
27,2 g.
Gốc acid của acid HNO3 có hóa trị mấy?
II.
III.
I.
IV.
Hãy viết các phương trình hóa học của phản ứng trong mỗi trường hợp sau:
a) Magnessium oxide và acid nitric;
b) Copper(II) oxide và acid chloride;
c) Aluminium oxide và sulfuric acid;
d) Iron và hydrochloric acid;
e) Zinc và sulfuric acid loãng.
Có những chất sau: CuO, Mg, Al2O3, Fe(OH)3, Fe2O3. Hãy chọn một trong những chất đã cho tác dụng với dung dịch HCl sinh ra:
a) Khí nhẹ hơn không khí và cháy được trong không khí.
b) Dung dịch có màu xanh lam.
c) Dung dịch có màu vàng nâu.
d) Dung dịch không có màu.
Bằng thí nghiệm hoá học, hãy chứng minh rằng trong thành phần của acid chloride có nguyên tố hydrogen.
Cho biết gốc acid và tính hoá trị của gốc acid trong các acid sau: H2S, HNO3. H2SO4, H2SiO3, H3PO4.
Cho 10 gam hỗn hợp bột hai kim loại đồng và sắt. Hãy giới thiệu phương pháp xác định thành phần phần trăm (theo khối lượng) của mỗi kim loại trong hỗn hợp theo:
a) Phương pháp hóa học. Viết các PTHH xảy ra.
b) Phương pháp vật lí.
(Biết rằng đồng không tác dụng với dung dịch acid HCl, H2SO4 loãng).
Cho 2,4 gam Mg vào dung dịch chứa 19,6 gam H2SO4.
a) Thể tích khí H2 thoát ra ở điều kiện chuẩn.
b) Tính khối lượng chất dư sau phản ứng.
c) Gọi tên và tính khối lượng muối tạo ra.
Cho một lượng bột iron dư vào 200 ml dung dịch acid H2SO4. Phản ứng xong thu được 4,958 lít khí hydrogen (điều kiện chuẩn).
a) Viết phương trình phản ứng hoá học.
b) Tính khối lượng iron đã tham gia phản ứng.
c) Tính nồng độ mol của dung dịch acid H2SO4 đã dùng.
Nhận biết các chất sau bằng phương pháp hóa học: Na2SO4, HCl, H2SO4, NaCl. Viết phương trình phản ứng (nếu có).
a) Trình bày tính chất hóa học của acid. Viết phương trình hóa học minh họa.
b) Hãy giải thích vì sao trong bất cứ hoàn cảnh nào cũng không được cho acid đậm đặc vào nước.
Phân biệt Al, Fe, Cu bằng 1 acid?

 Kim loại Al Kim loại Fe Kim loại Cu
Kim loại Al Kim loại Fe Kim loại Cu
Acid dạ dày rất cần cho việc tiêu hoá thức ăn. Tuy nhiên nếu dư thừa acid có thế tăng nguy cơ gây các vấn đề khác như trào ngược, viêm loét, xuất huyết dạ dày, ... thậm chí là ung thư dạ dày. Vì sao người mắc bệnh dạ dày thường được bác sĩ khuyên không nên sử dụng thức ăn có vị chua?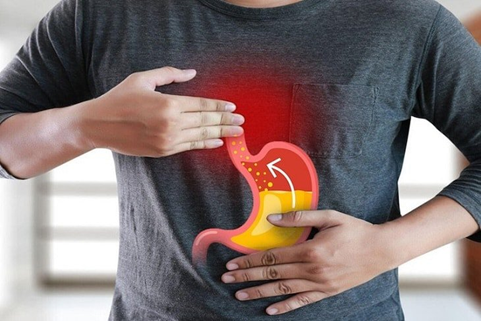
Hãy tìm hiểu trong sách báo hay internet, cho biết thành phần của giấm ăn có chứa acid nào và một số ứng dụng của giấm ăn trong đời sống?
Một trong những hoá chất được sử dụng rộng rãi trong cuộc sống cũng như trong các ngành công nghiệp sản xuất đó là acid. Các acid khác nhau nhưng vẫn có những tính chất hoá học giống nhau, đó là những tính chất gì? Acid có những ứng dụng nào trong đời sống, sản xuất?
a) Khi phân tử hydrogen chloride tan trong nước đã xảy ra quá trình gì?
b) Thành phần phân tử của các chất trong hình bên dưới có điểm gì giống nhau?
c) Phân tử nào trong các phân tử sau đây là acid và có thể tạo ra ion H+ khi tan trong nước: KCl, H2SO3, HClO4?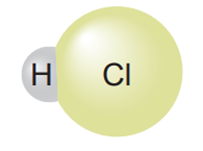
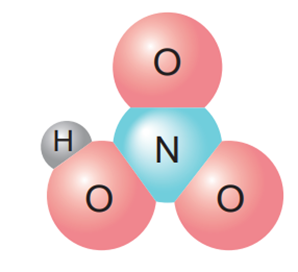
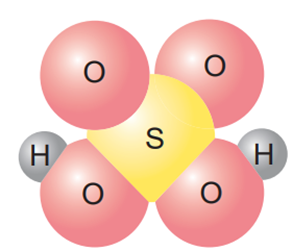 a) Phân tử HCl b) Phân tử HNO3 c) Phân tử H2SO4
a) Phân tử HCl b) Phân tử HNO3 c) Phân tử H2SO4
a) Bằng cách đơn giản nào ta có thể nhận biết dung dịch có tính acid?
b) Dự đoán hiện tượng và viết phương trình hoá học khi cho một lá nhôm vào dung dịch H2SO4 loãng.
Cho các chất: Mg, CuO, Al2O3, Fe(OH)3, BaCl2.
a) Viết các PTHH xảy ra khi cho các chất trên lần lượt tác dụng với dung dịch HCl, H2SO4 loãng.
b) Hãy cho biết, trong các chất trên chất nào khi tác dụng với HCl, H2SO4 loãng sinh ra:
Khí nhẹ hơn không khí và cháy được trong không khí.
− Dung dịch có màu xanh lam.
− Dung dịch có màu vàng nâu.
− Dung dịch không màu.
− Chất kết tủa trắng không tan trong nước và acid.
Bằng phương pháp hóa học hãy nhận biết các dung dịch sau:
a) Dung dịch hydrochloric acid và dung dịch sulfuric acid.
b) Dung dịch sodium nitrate và dung dịch sodium sulfate.
c) Dung dịch sodium hydroxide, dung dịch sodium chloride, dung dịch nitric acid và dung dịch sulfuric acid.
Cho sắt dư vào 50 ml dung dịch HCl, sau phản ứng thu được 3,7185 lít khí (ở đkc).
a) Viết các PTHH xảy ra.
b) Tính khối lượng sắt đã tham gia phản ứng.
c) Tính nồng độ mol của dung dịch HCl đã dùng.
